复方双参颗粒中人参皂苷含量测定
姜丽萍,侯会芳,王振波,李桂荣,尚金燕,姜志辉*,黄建军*
(1.天参密码药业股份有限公司,威海264211;2.山东药品食品职业学院,威海264210;3.山东大学(威海)海洋学院,威海264209)
人参来源于五加科人参属植物人参Panax ginseng C.A.Mey.的干燥根,主产于我国东北,尤以吉林省产量最大,质量最佳,是我国传统的珍贵药材。人参大补元气,复脉固脱,补脾益肺,生津养血,安神益智。根据加工方法不同,分为鲜人参、生晒参、红参等产品。人参是百草之王,红参是人参的熟用品,具有大补元气,复脉固脱,益气摄血功效。红参的加工方法是用人参经过浸润、清洗、分选、蒸制、烘干等工序加工而成。红参在蒸制过程中,因为热处理会发生化学反应,成份上发生变化,生成红参特有的生理活性物质,例如人参皂苷-Rg3、Rh2等抗癌活性成分,具有抑制癌细胞增长的作用。在补虚方面红参强于白参,久服红参可以补气、益血、生津、强心、补脾健胃、益肺、提高人体免疫力、抗氧化、抗疲劳、抗衰老、抗辐射、抑制肿瘤、调整人体内分泌系统。在癌症手术后,红参还能够减轻放化疗后产生的许多毒副作用。
海参属于海参纲(Holothuroidea),是生活在海边至8000米的海洋棘皮动物,距今已有6亿多年的历史,海参以海底藻类和浮游生物为食。海参全身长满肉刺,广布于世界各海洋中。中国南海沿岸种类较多,约有二十余种海参可供食用。海参同人参、燕窝、鱼翅齐名,是世界八大珍品之一。海参不仅是珍贵的食品,也是名贵的药材。据《本草纲目拾遗》中记载:海参,味甘咸,补肾,益精髓,摄小便,壮阳疗痿,其性温补,足敌人参,故名海参。海参具有提高记忆力、延缓性腺衰老,防止动脉硬化以及抗肿瘤等作用。
将人参、海参等以营养学和中医药学为基础,通过现代科学技术研发具有改善记忆、预防老年痴呆、抗衰老等营养保健作用的双参颗粒功能食品。由于人参皂苷是人参的标志性成分,也是主要活性成分,所以双参颗粒以人参皂苷含量作为其质量标准之一。
目前有许多检测人参皂苷的方法。本文采用药典方法、国家农业行业标准NY/T1842-2010,《保健食品检验与评价技术规范手册》2003版检验方法和红参分等质量GB/T 22538-2018检验方法测定样品中人参皂苷-Rg1、人参皂苷-Re、人参皂苷-Rb1和总皂苷含量,以比较4种检验方法测定人参皂苷含量的高低,为食品、保健食品和药品企业含有人参的产品制定企业标准提供参考数据[1~13]。
1 实验材料、仪器与试剂
1.1 实验材料
天参密码高丽红参(将进口韩国高丽鲜人参,采用韩国红参加工工艺和中国红参加工技术相结合制备而成),配伍威海产海参、昆布、核桃、黑豆、黑芝麻、燕麦、胡萝卜、无花果、大枣、适量麦芽糊精通过现代科学技术研发制备为双参颗粒。
1.2 仪器
UltiMate3000高效液相色谱仪,包括:四元泵,在线脱气机,柱温箱,UV检测器,化学工作站(Chromeleon TM变色龙工作站);UV-1810紫外可见分光光度计(北京普析通用仪器有限责任公司);索氏提取器。
1.3 试剂
乙腈(美国Fisher公司,色谱纯),其他试剂为分析纯。人参皂苷对照品人参皂苷-Rg1,批号:110703-201529,纯度:95.0%、人参皂苷-Re,批号:110754-201525,纯度:92.3%、人参皂苷-Rb1,批号:110704-201424纯度为93.7% (购于中国食品药品检定研究院)、D-101大孔吸附树脂;3cmAmberlite-XAD-2大孔树脂、中性氧化铝,乙醇、甲醇、正丁醇、香草醛-冰乙酸溶液、高氯酸、冰乙酸、硫酸、乙醚(均为分析纯)。
2 方法
2.1 药典方法
2.1.1 人参皂苷-Rg1、人参皂苷-Re、人参皂苷-Rb1的含量测定(按照高效液相色谱法测定)
2.1.1.1 色谱条件与系统适用性实验
以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相A,以水为流动相B,按下表中的 规定进行梯度洗脱;检测波长为203nm。理论板数按人参皂苷Rg1峰计算应不低于6000。

时间(min) 流动相A(%) 流动相B(%)0~35 19 81 35~55 19→29 81→71 55~70 29 71 70~100 29→40 71→60
2.1.1.2 对照品溶液的制备
分别取人参皂苷Rg1对照品、人参皂苷Re对照品、人参皂苷Rb1对照品,加甲醇制成每1mL中含人参皂苷Rg1 0.5mg、人参皂苷Re 0.3mg、人参皂苷Rb1 0.5mg的混合溶液,即得。
2.1.1.3 供试品溶液的制备
取本品粉末约1g,精密称定,置索氏提取器中,加三氯甲烷适量,加热回流3h,弃去三氯甲烷液,药渣挥干溶剂,连同滤纸筒移入具塞锥形瓶中,精密加入水饱和正丁醇50mL,密塞,放置过夜,超声处理 (功率250W,频率50kHz)30min,滤过。精密量取续滤液25mL,置蒸发皿中蒸干,残渣加甲醇溶解,转移至5mL容量瓶中,加甲醇至刻度,摇匀,滤过,取续滤液,即得。
2.1.1.4 方法学考察
a.线性关系的考察
吸取上述对照品溶液,分别进样 2、4、8、10、12μL,按上述色谱条件进行HPLC分析,以峰面积和进样质量进行线性回归,人参皂苷Rb1线性方程为Y=603105 X+74303.3(R=0.9989,n=5),人参皂苷 Rg1 线性方程为 Y=681792 X+47625.1(R=0.9991,n=5),人参皂苷Re线性方程为Y=821967X+27568.0(R=0.9993,n=5),结果表明人参皂苷Rb1在2~12μg与峰面积具有良好的线性关系,人参皂苷Rg1在2~12μg与峰面积具有良好的线性关系,人参皂苷Re在2~12μg与峰面积具有良好的线性关系。
b.精密度实验的考察
精密吸取人参皂苷 Rb1、Rg1、Re对照品溶液(1.0mg/mL)10μL,重复进样5次,测定人参皂苷Rb1、Rg1、Re峰面积,得其 RSD分别为 1.06%、1.14%、1.25%。实验结果表明,实验设备具有良好的精密度
c.稳定性实验的考察
取双参颗粒样品,按上述制备方法制备供试品溶液,进样10μL,每隔2h测定1次,样品中人参皂苷Rb1、Rg1、Re峰面积的 RSD 分别为 1.48%、1.67%、1.13%(n=5)。实验结果表明,样品在8h内稳定。
d.重现性实验
取双参颗粒样品,按上述制备方法,重复制备5份供试品溶液,分别测定,结果中人参皂苷Rb1、Rg1、Re质量分数的RSD分别为1.85%、1.48%、1.42%。实验结果表明,该实验方法重现性良好。
e.回收率实验
采取加样回收法。精密称取5份双参颗粒样品2.000g,分别加入一定量的人参皂苷Rb1、Rg1、Re对照品,制备供试品溶液,进行测定,计算得人参皂苷Rb1、Rg1、Re平均回收率分别为 100.17%、99.06%和98.65%,RSD分别为1.53%、1.81%和1.36%(n=5),表明结果准确可靠。
2.1.1.5 样品测定 取3批双参颗粒样品,按上述方法制备供试品溶液,分别精密吸取对照品溶液10μL与供试品溶液10μL,注入液相色谱仪,在上述选定的色谱条件下进行分析,将其峰面积代入相应的回归方程,并计算 Rb1、Rg1、Re的含量。
2.2 中华人民共和国农业行业标准(NY/T 1842-2010)方法
2.2.1 人参皂苷-Rg1、人参皂苷-Re、人参皂苷-Rb1的含量测定
2.2.1.1 对照品溶液的制备
准确称取 Rg10.163 g、Re 0.183 g、Rb10.255 g(精确至0.0001 g)人参皂苷对照品,置于100 mL容量瓶中,用甲醇定容,配制成质量浓度为 1.6、1.8、2.5 g/L的混合标准溶液,贮存在-18℃以下冰箱中,有效期6个月。
2.2.1.2 供试品溶液的制备
准确称取样品2 g(精确至 0.001 g),加入100 mL乙醚于索氏提取器中,提取1 h,弃去乙醚,待残渣中乙醚挥干后,再加入甲醇回馏8 h。回流后提取液在60°C水浴条件下,经旋转蒸发仪减压浓缩至近干,氮气吹干,加入4 mL去离子水充分摇匀。
2.2.1.3 SPE C18柱的预处理
先用20 mL去离子水淋洗,然后用20 mL的甲醇对SPE C18柱进行活化,再用20 mL去离子水平衡。待水与柱筛板近平时上样。取2 mL注入预先活化好的SPE C18柱中,待液面与柱筛板近平时,倒人10 mL去离子水淋洗SPE C18柱,弃去流出液,待淋洗液液面与柱筛板近平时,加入25 mL乙醇溶液(70%)洗脱SPE C18柱,收集洗脱液于50 mL刻度试管中,氮气吹至25 mL以下,用甲醇定容至25 mL,混匀后,用 0.2 μm滤膜过滤,待测。
2.2.1.4 测定
a.仪器参考条件
色谱柱:C18(4.6mm X 300mm X 0.5 μm),流动相:甲醇十水,柱温:47℃,流速:0.8 mL/min检测波长:202nm,进样量:10μL,梯度洗脱程序见表 1。
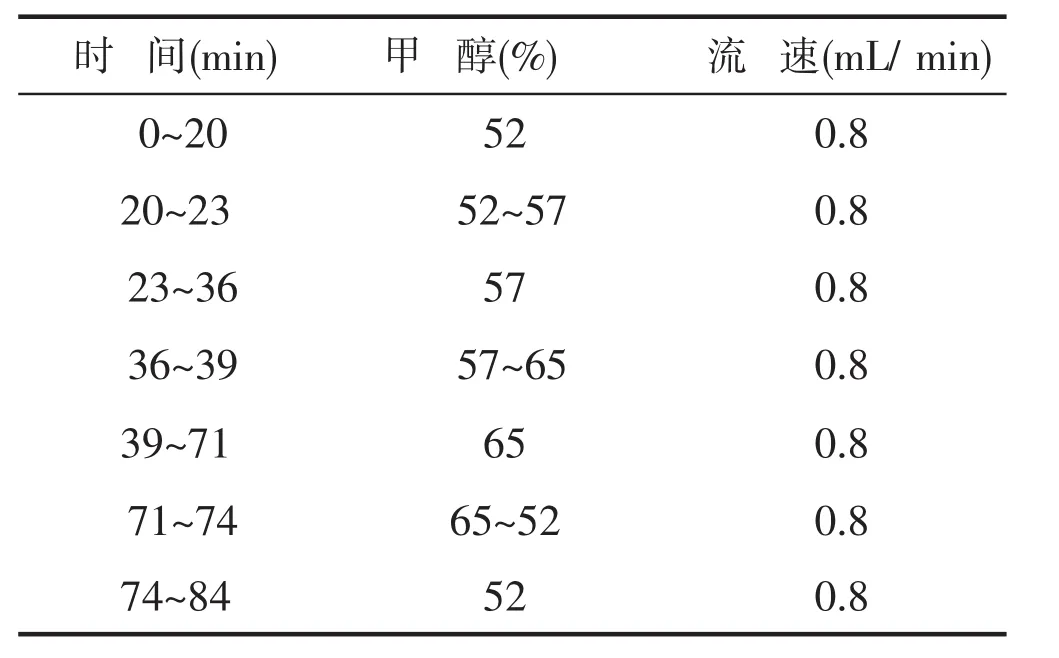
表1 梯度洗脱程序
b.标准曲线的绘制
用混合单体人参皂苷标准工作液按着梯度洗脱程序进行分析。 准确吸取 0、2、4、6、8、10 mL 混合单体人参皂苷标准溶液,分别置于10 mL容量瓶中,用甲醇稀释至刻度,准确吸取10μL各容量瓶中的标准溶液,分别注入液相色谱仪,记录峰面积。以各人参皂苷进样的质量浓度对其峰面积绘制标准曲线。
c.样品测定
准确吸取10μL供试样品溶液注人液相色谱仪,以保留时间定性,以待测液峰面积与标准溶液峰面积比较定量。
d.空白实验
不加试样,采用与试样完全相同的测定步骤进行平行操作。
2.2.1.4 结果计算 试样中人参皂苷的含量用质量分数ω表示,单位为(%),按下列公式计算:
式中:
m1一试样中某种人参皂苷的含量,单位为毫克(mg);
m2-一试样称样的质量,单位为克(g);
V1-一试样的进样体积,单位为毫升(mL);
V2一试样的定容体积,单位为毫升(mL)。
2.3 《保健食品检验与评价技术规范手册》2003版方法
2.3.1 人参皂苷-Rg1、人参皂苷-Re、人参皂苷-Rb1的含量测定
2.3.1.1 液相条件
色谱柱:反相 C18柱,4.6×250mm,5μm; 紫外检测器:检测波长203;柱温:35℃。梯度洗脱条件,详见表2。
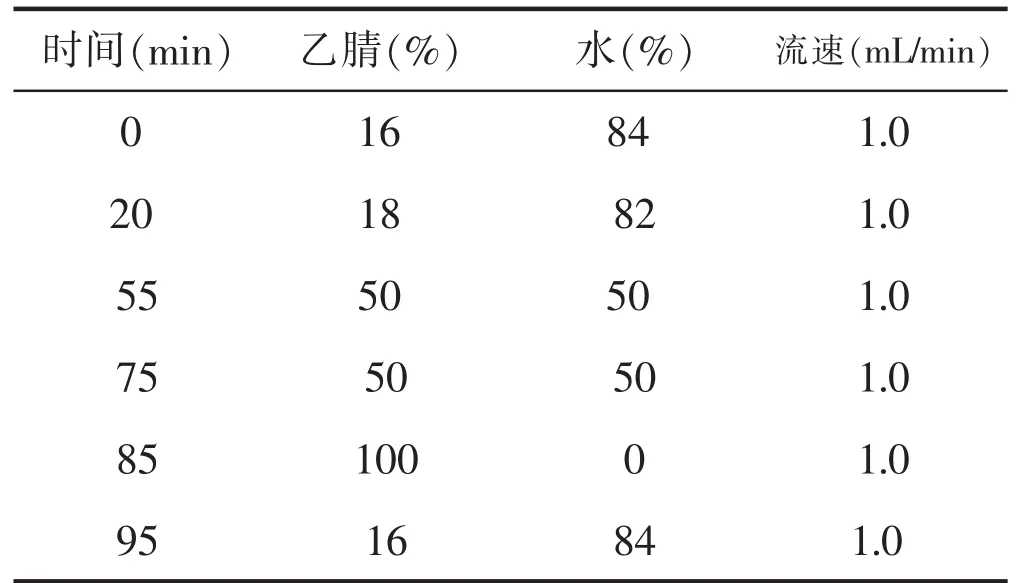
表2 梯度洗脱条件
2.3.1.2 样品制备
将样品研成粉末,过20目筛,精确称取该粉末适量于50mL容量瓶中,加水50mL于超声波清洗器中提取30min,取出,待溶液恢复常温后,定容至50mL。再准确量取10mL,通过D-101大孔吸附树脂净化柱(大孔吸附树脂使用前先用甲醇浸泡,水洗,装成10cm长小柱),小柱先用10mL水冲洗,弃去水液之后,用70%甲醇50mL洗脱皂苷,收集甲醇溶液,水浴上蒸干,残渣以甲醇溶解并定容至5mL,该样液离心后过0.2μm的滤膜,滤液进行色谱分析。
2.3.1.3 试样测定
a.标准曲线的制备
将混合标准系列溶液均取10μL进液相分析,用峰面积对浓度作各人参皂苷的标准回归曲线。b.试样的测定
取10μL试样净化液进高效液相色谱仪,以绝对保留时间定性,用峰面积通过各人参皂苷标准曲线定量计算试样中人参皂苷-Rg1、人参皂苷-Re、人参皂苷-Rb1的含量。
2.3.1.4 计算:
C—试样溶液中各人参皂苷的含量,mg/mL
M—试样的称样量,g。
2.3.1.5 方法学考察
a.线性关系
精密称取以60℃减压干燥10h的人参皂苷-Rg1 10mg,置10mL量瓶中,用甲醇溶解并定容。使对照品溶液(母液)的浓度约为1mg/mL。然后分别吸取50μL、100μL、200μL、400μL、800μL、1.6mL、3.2mL 对照品溶液(母液)分别置于各个10mL容量瓶中,加甲醇稀释至刻度,制备成不同浓度的对照品溶液,分别精密吸取不同浓度的对照品溶液各20μL进样。以色谱峰面积为纵坐标,进样量为横坐标,绘制标准曲线,经统计学计算得直线回归方程,回归方程为:Y=33.5042+501.2928X,r=0.9997
b.稳定性实验
取人参皂苷-Rg1的对照品溶液,精密吸取20μL,按上述色谱条件,分别于0、2、4、8h检测,峰面积RSD为1.98%。
c.精密度实验
取人参皂苷-Rg1的对照品溶液,精密吸取20μL,按上述色谱条件进样分析,连续5次,测定峰面积,其RSD为1.92%。
d.重现性实验
取同一粉碎后的红参样品5份,分别处理后,分别精密吸取20μL按上述色谱条件测定,峰面积RSD为2.66%。
e.回收率实验
采用加样回收法,取已知含量的红参粉末2g,精密称定,分别准确加入一定量的人参皂苷对照品,按上述色谱条件测定,平均回收率为99.85%,RSD为3.28%。
2.3.2 人参总皂苷含量测定
2.3.2.1 人参总皂苷的含量测定
a.样品制备
将样品研成粉末,精确称取该粉末适量于100mL容量瓶中,加水60mL于超声波清洗器中提取30min,取出,待溶液恢复常温后,定容至100mL,准确量取1mL,进行柱层析。
b.柱层析
用10mL注射器作层析管,内装3cmAmberlite-XAD-2大孔树脂,上加1cm中性氧化铝。先用25mL70%乙醇洗柱,弃去洗脱液,再用25mL水洗柱,弃去洗脱液,精确加入1.0mL已处理好的试样溶液。用25mL水洗柱,弃去洗脱液,用25mL70%乙醇洗脱人参皂苷,收集洗脱液于蒸发皿中,置于60度水浴挥干,显色用。
c.显色
在上述已挥干的蒸发皿中准确加入0.2mL5%香草醛冰乙酸溶液,转动蒸发皿,使残渣都溶解,再加0.8mL高氯酸,混匀后转入5mL带塞刻度离心管中,60度水浴上加热10min,取出,冰浴冷却后,准确加入冰乙酸5.0mL,摇匀后,以1cm比色池于560nm波长处与标准管一起进行比色测定。
d.标准管
吸取人参皂苷Re标准溶液 (2.0mg/mL)100μL放蒸发皿中,置水浴挥干(低于60℃)或热风吹干 ,再同样品“柱层析 ”操作。
e.计算
X-试样中总皂苷量(以人参皂苷Re计),g/100g
A1—样品吸光度值
A2—标准液吸光度值
C—标准管人参皂苷Re的量,μg
V—试样的稀释体积,mL
m-样品的称样量,g
2.4 人参总皂苷含量测定(红参分等质量GB/T 22538-2018)方法
2.4.1 原理
样品用乙醚脱脂后,用甲醇回流提取后再用水饱和的正丁醇超声萃取纯化皂苷,人参皂苷可以与硫酸-香草醛显色,在544nm波长处有最大吸收峰,在一定浓度下符合朗伯-比尔定律。
2.4.2 分析步骤
2.4.2.1 供试品溶液的制备
取供试品约1g,精密称定,用中性滤纸包好,置于索氏提取器中,加入乙醚,微沸回流提取1h,弃去乙醚液,供试品药包挥干乙醚溶剂,再置于另一索氏提取器中加入甲醇浸泡过夜,次日再加入适量甲醇开始微沸回流提取,回流6次,以人参皂苷提尽为准(定性鉴别阴性)。合并甲醇提取液,回收甲醇,少量提取液置于蒸发皿中,水浴蒸干。用蒸馏水溶解提取物,加水30~40ml至分液漏斗中用水饱和正丁醇30ml进行萃取,共4次。取上层液蒸干,加甲醇溶解后,转移至10ml量瓶中,用甲醇稀释至刻度,摇匀,即得。
人参皂苷提取定性鉴别:供试品回流提取6次以后,取少量点于硅胶G薄层板(105℃活化10min)上,用10%硫酸乙醇溶液显色,即将薄层板置于通风橱内,喷10%硫酸乙醇溶液,105℃加热10min,总皂苷阳性应为紫红色斑点。也可将薄层板置于碘气缸中数秒钟即取出,以没有紫黄色斑点为阴性。判断人参皂苷是否提取完全,应以索氏提取器中载供试品瓶中的溶液定性鉴别为阴性为准。
2.4.2.2 对照品溶液的制备
精密称取人参皂苷Re对照品10mg,置于10ml量瓶中,加甲醇适量使其溶解并稀释至刻度,摇匀,即得。
2.4.2.3 标准曲线的制作
精密 吸取 人 参 皂 苷 Re 对照 品 10、20、30、40、60μL,置于磨口带塞试管中,水浴蒸干甲醇后,加入8%香草醛乙醇试液0.5ml、72%硫酸溶液5ml,充分振摇混匀后置于60℃恒温水浴上加热10min,立即用冰水冷却10min,摇匀。以试剂作空白,按照分光光度法于544nm波长处分别测定吸光度,绘制浓度吸收曲线,做回归方程:[CONC]=a×abs+b
2.4.3 测定
精密吸取供试品溶液20μL,置于具塞刻度试管中,水浴蒸干甲醇后,加入8%香草醛乙醇试液0.5ml、72%硫酸溶液5ml,充分振摇混匀后置于60℃恒温水浴上加热10min,立即用冰水冷却10min,摇匀。以试剂作空白,按照分光光度法于544nm波长处分别测定吸光度。
2.4.4 分析结果计算
以质量分数(%)表示红参中人参总皂苷含量(X)按下式计算
式中:
[CONC]—曲线上读出样品含量,单位ug;
V1——定容体积,单位为毫升(ml)
V2——取样体积,单位为微升(μl)
m——供试品称样量,单位为毫克(mg)
3 结果
详见表3。
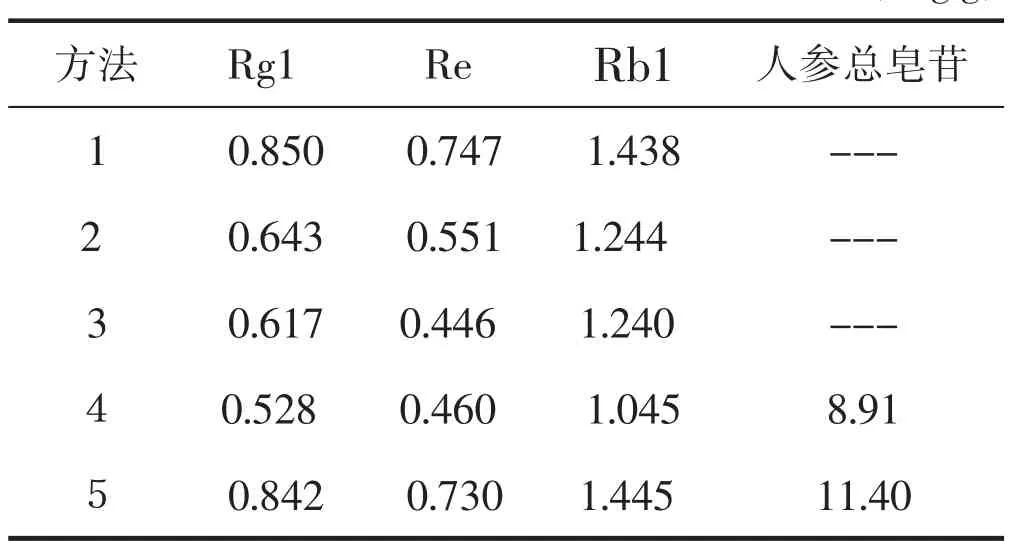
表3 不同方法测定双参颗粒中人参皂苷含量的对比(mg/g)
备注:
1药典方法(公司化验室检测)
2农业行业标准(公司化验室检测,未过SPE C18柱)
3农业行业标准(公司化验室检测,过SPE C18柱)
4保健食品方法(公司化验室检测)
5 GB/T 22538-2018单体皂苷检测方法与药典方法相同(公司化验室检测)
6 Rg1-人参皂苷,Re-人参皂苷,Rb1-人参皂苷
4 讨论
以含有人参的双参颗粒产品制定标准需要以单体人参皂苷-Rg1,人参皂苷-Re,人参皂苷-Rb1含量作为检测指标。由于双参颗粒含有大量的蛋白质、脂肪等干扰成分,采用常规方法难以将红参中的有效成分提取分离,因此本实验研究了多种供试品溶液的制备方法。我们通过实验数据认为:药典方法最佳,能够将人参皂苷从样品中提取分离出来,检测结果稳定,重现性好,能够有效控制产品质量。也可选用中华人民共和国农业行业标准(NY/T1842-2010),该两种方法均有利于企业产品质量标准达标。农业行业标准中的方法检测结果与药典方法差别不大,但样品的前处理相比药典较为复杂,且操作中的过SPE C18柱过程繁琐耗时长,对柱的性能要求较高,才能保证较高的稳定的回收率,使结果的重现性达到要求,不如药典法重现性好且易于操作。保健食品方法检测单体皂苷由于用水做溶剂,对以人(红)参或人(红)参提取物为主要原料的保健食品,如红参茶、红参冲剂中的人参皂苷提取效果很好。

