内镜下黏膜切除术对胃肠道息肉患者红细胞免疫功能和炎性细胞因子的影响
高元平 郝卫刚 王轶佳 李绍军
四川省眉山市人民医院消化内科(620020)
背景:内镜手术创伤可抑制红细胞免疫功能,并激活机体炎症反应,但这一影响在不同术式间存在一定差异。目的:探讨内镜下黏膜切除术(EMR)对胃肠道息肉患者红细胞免疫功能和炎性细胞因子的影响。方法:2011年1月—2016年12月眉山市人民医院收治的315例胃肠道息肉患者随机进入EMR组(n=160)和对照组(n=155),分别接受EMR和常规内镜下电凝切除术治疗。观察两组息肉切除情况以及术后红细胞免疫功能[外周血红细胞膜补体3b受体花环率(C3bRR)、免疫复合物花环率(ICR)、CD58、CD59]和血清炎性细胞因子[白细胞介素-1β(IL-1β)、IL-6、IL-8、IL-12]水平。结果:两组患者胃肠道息肉均完整切除,EMR组术中并发症发生率显著低于对照组(3.1%对20.0%, P<0.05),术后红细胞膜C3bRR、CD58、CD59水平高于对照组(P<0.05),ICR和血清IL-1β、IL-6、IL-8、IL-12水平低于对照组,差异均有统计学意义(P<0.05)。结论:EMR治疗胃肠道息肉效果确切,术中并发症少,并可保护患者的红细胞免疫功能,手术相关炎症反应亦较轻。
胃肠道息肉是由胃肠道内局部黏膜上皮增生而逐步发展形成的隆起型病变,临床治疗多采取内镜下电凝切除术。该术式虽可有效切除息肉且操作简便,但切除深度较难掌握,对于平坦型息肉,如操作者未能熟练掌握切除深度,极易导致病变切除不彻底或引起消化道穿孔等并发症。近年来,随着微创诊疗技术的发展,内镜下黏膜切除术(endoscopic mucosal resection, EMR)在胃肠道息肉治疗中的应用日益普及,该技术将黏膜下注射与电凝切除术相结合,具有安全可靠、创伤小、设备简单、适合在基层医院开展的优势,成为治疗胃肠道无蒂、平坦型息肉的主要方法之一[1-3]。
红细胞免疫是一种重要的机体免疫机制,已知手术创伤可引起暂时性的红细胞免疫功能低下[4],并在一定程度上激活机体炎症反应,但这一影响在不同内镜术式间存在一定差异。本研究旨在探讨EMR对胃肠道息肉患者红细胞免疫功能和炎性细胞因子的影响。
对象与方法
一、研究对象
选取2011年1月—2016年12月四川省眉山市人民医院收治的胃肠道息肉样病变患者315例,按随机数字表法进入EMR组(n=160)和对照组(n=155),分别接受EMR和常规内镜下电凝切除术治疗。入选标准:①经内镜检查确诊为胃肠道息肉样病变;②息肉直径>5 mm且≤20 mm;③无相关手术禁忌证;④患者签署知情同意书。排除标准:①表达障碍、意识不清;②合并心、肺、肝、肾功能不全;③过敏体质或对手术相关药物过敏。研究方案经医院医学伦理委员会审核批准。
二、内镜手术方法
1. 术前准备:患者术前常规接受胃镜或结肠镜检查,以及血型、心电图、血常规、凝血功能等检查,并常规行胃镜或结肠镜检查前准备。
2. 对照组:内镜下确定息肉位置后,于距息肉边缘2 mm处采用高频电刀切除息肉,尽可能切至黏膜下层。
3. EMR组:内镜下确定息肉位置后,选择病变肛侧或口侧边缘为注射点,针尖插入至黏膜下层为宜,于息肉底部黏膜下层注射0.9% NaCl溶液,根据病灶大小决定注射量,待病变充分隆起后拔除注射针,插入圈套器,将息肉完全套住后收紧并通电,采用混合电流切除息肉。
4. 术中、术后处理:息肉切除后如创面有少量渗血,可喷洒0.8%去甲肾上腺素溶液,创面较深或出血较多者可使用钛夹夹闭。切除的息肉送病理检查。术毕抽出胃肠道内气体,密切观察患者有无腹胀、腹痛、便血等情况。
三、观察指标
术后2 h采集两组患者外周血,行红细胞免疫功能和血清炎性细胞因子水平检测。
1. 红细胞免疫功能:采用红细胞酵母花环法进行检测[5],具体指标包括红细胞膜补体3b(complement 3b, C3b)受体花环率(C3b receptor rosette, C3bRR)、免疫复合物花环率(immune complex rosette, ICR),同时采用流式细胞术检测红细胞膜CD58/淋巴细胞功能相关抗原3(LFA-3)、CD59水平。
2. 血清炎性细胞因子:采用ELISA法进行检测,具体指标包括白细胞介素-1β(IL-1β)、IL-6、IL-8、IL-12。
四、统计学分析
结 果
一、一般资料和息肉切除情况
315例胃肠道息肉患者共成功切除338枚息肉,其中EMR组171枚,对照组167枚。EMR组男性81例,女性79例,年龄34~79岁,平均(54.5±7.4)岁。息肉部位:胃息肉69例72枚,包括幽门12枚,胃窦23枚,胃底16枚,胃体21枚;结直肠息肉91例99枚,包括升结肠6枚,横结肠7枚,降结肠46枚,乙状结肠25枚,直肠15枚。对照组男性79例,女性76例,年龄35~76岁,平均(53.6±7.6)岁。息肉部位:胃息肉67例75枚,包括幽门13枚,胃窦25枚,胃底18枚,胃体19枚;结直肠息肉88例92枚,包括升结肠5枚,横结肠5枚,降结肠44枚,乙状结肠24枚,直肠14枚。两组间性别、年龄、息肉部位差异均无统计学意义(P>0.05)。
两组患者息肉均完整切除(图1、图2)。EMR组出现术中出血3例,黏膜肌层损伤2例;对照组出现穿孔9例,出血14例(出血量较大),黏膜肌层损伤8例。EMR组术中并发症发生率明显低于对照组,差异有统计学意义(3.1%对20.0%, χ2=22.148,P=0.000)。
二、两组术后红细胞免疫功能比较
EMR组术后外周血红细胞膜C3bRR、CD58/LFA-3、CD59水平明显高于对照组,ICR明显低于对照组,差异均有统计学意义(P<0.05)(表1)。
三、两组术后血清炎性细胞因子水平比较
EMR组术后血清IL-1β、IL-6、IL-8、IL-12水平均明显低于对照组,差异有统计学意义(P<0.05)(表1)。

A:电凝切除前;B:电凝切除后
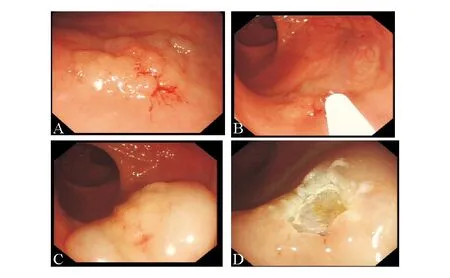
A:EMR切除前;B、C:黏膜下注射后病变充分隆起;D:EMR切除后

表1 两组术后红细胞免疫功能和血清炎性细胞因子水平比较
讨 论
胃肠道息肉在消化系统疾病中属于常见病、多发病,好发于中老年人群。随着内镜技术的进步,内镜下切除术现已广泛应用于胃肠道息肉的治疗。EMR系通过黏膜下注射分离息肉,再以圈套器圈套隆起的病变并切除,病变完整切除率和并发症发生率均优于传统内镜下电凝切除术,息肉复发率亦较低[6-7]。本研究中接受EMR和传统内镜下电凝切除术的胃肠道息肉患者息肉均完整切除,但EMR组术中并发症发生率更低,证实了该技术在胃肠道息肉治疗中的优势。
Siegel等[8]于1981年首次提出了红细胞免疫系统的概念。红细胞除携带氧、参与组织呼吸功能外,还可发挥免疫功能,包括识别和存储抗原、清除循环中的免疫复合物、增强T细胞依赖性反应、促进吞噬作用等,是机体免疫反应调控网络的重要组成部分[9-10]。上述免疫功能的生理学基础为红细胞的免疫黏附作用。人体血液循环中约95%的C3b受体定位于红细胞膜,其为红细胞免疫中最重要的免疫分子,可介导红细胞黏附于抗原-抗体-补体复合物,从而有效清除循环中的免疫复合物;红细胞与自体胸腺细胞和T细胞的黏附则提示其可发挥抗原识别和呈递作用[8-9]。红细胞膜上的C3b受体可与补体致敏的酵母菌黏附形成花环,而红细胞膜上黏附的免疫复合物中的C3b分子可与未致敏的酵母菌酵母多糖黏附形成花环,C3bRR和ICR是反映红细胞免疫功能的重要指标。除C3b受体外,红细胞表面的天然免疫分子还包括CD44、CD55、CD58、CD59、自然杀伤细胞(NK细胞)增强因子、趋化因子受体等,其中CD58、CD59可与T细胞CD2受体结合,激活调控T细胞的适应性免疫反应[10]。
研究[4]显示手术创伤可抑制红细胞免疫功能,引起继发性红细胞免疫功能低下,表现为术后72 h内C3bRR降低,ICR升高。本研究比较了接受EMR治疗和常规内镜下电凝切除术治疗胃肠道息肉患者的外周血红细胞膜C3bRR、ICR以及CD58、CD59水平,结果显示EMR对红细胞免疫功能的抑制作用明显小于常规内镜下电凝切除术。此外。内镜治疗损伤胃肠道黏膜可上调组织内炎性因子表达,进而激活相关信号通路,引起大量炎性细胞因子分泌并进入血液循环;红细胞免疫功能减弱亦会对淋巴细胞和细胞因子表达产生影响。本研究进一步检测了两组患者的术后血清炎性细胞因子水平,发现EMR组IL-1β、IL-6、IL-8、IL-12水平均显著低于对照组,表明与传统内镜下电凝切除术相比,EMR引起的炎症反应较轻。
综上所述,EMR治疗胃肠道息肉效果确切,术中并发症少,并可保护患者的红细胞免疫功能,手术相关炎症反应亦较轻,可作为临床治疗胃肠道息肉的主要手段推广应用。

