高效诱导人胚胎干细胞分化为表达生殖功能调控相关基因的下丘脑神经细胞
徐瑜辰,覃莲菊,宁松,曹孟,李真真,崔毓桂,马翔,刘嘉茵
(南京医科大学第一附属医院生殖医学科/生殖医学国家重点实验室,南京 210029)
下丘脑是调节机体稳态平衡的中枢,通过分泌多种神经递质和神经肽,调控人体能量代谢、生殖功能、免疫功能、应激反应和昼夜节律[1-2]。下丘脑主要由弓状核(ARC)、腹内侧核(VMH)、背内侧核(DMH)和室旁核(PVN)这几种功能不同的核团组成[3]。人下丘脑ARC中存在表达阿片促黑素皮质素原(POMC)和神经肽Y/刺鼠相关肽(NPY/AGRP)基因的神经元,这些神经元能对与代谢相关的外周信号激素如胰岛素、瘦素、饥饿素产生应答,并通过分泌多种神经肽来调控机体的食物摄入与能量消耗[4]。ARC中还有表达亲吻素1(KISS1)基因的神经元,通过分泌亲吻肽(Kisspeptin)作用于促性腺激素释放激素(GnRH)神经元,从而影响GnRH的分泌,调控生殖功能[5-7]。此外,越来越多的研究表明,代谢因素会影响KISS1的表达[8-9],而Kisspeptin信号通路的异常同样会引起代谢相关疾病[10-12]。因此,深入了解下丘脑ARC中不同亚型神经元在维持人体代谢与生殖功能平衡中的细胞生理学机制尤为重要,但目前很难直接获得人类下丘脑神经细胞用于体外疾病研究。
人类多能干细胞(hPSCs:包括人胚胎干细胞hESCs,以及人诱导多能干细胞hiPSCs)具有体外扩增能力和多向分化潜能,在适当的培养条件下可分化为三胚层来源的所有细胞类型[13],包括神经细胞[14-15]。2008年,Wataya等[16]基于小鼠下丘脑神经细胞发育过程中的分子调控机制,在体外将小鼠胚胎干细胞(mESCs)诱导分化为下丘脑类型的神经前体细胞。2015年,Merkle等[17]成功诱导hPSCs分化为具有分泌神经肽功能的下丘脑神经细胞。Wang等[18-19]开发了一种将hPSCs分化为类下丘脑弓状核神经细胞(HANs)的实验方案,并证实这些神经细胞与人体内HANs的功能极为相似。体外定向诱导hPSCs分化为下丘脑神经细胞,可有效解决研究用人类神经细胞模型问题。
虽然以往研究证实了从hESCs或hiPSCs诱导分化的类HANs表达代谢相关基因如POMC、NPY/AGRP等[18-20],但这些神经细胞是否表达参与生殖功能调控相关基因尚未得到证实。本研究优化现有体外诱导hESCs向类HANs分化方案,并进一步分析生殖内分泌相关基因在分化神经细胞中的表达情况,探讨该类神经细胞可否作为细胞模型应用于下丘脑ARC在生殖相关疾病发生、发展过程中的调控机制研究。
材料和方法
一、细胞及试剂
1.细胞:利用接受辅助生殖技术治疗患者捐赠的冷冻女性胚胎,建立hES细胞系[21],命名为CCRM14。经过南京医科大学、南京医科大学第一附属医院的伦理委员会审查通过,捐献者签署知情同意书。
2.主要试剂:Knockout DMEM、血清替代物(Knockout Serum Replacement)、B27、N2添加物(N2-supplement)、IV型胶原蛋白酶(Collagenase IV)、中性蛋白酶(Dispase)、胰蛋白酶-EDTA[Trypsin-EDTA(0.25%)]、Natural mouse laminin(Thermo Fisher,美国);β-巯基乙醇(β-mercraptoethanol)(Biolink,美国);基质胶(Matrigel)(BD Biosciences,美国);碱性成纤维细胞生长因子(FGF-basic)(Pepro Tech,美国);mTeSRTM1 cGMP,feeder-free maintenance medium for human ES and iPS Cells(Stem Cell,加拿大);SB431542、Purmorphamine(Stemgent,美国);LDN-193189、Y-27632(Selleckchem,美国);DAPT(TOCRIS,美国);SHH、BDNF(R&D,美国);D-Glucose、Ascorbic Acid、Poly-L-ornithine(Sigma,美国)。所用抗体见表1。
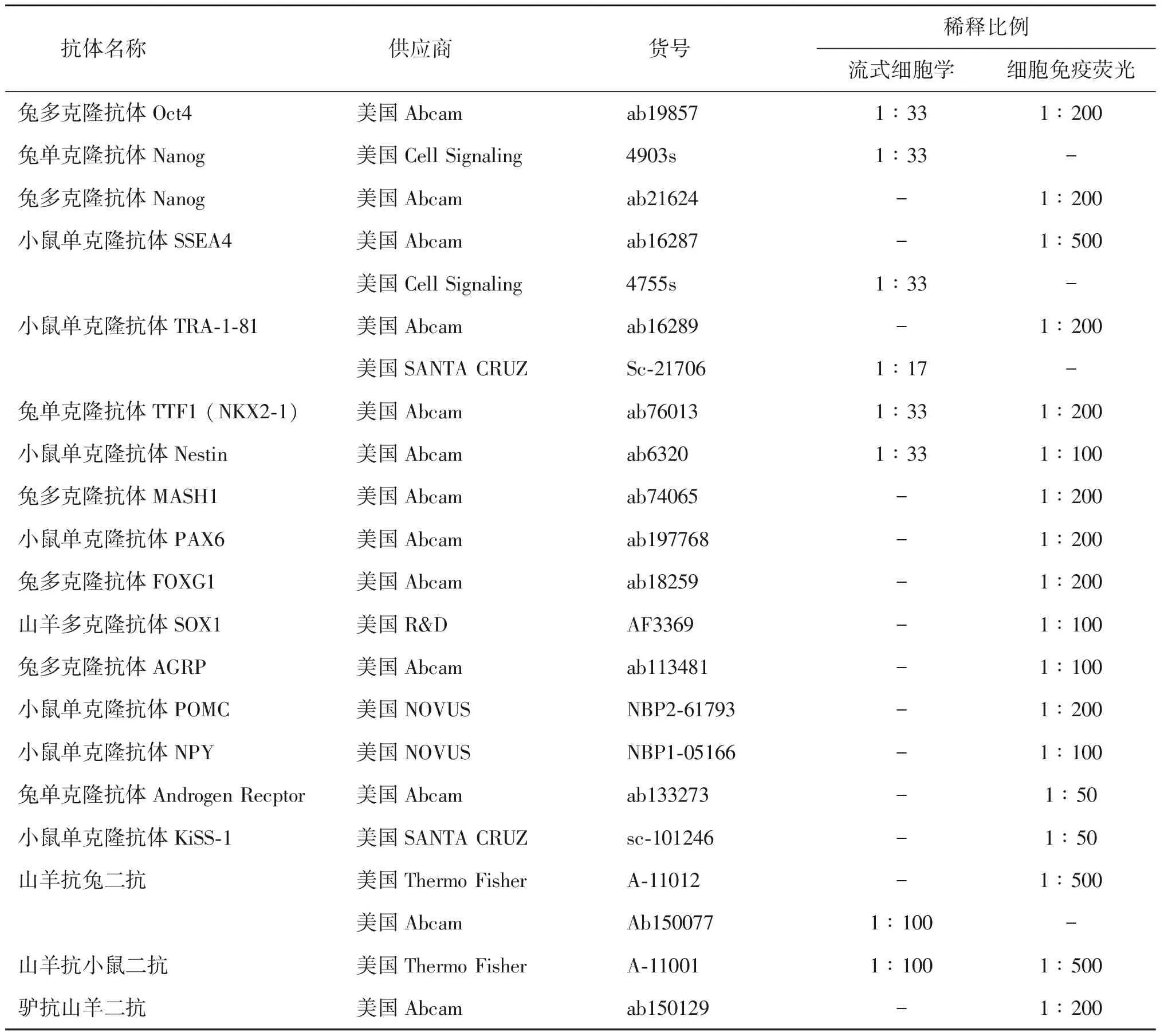
表1 抗体信息
3.主要仪器:流式细胞仪(型号:Navios)、台式冷冻离心机(型号:AllegraX-30)(Beckman,美国);激光共聚焦显微镜(型号:C2 plus)、生物显微镜(型号:TS100-F)(Nikon,日本);三气培养箱(型号:Thermo-3131)(Thermo,美国)。
二、研究方法
(一)类HANs的体外诱导分化
体外诱导hESCs分化为类HANs的实验方案包括三个主要步骤。第一步:在以小鼠胚胎成纤维细胞(MEF)的饲养层上培养hESCs(CCRM14),并在无饲养层培养系统中纯化;第二步:依次加入SB431542、LDN-193189、SHH、Purmorphamine、DAPT等分子,诱导hESCs分化为特异性表达NKX2-1的下丘脑神经前体细胞(HNPs);第三步:依次加入DAPT、脑源性神经营养因子(BDNF),诱导HNPs分化为类HANs(图2)。
1.hESCs的培养:CCRM14以MEF为饲养层、在ESC完全培养基[组成:DMEM/F12、20%血清替代物、1%谷氨酰胺、1%非必需氨基酸、0.1 mmol/L β-巯基乙醇、1%青霉素链霉素,10 ng/ml 碱性成纤维细胞生长因子(bFGF)]中进行常规培养,每5~7 d传代。
2.hESCs的纯化:为去除饲养层对诱导神经分化的影响,采用无饲养层培养系统对hESCs进行纯化培养。在hESCs克隆生长至接近汇合时,加入Collagenase Ⅳ-Dispase混合液[1 mg/ml Collagenase Ⅳ∶1 mg/ml Dispase(v/v)=1∶1,DMEM/F12配制];放入5% CO2、37℃培养箱内消化约35 min;收集与MEF分离并脱落的hESCs克隆至15 ml离心管内,待其自然沉降至管底;吸弃酶液,加入ESC培养基洗涤3次。按照1∶2或1∶3的传代比例,接种于Matrigel包被的培养板内,加入适量mTeSR1培养基培养3~5 d,至hESCs 克隆接近汇合。加入0.25% Trypsin-EDTA,消化约3 min,使hESCs为单细胞;加入KSR培养基(组成:knockout DMEM、14.75%血清替代物、1.07% GlutaMAX、1.07%非必需氨基酸、1.07%青霉素链霉素、0.06 mmol/L β-巯基乙醇)中和并离心,悬浮细胞并计数。按适量密度接种细胞于Matrigel包被的培养板中(6孔板:1.0×106细胞/孔;12孔板:3.0×105细胞/孔;24孔板:1.5×105细胞/孔);加入适量KSR培养基,并加入bFGF(10 ng/ml)和ROCK抑制剂Y27632(10 μM)培养约1 d。显微镜下观察到hESCs细胞密度长至95%以上时,即可开始诱导神经分化。
3.诱导hESCs分化为HNPs:将开始诱导神经分化记为第1天(Day 1)。Day 1~4:加入KSR分化培养基(组成:KSR培养基、100 ng/ml SHH、2 μmol/L PM、10 μmol/L SB431542、2.5 μmol/L LDN-193189),培养4 d。Day 5:加入KSR/N2混合分化培养基A[组成:3份KSR培养基、1份N2培养基(N2培养基组成:DMEM/F12、1.04% GlutaMAX、1.04%非必需氨基酸、1.04%青霉素链霉素、1.04% N2添加物、1.04% D-Glucose(16%)、0.2 mmol/L Ascorbic Acid)、100 ng/ml SHH、2 μmol/L PM、10 μmol/L SB431542、2.5 μmol/L LDN-193189]培养1 d。Day 6:加入KSR/N2混合分化培养基B(组成:1份KSR培养基、1份N2培养基、100 ng/ml SHH、2 μmol/L PM、10 μmol/L SB431542、2.5 μmol/L LDN-193189)培养1 d。Day 7:加入KSR/N2混合分化培养基C(组成:1份KSR培养基、3份N2培养基、100 ng/ml SHH、2 μmol/L PM、10 μmol/L SB431542、2.5 μmol/L LDN-193189)培养1 d。Day 8:加入N2分化培养基A(组成:N2培养基、100 ng/ml SHH、2 μmol/L PM、10 μmol/L SB431542、2.5 μmol/L LDN-193189)培养1 d。Day 9~12:加入N2分化培养基B(组成:N2培养基、0.02% B27、10 μmol/L DAPT)培养4 d。需每天更换新鲜培养基。至分化第12天,hESCs即分化为HNPs。
4.诱导HNPs分化为类HANs:Day 13加入TrypLE,消化HNPs约4 min,将细胞吹打为单细胞悬液,离心、弃上清液,加入适量N2分化培养基C(组成:N2培养基、0.02% B27、10 μmol/L ROCK抑制剂)重悬细胞并细胞计数。以适当密度(6孔板:1.0×106细胞/孔;12孔板:3.0×105细胞/孔;24孔板:1.5×105细胞/孔)接种至Poly-L-ornithine/Laminin包被的培养板中,加入适量N2分化培养基C,培养约3 h后更换培养基为N2分化培养基B,培养4天,每天更换新鲜培养基。Day 17开始,更换培养基为N2分化培养基D(组成:N2培养基、0.02% B27、20 ng/ml BDNF),培养2~3周,每2天更换新鲜培养基,直到类HANs成熟。
(二)细胞流式分析
加入TrypLE,将hESCs和HNPs消化为单细胞,离心、弃上清,PBS重悬。加入Fixation Buffer(Biolegend),4℃避光固定30~60 min。使用1×Permeabilization Wash Buffer(Biolegend,10×)破膜5 min,PBS重悬细胞。加入一抗,4℃孵育至少30 min,PBS洗涤后加入二抗,4℃避光孵育30 min。0.1% BSA洗涤并重悬,上机检测。共分析3个代次(P33~35)的CCRM14及其诱导分化的HNPs。其中:兔多克隆抗体OCT4(1∶33),兔单克隆抗体Nanog(1∶33),小鼠单克隆抗体SSEA4(1∶33),小鼠单克隆抗体Tra-1-81(1∶17)抗体用于检测CCRM14干细胞多能性;兔单克隆抗体TTF1(NKX2-1)(1∶33),小鼠单克隆抗体Nestin(1∶33)抗体用于检测神经前体细胞。山羊抗小鼠二抗(1∶100)或山羊抗兔二抗(1∶100)。
(三)细胞免疫荧光检测
用4%多聚甲醛室温固定在盖玻片上培养的细胞30 min,PBS洗3遍,每次5 min。0.4% Triton X-100冰上破膜10 min,PBS洗3遍,使用5%BSA 37℃封闭30 min。孵育一抗4℃过夜,次日PBS 洗3遍,室温避光孵育二抗1 h,PBS 洗涤后加入含DAPI的封片剂封片,利用荧光倒置显微镜观察拍照。所用抗体如下:用于鉴定CCRM14干细胞多能性一抗:兔多克隆抗体Oct4(1∶200)、兔多克隆抗体Nanog(1∶200)、小鼠单克隆抗体SSEA4(1∶500)、小鼠单克隆抗体TRA-1-81(1∶200);用于鉴定HNPs一抗:兔单克隆抗体TTF1(NKX2-1)(1∶200)、小鼠单克隆抗体Nestin(1∶100)、兔多克隆抗体FOXG1(1∶200)、山羊多克隆抗体SOX1(1:500)、兔多克隆抗体MASH1(1∶200)、小鼠单克隆抗体PAX6(1∶200)、兔单克隆抗体AR(1∶50)、小鼠单克隆抗体KiSS-1(1∶50);用于鉴定类HANs一抗:小鼠单克隆抗体POMC(1∶200)、小鼠单克隆抗体NPY(1∶100)、兔多克隆抗体AGRP(1∶100)、兔单克隆抗体AR(1∶50)、小鼠单克隆抗体KiSS-1(1∶50)。二抗为山羊抗兔(1∶500)、山羊抗小鼠(1∶500)和驴抗山羊二抗(1∶200)。
(四)RT-qPCR分析基因表达
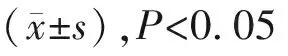

表2 RT-qPCR引物序列
三、统计学分析
结 果
一、CCRM14建系及鉴定
复苏冷冻胚胎,培养至囊胚内细胞团(ICM)出现,分离ICM转移至饲养层培养,经传代、扩增,成功建立hES细胞系CCRM14。CCRM14在饲养层上呈克隆状生长;免疫荧光实验结果显示,CCRM14表达干细胞多能性标志物 OCT4、NANOG、SSEA4、TRA-1-81(图1A)。流式细胞学检测结果显示,CCRM14多能性标志物的阳性表达率依次为OCT4(97.82±0.46)%、NANOG(97.70±0.27)%、SSEA4(97.01±0.59)%、TRA-1-81(97.23±0.52)%(图1B)。使用不含bFGF的ESC培养基悬浮培养CCRM14克隆,可观察到拟胚体(EB)的形成(图1C)。检测EB在培养第0、3、7和14 d时的基因表达水平,发现多能性标志基因OCT4表达水平随分化进程下降,而内胚层标志基因SOX17、中胚层标志基因CD31以及外胚层标志基因NESTIN的表达水平则随分化进程先增加,而后随着向特异性组织的分化呈下降趋势(图1D)。以上研究结果表明:CCRM14具有典型hESCs特征。
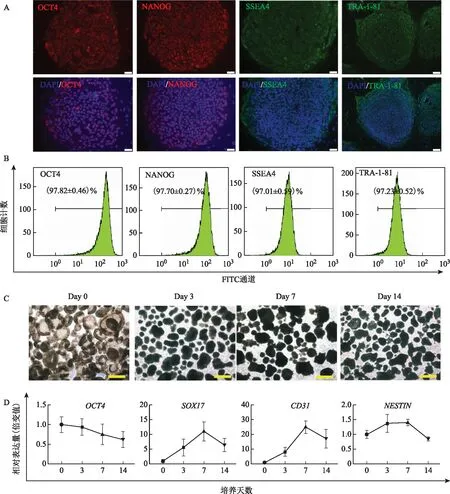
A:免疫荧光检测显示CCRM14表达多能性标志物OCT4、NANOG、SSEA4和TRA-1-81,标尺=100 μm;B:流式细胞学检测CCRM14细胞表达多能性标志物阳性率(共检测3个代次:P33~35);C:CCRM14体外悬浮培养形成EB,标尺=500 μm;D:CCRM14来源的EB三胚层分化特异标志基因SOX17(内胚层)、CD31(中胚层)、NESTIN(外胚层)的表达情况图1 CCRM14细胞系的鉴定
二、诱导CCRM14向HNPs分化并鉴定
本研究对已报道诱导分化方案[19]进行了优化,即诱导神经细胞诱导分化之前增加了hESCs纯化步骤(图2A)。MEF上培养的CCRM14呈类圆形克隆样生长(图2B-a);使用Collagenase Ⅳ-Dispase消化之后,MEF仍然贴壁、而hESCs克隆完整游离后留下印迹(图2B-b)。游离的纯化hESCs克隆转移至基质胶上培养,初时呈铺路石样,后逐渐长至汇合、辨不清细胞形态(图2B-c)。用0.25% Trypsin-EDTA消化为单细胞后接种于新培养皿,贴壁后细胞形态均一、伴高核质比(图2B-d)。分化至Day 12时,快速增殖的细胞显示积聚重叠状(图2B-e)。分化至Day 34时,镜下可见神经细胞样细胞(图2B-f)。
收集Day 0和分化Day 12的细胞样本,检测多能性标志基因和HNPs特异基因表达情况。RT-qPCR检测结果显示(图3A),Day 0细胞高水平表达干细胞多能性标志基因OCT4、NANOG;Day 12分化细胞的OCT4(P<0.0001)和NANOG(P<0.001)表达水平显著降低,同时HNPs标志基因NKX2-1(P<0.0001)、神经细胞标志基因NESTIN(P<0.01)、MASH1(P<0.01)和神经前体细胞标志基因SOX1(P<0.0001)的mRNA相对表达量显著上调;而端脑类型神经细胞标志基因PAX6(P<0.01)、FOXG1(P=0.30)的表达水平则随着细胞向腹侧间脑细胞类型的分化而降低。免疫荧光检测结果与RT-qPCR检测结果一致:Day 12分化细胞均表达NESTIN、NKX2-1、MASH1和SOX1,不表达PAX6和FOXG1(图3B)。流式细胞学检测结果显示,Day 12分化细胞中,(99.11±0.30)%的细胞显示神经细胞标志物NESTIN强阳性;同时(96.76±3.24)%的细胞显示HNPs标志物NKX2-1强阳性(图3C),均高于之前报道的分化方案[19,22]。以上结果表明,本优化方案可以更高效率分化为HNPs。
三、诱导HNPs向类HANs分化并鉴定
更换诱导培养基,加入BDNF,继续诱导HNPs向类HANs亚群分化(图2A)。收集Day 34细胞样本,检测多能性标志基因和HANs特异基因表达情况。RT-qPCR检测结果显示:干细胞多能性标志物OCT4、NANOG的表达水平随分化进程显著降低(P<0.0001);而神经细胞标志物NESTIN(P<0.05)、ARC神经细胞特异性标志物POMC(P<0.05)、NPY(P<0.05)和AGRP(P<0.001)的表达水平均显著升高(图4A)。免疫荧光检测结果与RT-qPCR检测结果一致:大部分 Day 34的分化细胞均高水平表达POMC、NPY和AGRP(图4B)。以上结果表明,加入BDNF继续诱导两周以上,HNPs可分化为ARC神经细胞。
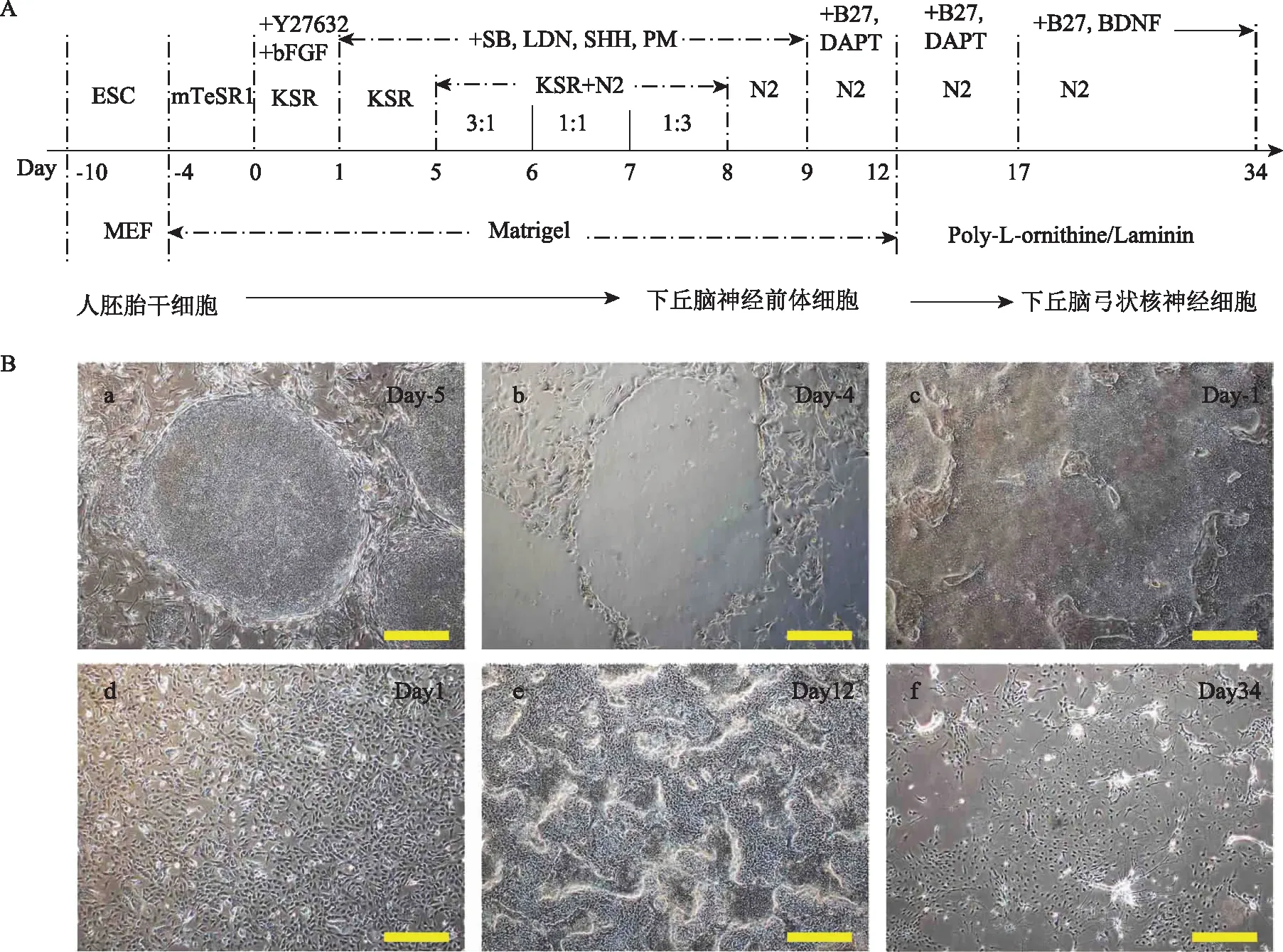
A:体外诱导CCRM14向类HANs分化的流程图。hESCs在MEF上培养6 d,纯化后在Matrigel上培养4 d,然后消化为单细胞、诱导向神经细胞分化(将开始诱导当天记为第1天);培养至第12天收获HNPs,转移至Poly-L-ornithine/Laminin上继续培养至第34天时收获类HANs。其中ESC、mTeSR1、KSR和N2为培养基,Y27632(ROCK抑制剂)、bFGF(FGF-basic)、SB(SB431542)、LDN(LDN-193189)、SHH、PM(Purmorphamine)、B27、DAPT和BDNF为添加因子;B:显微镜下CCRM14向类HANs分化不同阶段细胞形态:a,MEF上培养CCRM14第6天(Day-5)时形态;b,Day-4时使用Collagenase Ⅳ-Dispase游离CCRM14克隆之后的MEF;c,Matrigel上培养CCRM14至第3天(Day-1)的细胞形态;d,Day1时CCRM14消化为单细胞再接种、贴壁后细胞形态;e,CCRM14分化至Day12的细胞形态;f,CCRM14分化至Day34的细胞形态;标尺=500 μm图2 体外诱导CCRM14向类HANs分化方案
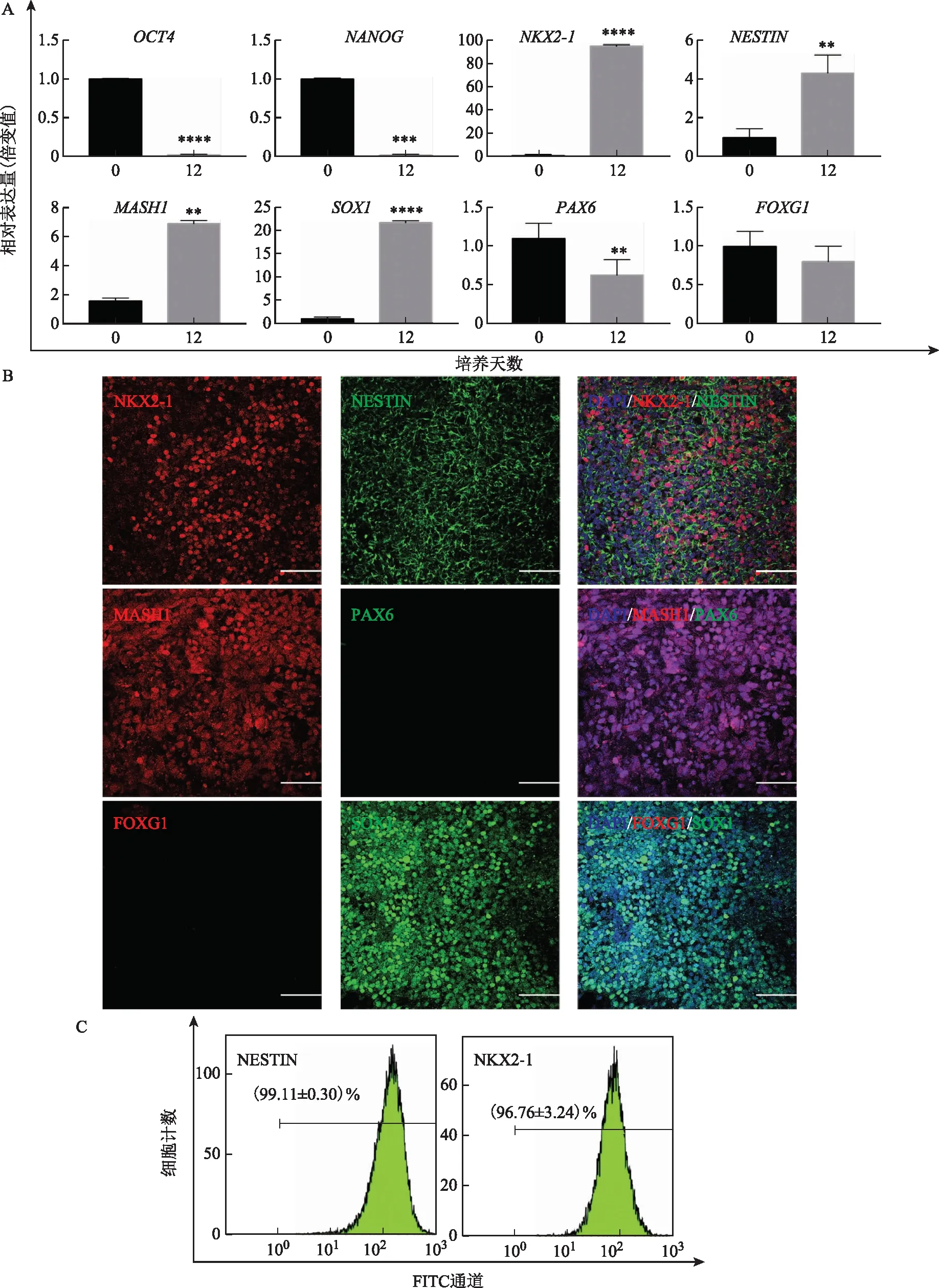
A:RT-qPCR检测分化Day 0和Day12细胞的多能性标志基因OCT4、NANOG;HNPs特异性标志基因NKX2-1;神经细胞标志基因NESTIN、MASH 1;神经前体细胞标志基因SOX1;端脑类型神经细胞标志基因PAX6、FOXG1的表达,**P<0.01、***P<0.001、****P<0.0001;B:免疫荧光检测分化Day12细胞NKX2-1、NESTIN、MASH1、SOX1、PAX6、FOXG1的表达;标尺=100 μm;C:流式细胞学检测分化Day12细胞NESTIN、NKX2-1的阳性表达率分别为(99.11±0.30)%、(96.76±3.24)%图3 CCRM14诱导分化至第12天时鉴定HNPs
四、检测CCRM14来源的HNPs和类HANs中生殖功能相关基因的表达
我们进一步检测分化的神经细胞是否表达生殖功能调控相关基因。细胞免疫荧光实验结果显示,大部分Day12分化细胞(HNPs)和Day34分化细胞(类HANs)中,均显著表达参与生殖功能调控相关基因KISS1和AR(图5)。
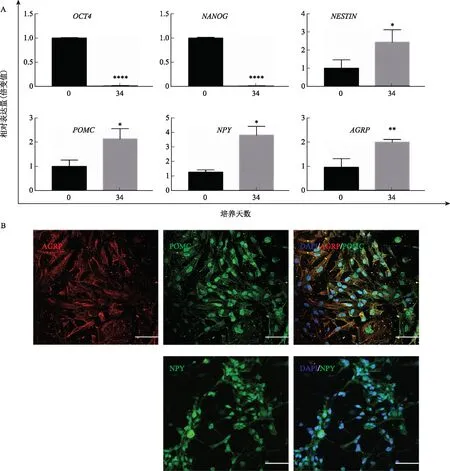
A:RT-qPCR检测分化Day 0和Day34细胞的多能性标志基因OCT4、NANOG;神经细胞标志基因NESTIN;HANs标志基因POMC、NPY、AGRP的表达,*P<0.05、**P<0.01、****P<0.0001;B:免疫荧光检测分化Day34细胞POMC、AGRP、NPY的表达;标尺=100 μm图4 CCRM14诱导分化至第34天时鉴定类HANs
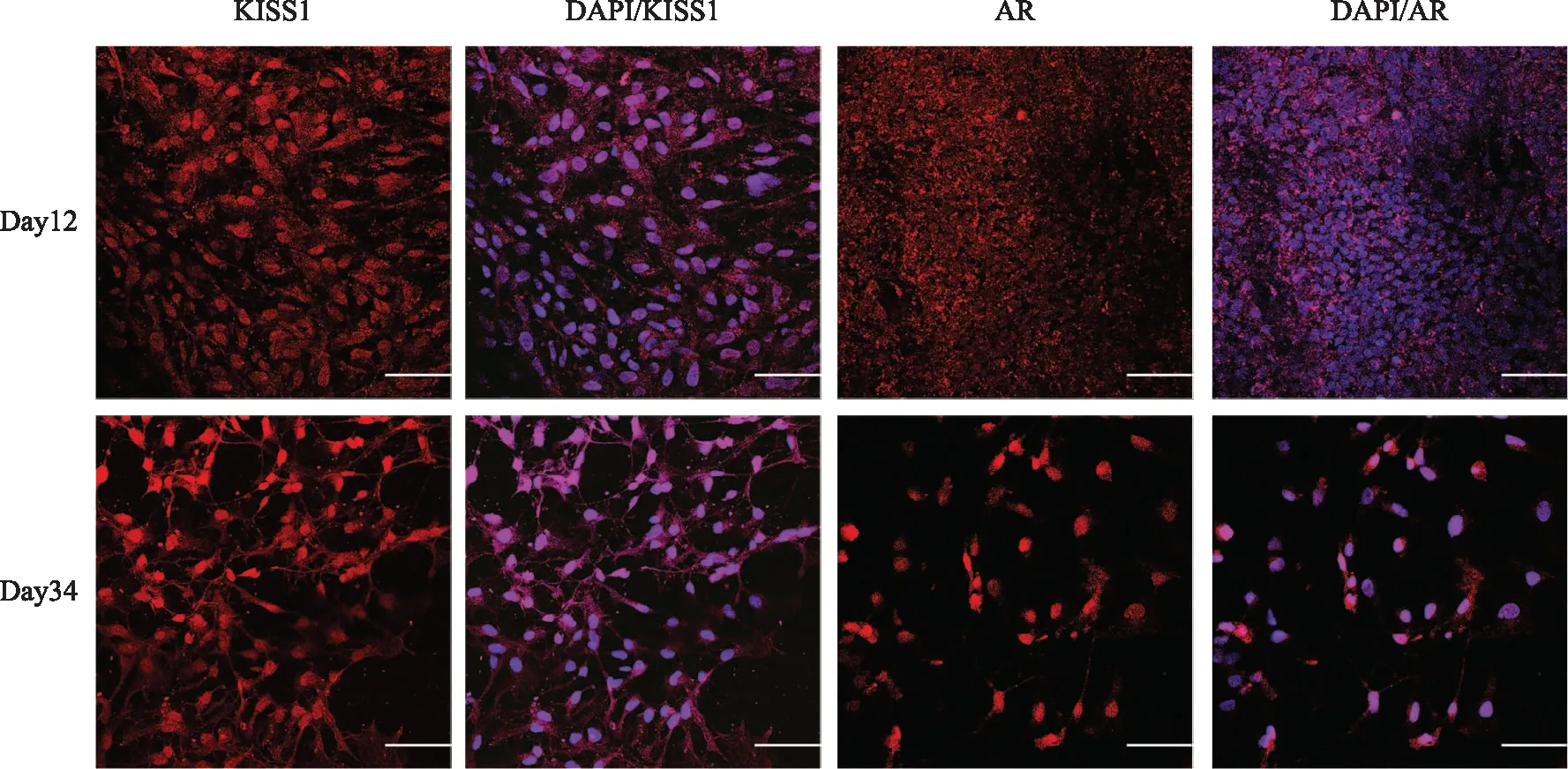
免疫荧光检测分化Day 12、Day 34细胞KISS1和AR的表达;标尺=100 μm图5 检测CCRM14来源下丘脑神经细胞中参与生殖功能调控相关基因的表达
讨 论
维持hESCs自我更新能力和多能性最常用的体外培养方法是饲养层支持培养[23]。之前报道的体外诱导hESCs向神经细胞分化方案中,或通过酶法利用TrypLE直接将hESCs连同饲养层一起消化为单细胞[19],或通过机械法将hESCs克隆逐一挑出进行传代及后续分化[24],亦或直接将hESCs接种于无饲养层的Matrigel上进行增殖传代用于分化[17-18,20,22]。酶法无法分离hESCs和饲养层细胞,不能排除饲养层细胞对后续诱导分化的影响;机械法虽能很好地分离hESCs和饲养层细胞,但操作难度大、耗时长,会使hESCs过长时间暴露于非培养环境,不利于之后的诱导分化;直接利用无饲养层培养成本高,且不利于规模化获得神经细胞。
本研究中,在诱导分化为神经细胞前,增加了hESCs的纯化步骤,利用hESCs、MEF对Collagenase Ⅳ和Dispase两种酶的敏感性差异,有效地分离了hESCs和MEF,且时间短、易于操作,同时避免了饲养层以及过长时间暴露于非培养环境对后续诱导分化实验的影响。本研究中诱导分化前的hESCs纯度>97%(图1B);而HNPs 的NESTIN阳性率达99.11%、NKX2-1阳性率达96.76%,较先前文献报道的80%以上的分化效率大幅提高[19,22]。本优化方案便捷、可靠、效率高,将来可促进神经细胞领域的研究。此外,我们的研究结果也表明了高纯度的hESCs更易于诱导分化为特定细胞群体,对高效诱导hESCs向其它类型细胞分化具有借鉴作用。
现有研究表明从hPSCs分化的下丘脑神经细胞与其在人体内对应的神经细胞有着极为相似的特征和功能[17-18,25],直接使用hPSCs诱导分化出的人体细胞进行基因筛选和机制研究,可克服利用动物进行研究时的耗时长、成本高等缺陷,同时也更易于获得与人体内研究一致结果,这为研究人类中枢神经系统疾病发病机制提供了理想的细胞模型。此外,与大脑中复杂环境不同的是,体外下丘脑神经细胞培养系统的复杂性低,使得在体外直接检测化学物质或药物对神经元功能的影响成为可能。目前,多种神经发育性疾病[26],神经退行性疾病[27]和代谢性疾病[20,28],已利用hPSCs成功构建了相关的疾病模型,用于阐明疾病发生、发展的线索以重现病因。
本研究获得的HNPs和类HANs,在蛋白水平上均能表达生殖功能调控相关基因KISS1以及参与雄激素应答的基因AR,提示该类神经细胞可作为细胞模型用于研究下丘脑神经细胞在生殖相关疾病中的调控作用及机制,同时为研究代谢与生殖功能之间的相互影响构建桥梁。不足的是,本研究尚未验证获得的类HANs是否能分泌具有生物学功能的神经肽类激素,本研究小组将在后续研究中完善该类神经细胞的功能鉴定。后续研究中,本研究小组将进一步验证所获得的类HANs的分泌功能,为建立探讨生殖与代谢疾病在中枢神经系统水平上的发病机制提供细胞模型。

