系统性红斑狼疮患者CD4+T细胞HDAC2、HDAC7和miR-21的表达及意义
聂 萃 刘莉莎 周 燕
(重庆市第四人民医院检验科,重庆400014)
系统性红斑狼疮(Systemic lupus erythematosus,SLE)是免疫调节发生紊乱的自身免疫性疾病,并以产生自身抗体及免疫复合物为主要特征[1]。目前SLE发病机制尚未完全阐明,以往研究认为,患者免疫系统中自身抗原失去耐受主要是T细胞与CD4+辅助T淋巴细胞等免疫活性细胞的异常活化导致,使机体免疫紊乱从而启动或持续自身免疫性疾病[2]。相关研究表明组蛋白去乙酰化酶(Histone deacetylases,HDACs)在细胞异常状态下活性增强并破坏乙酰化与去乙酰化的平衡状态,并可参与机体免疫反应调节过程[3]。随着对SLE发病机制的深入研究,发现微小RNAs(micro RNAs,miRNAs)作为一类内源性非编码小RNA分子可在多种生物学过程中发挥重要作用,研究报道指出miR-21可通过调控靶基因表达进而参与固有免疫及适应性免疫应答的调节过程,并可在多种自身免疫性疾病中异常表达[4]。但关于HDACs、miR-21与SLE间的关系尚未见报道,因此本研究主要分析SLE患者CD4+T细胞HDAC2、HDAC7和miR-21的表达水平及临床意义,为进一步揭示SLE发病机制提供参考依据。
1 资料与方法
1.1一般资料 选取2016年10月至2017年5月间我院收治的85例SLE患者为SLE组,且均符合1997年美国风湿协会修订的相关诊断标准[5],其中男22例,女63例,年龄为16~40岁,平均(25.32±9.37)岁。计算SLE活动指数(SLE disease activity index,SLEDAI)并对SLE组患者进行活动性评估,将SLEDAI评分>10作为活动组(52例),SLEDAI评分≤10作为稳定组(33例)[6]。另选取同期于我院进行体检的37例健康志愿者为对照组,其中男13例,女24例,年龄为年龄为20~36岁,平均(26.24±7.34)岁。两组临床资料比较差异无统计学意义(P>0.05),具有可比性。纳入标准:①近期未服用相关治疗药物;②未患有其他自身免疫性疾病者;③临床资料完整者;④患者与健康志愿者知情且均签署知情同意书。排除标准:①患有严重糖尿病疾病;②合并其他恶性肿瘤患者;③心脑血管疾病患者;④妊娠期妇女;⑤精神疾病者。PBS缓冲液购自Hyclone公司,RLT Buffer 裂解液购自上海易利生物科技有限公司, 总RNA提取试剂盒购自美国OMEGA公司,反转录试剂盒购自美国Promega公司,HDAC2、HDAC7等引物均由生工生物(上海)工程有限公司合成;荧光定量PCR仪购自瑞士Roche公司,Olympus BX2 生物荧光显微镜购自日本奥林巴斯公司。
1.2方法
1.2.1制备单核细胞与CD4+T细胞 抽取两组研究对象外周血10 ml并采用密度梯度离心法分离外周血单个核细胞(Peripheral blood mononuclear cell,PBMC),将PBMC细胞悬液加入PBS洗涤并进行离心,10 min后弃上清并按照约107个细胞加入80 μl缓冲液及20 μl MACS CD4磁珠的比例混匀,将其置于4℃孵育15 min并按照每107个细胞加入1~2 ml 缓冲液洗涤细胞,离心10 min后弃上清并加入500 μl缓冲液洗涤细胞。之后置LS分离柱于Midi MACS分选器中并用3 ml缓冲液湿润LS分离柱,将细胞悬液加入分离柱中并在运作期间采用3 ml缓冲液湿润LS分离柱3次,30 min后将LS分离柱移出磁场并加入5 ml缓冲液将滞留于LS分离柱中的CD4+T细胞冲出,并将其置于-80℃冻存。
1.2.2qRT-PCR法检测CD4+T细胞HDAC2、HDAC7与miR-21的表达水平 取出冻存的CD4+T细胞沉淀,解冻后加入RLT裂解液裂解细胞,按照RNA提取试剂盒说明书提取总RNA,按照反转录试剂盒说明书操作将RNA反转录为cDNA, 将CD4+T细胞cDNA稀释5倍为模板进行qRT-PCR检测。反应体系为20 μl:SYBR Green Ⅰ qPCR Master Mix 10.0 μl,上下游引物各1.0 μl,cDNA模板4.0 μl,ddH2O 4 μl。miR-21以U6为内参基因,HDAC2、HDAC7均以β-actin为内参基因,引物序列见表1。反应程序为:95℃ 15 min;94℃ 15 s,55℃ 30 s,72℃30 s,共40个循环。反应结束后收集数据,并对所得数据Ct值进行分析,采用2-ΔΔCt算法计算HDAC2、HDAC7与miR-21的相对表达量。
表1 qRT-PCR引物序列
Tab.1 qRT-PCR primer sequences
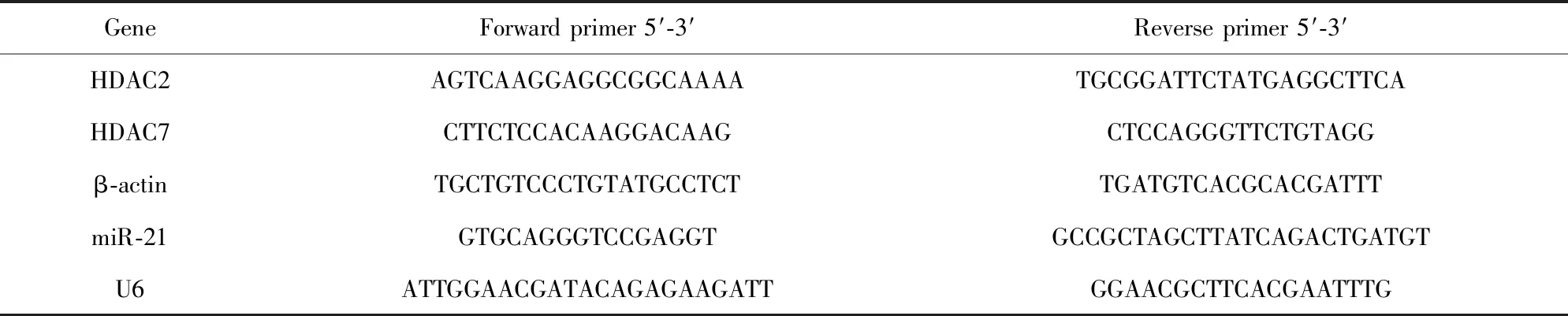
GeneForward primer 5′-3′Reverse primer 5′-3′HDAC2AGTCAAGGAGGCGGCAAAATGCGGATTCTATGAGGCTTCAHDAC7CTTCTCCACAAGGACAAGCTCCAGGGTTCTGTAGGβ-actinTGCTGTCCCTGTATGCCTCTTGATGTCACGCACGATTTmiR-21GTGCAGGGTCCGAGGTGCCGCTAGCTTATCAGACTGATGTU6ATTGGAACGATACAGAGAAGATTGGAACGCTTCACGAATTTG
1.2.3免疫学指标检测 SLE患者于入院后与健康志愿者体检时各抽取清晨空腹静脉血3 ml,并将其分别置于EDTA-K2抗凝管内,离心后吸取上层血清进行相关免疫指标检查。主要包括免疫球蛋白IgA、IgG与IgM以及补体C3与C4,采用免疫比浊法检测免疫指标并在荧光显微镜下观察[7]。
2 结果
2.1一般资料比较 两组免疫学指标存在明显差异,SLE组患者IgA、IgM、IgG水平均高于对照组,而C3、C4均低于对照组,差异均具有统计学意义(P<0.05),两组在年龄、性别等方面差异均无统计学意义(P>0.05),详见表2。
2.2SLE患者CD4+T细胞HDAC2、HDAC7与miR-21表达水平的检测结果 SLE患者活动组HDAC2、HDAC7表达水平均显著低于对照组与稳定组(P<0.05),而稳定组与对照组对比差异无统计学意义(P>0.05);SLE患者活动组miR-21表达水平显著高于对照组与稳定组(P<0.05),且稳定组与对照组对比差异无统计学意义(P>0.05),详见表3。
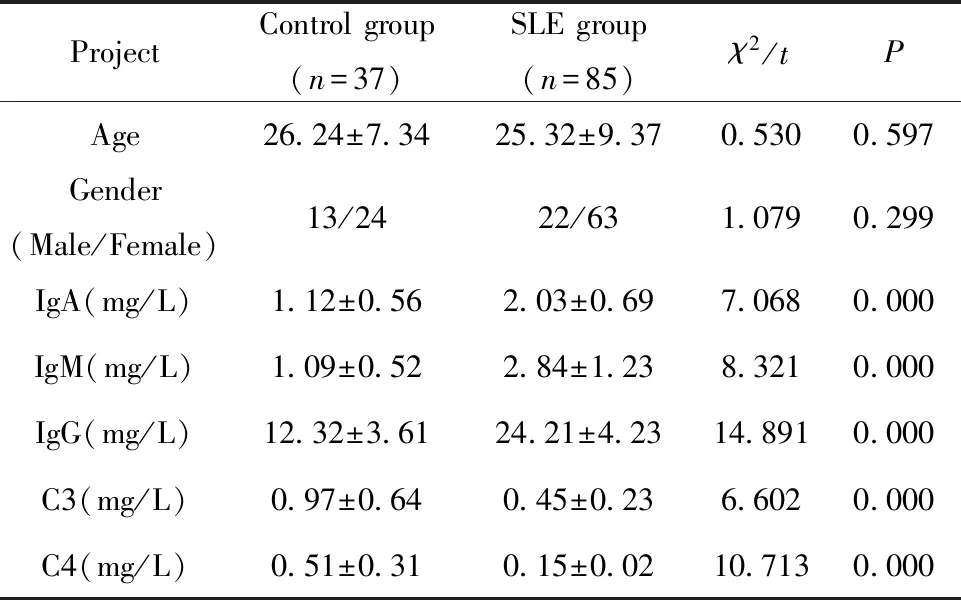
ProjectControl group(n=37)SLE group(n=85)χ2/tPAge26.24±7.3425.32±9.370.5300.597Gender(Male/Female)13/2422/631.0790.299IgA(mg/L)1.12±0.562.03±0.697.0680.000IgM(mg/L)1.09±0.522.84±1.238.3210.000IgG(mg/L)12.32±3.6124.21±4.2314.8910.000C3(mg/L)0.97±0.640.45±0.236.6020.000C4(mg/L)0.51±0.310.15±0.0210.7130.000
2.3HDAC2、HDAC7、miR-21表达水平与SLE患者免疫学指标的相关性 将SLE患者CD4+T细胞HDAC2、HDAC7、miR-21表达水平与患者免疫学指标进行相关性分析,结果显示HDAC2、HDAC7均与miR-21、IgA、IgM、IgG呈负相关,而均与C3、C4呈正相关;miR-21与IgA、IgM、IgG呈正相关,而与C3、C4呈负相关;IgA、IgM、IgG均与C3、C4呈负相关,差异均具有统计学意义(P<0.05),详见表4。
2.4ROC分析HDAC2、HDAC7与miR-21对SLE的诊断价值 结果显示HDAC2的敏感度为92.94%,特异度为64.86%,截断值为0.66;HDAC7的敏感度为92.94%, 特异度为67.57%, 截断值为0.95;miR-21的敏感度为74.12%,特异度为75.68%,截断值为1.06,详见图1、表5。
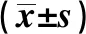
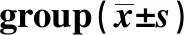
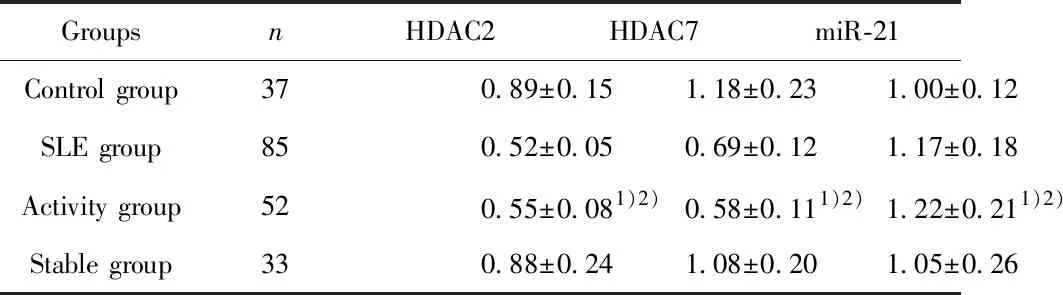
GroupsnHDAC2HDAC7miR-21Control group370.89±0.151.18±0.231.00±0.12SLE group850.52±0.050.69±0.121.17±0.18Activity group520.55±0.081)2)0.58±0.111)2)1.22±0.211)2)Stable group330.88±0.241.08±0.201.05±0.26
Note:Compared with the control group,1)P<0.05;compared with the stable group,2)P<0.05.
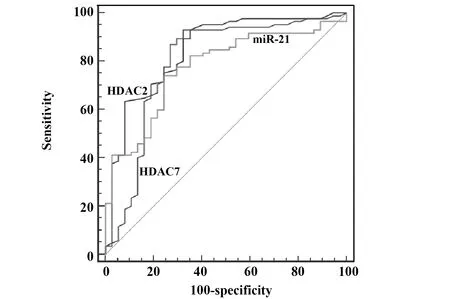
图1 HDAC2、HDAC7与miR-21对SLE的ROC分析Fig.1 ROC analysis of HLE2,HDAC7 and miR-21 for SLE
表4 HDAC2、HDAC7和miR-21表达水平与SLE患者免疫学指标的相关性(r/p)
Tab.4 Correlation of HDAC2,HDAC7 and miR-21 mRNA expression with immunological parameters of patients with SLE(r/p)
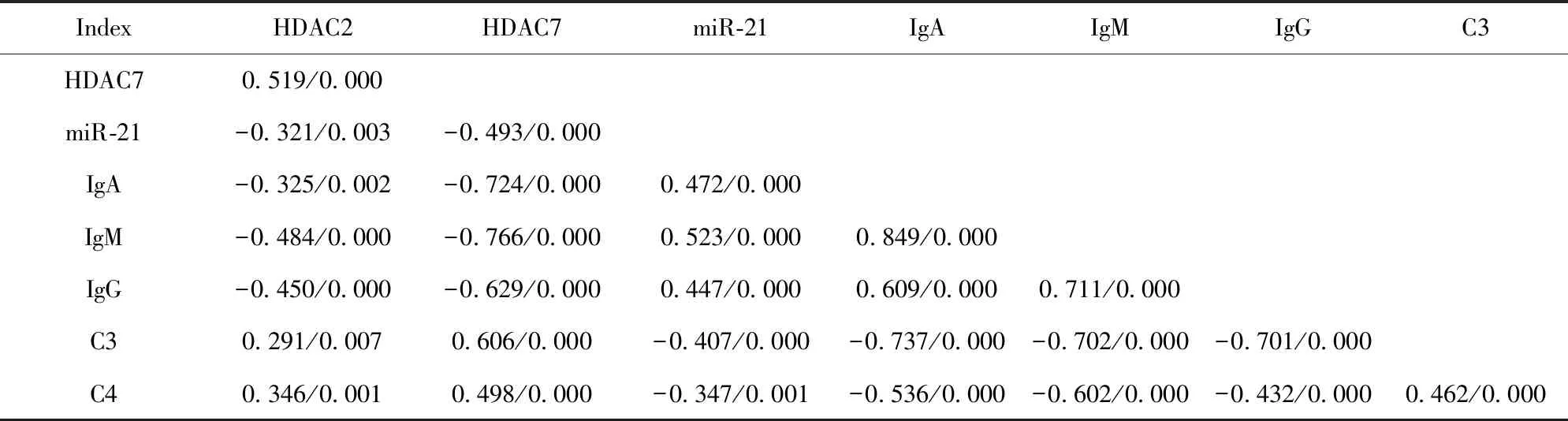
IndexHDAC2HDAC7miR-21IgAIgMIgGC3HDAC70.519/0.000miR-21-0.321/0.003-0.493/0.000IgA-0.325/0.002-0.724/0.0000.472/0.000IgM-0.484/0.000-0.766/0.0000.523/0.0000.849/0.000IgG-0.450/0.000-0.629/0.0000.447/0.0000.609/0.0000.711/0.000C30.291/0.0070.606/0.000-0.407/0.000-0.737/0.000-0.702/0.000-0.701/0.000C40.346/0.0010.498/0.000-0.347/0.001-0.536/0.000-0.602/0.000-0.432/0.0000.462/0.000
表5 HDAC2、HDAC7与miR-21对SLE的ROC分析
Tab.5 ROC analysis of HLE2,HDAC7 and miR-21 for SLE

Detection IndicatorAUCStandard errorZ statistics95% confidence intervalPHDAC20.8480.0408.6390.772-0.906<0.000HDAC70.7950.0525.6630.712-0.863<0.000miR-210.7740.0456.1510.690-0.845<0.000
表6 影响SLE相关因素的Logistic分析
Tab.6 Logistic analysis of factors affecting SLE
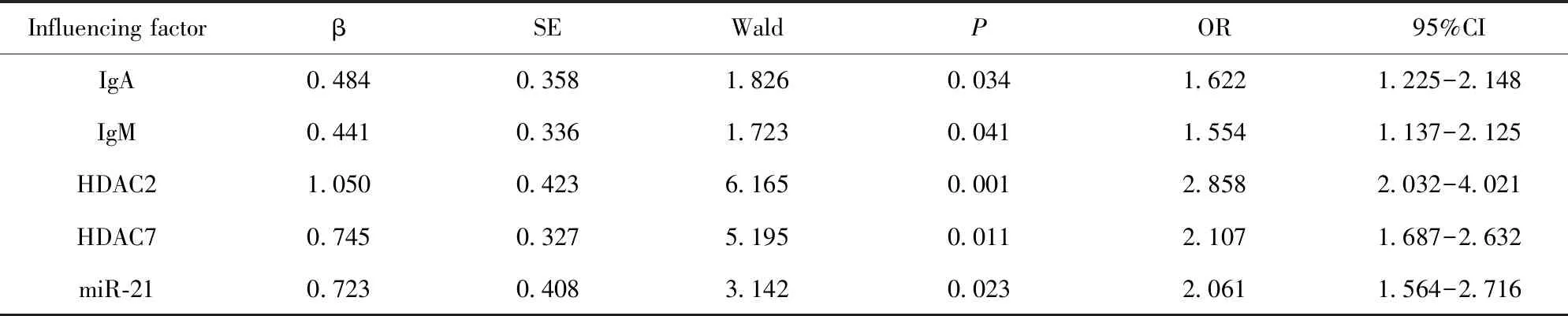
Influencing factorβSEWaldPOR95%CIIgA0.4840.3581.8260.0341.6221.225-2.148IgM0.4410.3361.7230.0411.5541.137-2.125HDAC21.0500.4236.1650.0012.8582.032-4.021HDAC70.7450.3275.1950.0112.1071.687-2.632miR-210.7230.4083.1420.0232.0611.564-2.716
2.5SLE影响因素的Logistic分析 将影响SLE发生的相关因素进行Logistic分析,结果显示HDAC2、HDAC7、miR-21、IgA及IgM水平异常均为SLE发生的危险因素,详见表6。
3 讨论
SLE是一类由多因素引起机体免疫异常的自身免疫性疾病,同时可激活局部补体系统并导致局部组织的炎症损伤[8]。其主要表现为大量自身抗体产生与免疫复合物的沉积,并可损伤肾脏、心脏等组织器官[9]。目前关于SLE发病机制尚未完全清楚,因而需寻找新方向进一步探究其发病因素以控制病情发展。研究表明CD4+T细胞与B细胞相互作用可促进体液免疫亢进并产生自身抗体进而参与SLE疾病发生过程[10]。随着生物技术进步,研究发现HDACs可通过调节组蛋白与胞内蛋白的乙酰化水平并改变细胞表型进而参与机体免疫细胞分化及免疫反应过程[11]。相关研究报道指出miR-21可通过调控T细胞中转录因子Foxp3进而参与调节性T细胞分化及发育并可影响获得性免疫细胞的功能[12]。CD4+T细胞HDACs与miR-21在SLE发生过程中是否发挥相似功能尚不明确。因此,本研究旨在探讨SLE患者CD4+T细胞HDAC2、HDAC7与miR-21的表达特点及其与患者临床免疫学指标的相关性。
HDACs可分为4大类与18个亚型,HDAC2属于HDACⅠ类亚型,研究表明HDACⅠ可通过降低肾脏血管系膜细胞炎症介质生成从而改善肾脏功能最终缓解狼疮肾炎[13]。研究发现有害颗粒的应激作用可降低HDAC2活性,HDAC2可产生白细胞介素-8、肿瘤坏死因子-α且均为炎性反应的代表性标志物,同时可调节机体的免疫反应[14]。HDACⅡ型蛋白酶分子位于细胞质并可在细胞质与细胞核间出入,HDAC7属于HDACⅡ亚型且在癌细胞中高表达,相关研究表明HDAC7在急性淋巴细胞白血病患者骨髓中表达水平与疾病发生有关,且HDAC7表达水平越低疾病进展越快[15]。研究表明HDAC7可影响p21等细胞凋亡蛋白表达,而凋亡细胞与自身免疫性疾病的发生密切相关[16,17]。关于HDAC2、HDAC7在SLE发病过程中的相关研究较少,因此本研究通过qRT-PCR法检测SLE患者与健康志愿者CD4+T细胞HDAC2、HDAC7表达水平,结果显示SLE组HDAC2、HDAC7表达水平均显著低于对照组,其中SLE活动组中两者表达水平显著低于稳定组与对照组,说明SLE患者CD4+T细胞HDAC2、HDAC7表达水平显著降低,且其表达水平降低程度与疾病进展密切相关。分析其原因可能为SLE患者CD4+T细胞HDAC2、HDAC7表达降低诱导T细胞凋亡并通过凋亡途径进而导致抗原提呈细胞提呈至反应性T细胞引起自身反应,最终导致SLE的发生。本研究结果检测并观察SLE患者免疫指标表达,结果显示IgA、IgM、IgG水平显著升高,而C3、C4显著降低,进一步分析发现HDAC2、HDAC7均与miR-21、IgA、IgM、IgG呈显著负相关,而均与C3、C4呈显著正相关,且研究报道指出IgA、IgM等免疫学指标用于鉴别SLE并可反映疾病严重程度[18]。提示SLE发病时外周血CD4+T细胞等发生作用活化T细胞并释放大量细胞因子而降低HDAC2、HDAC7表达水平进而促进疾病进展。本研究采用ROC法分析HDAC2、HDAC7对SLE的临床诊断价值,结果显示HDAC2与HDAC7均具有较高的灵敏度与特异度,推测HDAC2与HDAC7可作为临床早期诊断SLE的重要指标。
miR-21位于人类17q23.2染色体,研究表明miR-21可调控程序性死亡分子4、转录信号转导子和激活子3等转录因子、细胞因子表达进而参与机体免疫细胞的凋亡、分化及生成等过程[19]。miR-21在银屑病病灶的上皮细胞中表达水平显著升高,将其转染CD4+T细胞后导致CD4+T细胞凋亡并参与银屑病发生过程[20]。相关研究表明溃疡性结肠炎患者体内miR-21表达水平显著升高,miR-21可能通过Toll样受体(Toll-like receptors,TLR)途径影响T细胞的分化及功能进而参与肠内炎症及免疫应答过程[21]。与此相似,本研究结果显示SLE活动组miR-21表达水平显著高于对照组与稳定组,且稳定组与对照组差异无统计学意义,说明SLE患者miR-21呈高表达且参与疾病发生过程。本研究将miR-21表达水平与患者免疫血清指标进行相关性分析,结果显示miR-21与IgA、IgM、IgG呈显著正相关,而均与C3、C4呈显著负相关,提示miR-21表达水平升高导致机体免疫耐受功能下降并产生大量自身抗体进而加快SLE进展。ROC分析结果显示miR-21的敏感度为74.12%,特异度为75.68%,截断值为1.06,说明检测SLE患者miR-21表达水平高于1.06时可判断疾病是否已发生。同时本研究发现HDAC2、HDAC7均与miR-21呈显著负相关,且Logistic回归分析显示HDAC2、HDAC7、miR-21、IgA及IgM水平异常均为SLE发生的危险因素。本研究结果揭示SLE患者CD4+T细胞HDAC2、HDAC7及miR-21表达水平异常与疾病活动程度有关,且均可导致疾病的恶性发展。
综上所述,SLE患者CD4+T细胞HDAC2、HDAC7表达水平显著降低,而miR-21表达水平显著升高,HDAC2、HDAC7均与miR-21呈负相关且均可参与SLE发生及进展过程,检测CD4+T细胞HDAC2、HDAC7及miR-21表达水平有助于临床早期诊断SLE及评估病情进展。本研究存在不足之处,关于HDAC2、HDAC7与miR-21在SLE发病过程中的具体作用机制有待进一步研究。

