黄芪多糖治疗和预防性给药对感染PR8小鼠的保护作用及机制研究①
卢春化 马艳梅 王红霞 薛 凌
(锦州医科大学附属第一医院,锦州121000)
流感病毒感染所致的“细胞因子风暴”是高发病率和病死率的主要原因,机体感染后可产生一系列细胞因子,如TNF-α、IFN-α、IFN-β、IL-6、IL-1、MCP-1等[1-2]。炎症介质失衡的同时产生过量的氧自由基,引起脂质过氧化,直接诱导组织损伤。MDA、GSH-Px及SOD水平是监测脂质过氧化的代表性指标。MDA是脂质过氧化作用的终产物,反映脂质过氧化程度[3]。而SOD、GSH及GSH-Px是维持机体氧化系统平衡的关键酶。当损伤性刺激破坏内膜氧化呼吸链,激发氧化应激时,产生的活性氧、脂类、氧化蛋白质等激活Caspase-3、Caspase-8,诱导细胞凋亡[4]。
近来研究发现黄芪多糖具有抗癌、抗病毒、抗凋亡、抗氧化等多种生物活性[5]。本实验通过构建小鼠流感肺损伤模型,应用黄芪多糖干预,探讨其对PR8所致小鼠肺损伤的保护机制。
1 材料与方法
1.1材料
1.1.1实验动物 SPF级C57BL/6小鼠40只,6周龄,雌性,体质量18~20 g,购自北京维通利华有限公司。
1.1.2主要试剂 黄芪多糖(C10H7ClN2O2S,分子量254.69)购自中国药品生物制品检定所;SOD、MDA、GSH试剂盒购自南京建成生物工程研究所;RNA提取及qPCR检测试剂盒购自QIAGEN;Caspase-3、8、9及β-actin抗体购自Abcam。
1.2方法
1.2.1小鼠模型的建立及给药 分为正常对照组、PR8模型组、黄芪多糖治疗组、黄芪多糖预防组、利巴韦林对照组,每组8只。黄芪多糖预防组:于感染流感病毒PR8前7 d,给予黄芪多糖200 mg/(kg·d),灌胃给药,连续给药7 d。之后用乙醚将各组小鼠麻醉,正常对照组滴鼻30 μl无菌PBS,其余各组滴鼻30 μl PR8稀释液(滴度:103pfu/鼠)[6]。除预防组外,各组小鼠在PR8感染24 h 后灌胃,1次/d,连续4 d。正常对照组和PR8模型组:灌胃100 μl无菌PBS;黄芪多糖治疗组灌胃100 μl 黄芪多糖(2 000 mg/kg),利巴韦林对照组灌胃利巴韦林(100 mg/kg)。
1.2.2标本采集 PR8感染后第5天进行眼球采血,加入含EDTA-Na2的采血管中,3 000 r/min离心10 min,吸上清于EP管,-20℃保存。打开胸腔无菌取肺。
1.2.3小鼠肺指数和肺指数抑制率 肺组织用无菌PBS洗净、吸干,称重。肺指数=(肺重/体质量)×100%,肺指数抑制率=(模型组平均肺指数-实验组平均肺指数)/模型组平均肺指数×100%。
1.2.4肺组织HE染色 肺左叶用4%多聚甲醛固定,石蜡包埋,切片,HE染色。
1.2.5SOD、GSH-Px、MDA水平 检测血清和肺组织中MDA、SOD、GSH-Px水平,按试剂说明书进行。
1.2.6qPCR检测TNF-α、IFN-α、IL-6、IL-1β mRNA水平 用QIAGEN组织匀浆器将小鼠肺组织匀浆,提取总RNA。引物由TaKaRa公司合成,见表1。反应条件95℃ 5 min;95℃ 25 s,60℃ 25 s,72℃ 30 s 40 个循环。采用2-ΔΔCT法计算基因相对表达量。
1.2.7Western blot检测凋亡蛋白表达 肺组织剪碎,液氮研磨,将研好组织转至1.5 ml EP管中,加入800 μl Lysis buffer与PMSF的混合液,4℃ 12 000 r/min 离心10 min,吸上清液至EP管中,进行BSA定量。100℃ 10 min变性,进行SDS-PAGE。加样10 μl,电压调至80 V,电泳约20 min,调电压至110 V,待所检测条带跑至适合的位置停止电泳。120 mA恒流120 min转膜,5%BSA室温封闭1 h。加1∶1 000 Caspase-3/1∶1 000 Caspase-8/1∶1 000 Caspase-9/1∶5 000 actin一抗稀释液后,自封袋压膜,4℃摇床过夜。加1∶5 000羊抗兔IgG二抗,室温孵育1 h。ECL发光,8 bit存图。Scion Image 4.03软件分析。
1.3统计学分析 用SPSS17.0进行统计分析,运用单因素方差分析、两两比较法(LSD法)分析结果。以P<0.05表示差异有统计学意义。
2 结果
2.1黄芪多糖对肺指数和肺指数抑制率的影响 PR8模型组与正常对照组肺指数比较,差异有统计学意义(P<0.01);黄芪多糖治疗组、预防组、利巴韦林对照组与PR8模型组比较差异有统计学意义(P<0.01;P<0.05;P<0.01),见表2。
2.2HE染色 PR8模型组肺组织出现弥漫性肺水肿及出血,肺组织实变及炎性细胞浸润,部分肺泡间隔破损断裂。黄芪多糖治疗组和利巴韦林对照组较PR8模型组病变减轻,形态较完整,有少量炎性细胞渗出。黄芪多糖预防组肺泡壁呈轻度增厚,伴肺泡损伤出血,有中度炎性细胞渗出,见图1。
表1 引物序列
Tab.1 Primer sequence

Primer nameDirectionSequenceTNF-αF5′-TCAAGTGGCATAGATGTGGAAGAA-3′R5′-TGGCTCTGCAGGATTTTCATG-3′IFN-αF5′-GTCACTACGAATCGCACCTGATCAC-3′R5′-CCGATGTATAGACATTCCTCTGG-3′IL-6F5′-TGATGCACTTGCAGAAAACAA-3′R5′-GGTCTTGGTCCTTAGCCACTC-3′IL-1βF5′-AAGGAGAACCAAGCACGACAAAA-3′R5′-TGGGGAACTCTGCAGACTCAAACT-3′GAPDHF5′-TGCACCACCAACTGCTTAG-3′R5′-GGATGCAGGGATGATGTTC-3′
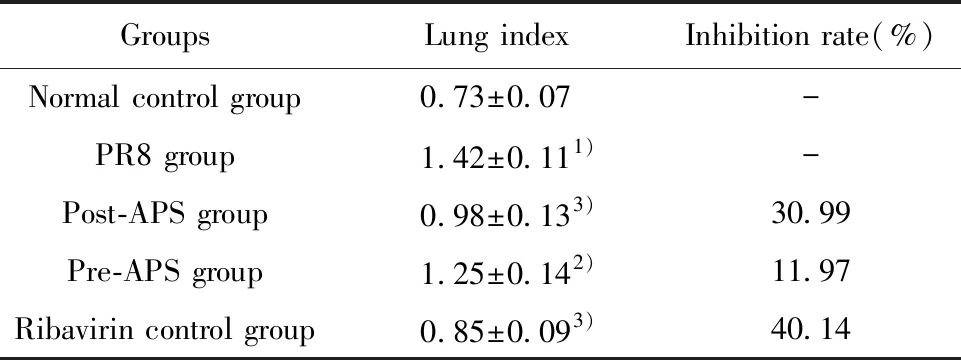
GroupsLung indexInhibition rate(%)Normal control group0.73±0.07-PR8 group1.42±0.111)-Post-APS group0.98±0.133)30.99Pre-APS group1.25±0.142)11.97Ribavirin control group0.85±0.093)40.14
Note:Compared to group A,1)P<0.01;compared to group B,2)P<0.05,3)P<0.01.
2.3血清及肺组织中MDA、GSH-Px、SOD水平 PR8模型组与正常对照组相比,MDA显著升高(P<0.01),GSH-Px、SOD活性显著降低(P<0.01);与PR8模型组比较,黄芪多糖治疗组和利巴韦林对照组MDA含量显著降低(P<0.01),GSH-Px、SOD活性显著升高(P<0.01);与PR8模型组比较,黄芪多糖预防组MDA水平在一定程度上降低(P<0.05),GSH-Px、SOD活性呈上升趋势 (P<0.05)。见表3、4 。
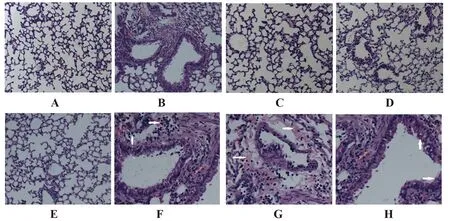
图1 肺组织病理变化(A~E,×100;F~H,×400)Fig.1 Pathological changes of lung tissue(A-E,×100;F-H,×400)Note: A.Normal control group;B.PR8 group;C.Astragalus polysaccharide treatment group;D.Astragalus polysaccharide prevention group;E.Ribavirin control group;F.Infiltration of inflammatory cell (PR8 group);G.Diffuse hyperplasia of the surrounding tissues of the trachea (PR8 group);H.Inflammatory exudate of the trachea (PR8 group).
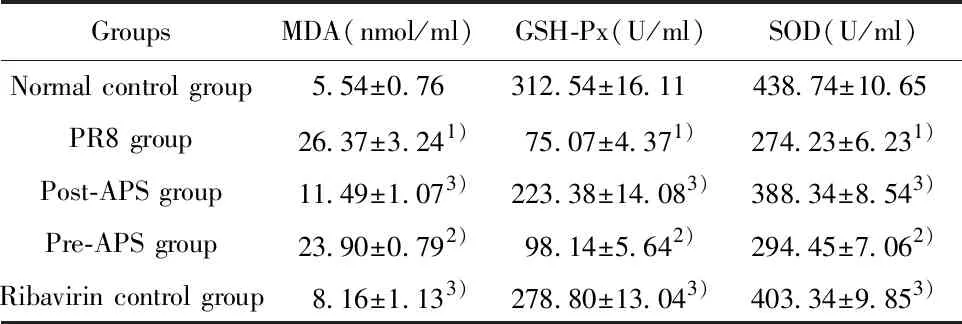
GroupsMDA(nmol/ml)GSH-Px(U/ml)SOD(U/ml)Normal control group5.54±0.76312.54±16.11 438.74±10.65 PR8 group26.37±3.241)75.07±4.371)274.23±6.231)Post-APS group11.49±1.073)223.38±14.083)388.34±8.543)Pre-APS group23.90±0.792)98.14±5.642)294.45±7.062)Ribavirin control group8.16±1.133)278.80±13.043)403.34±9.853)
Note:Compared to group A,1)P<0.01;compared to group B,2)P<0.05,3)P<0.01.
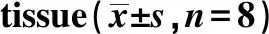
GroupsMDA(nmol/mg prot)GSH-Px(U/mg prot)SOD(U/mg prot)Normal control group0.87±0.0834.50±1.4042.07±2.03PR8 group3.88±0.111)19.08±0.561)26.86±1.691)Post-APS group1.95±0.143)25.43±1.073)34.86±2.323)Pre-APS group3.27±0.162)21.72±1.382)29.53±2.172)Ribavirin control group1.36±0.073)29.98±1.233)35.87±2.013)
Note:Compared to group A,1)P<0.01;compared to group B,2)P<0.05,3)P<0.01.
2.4TNF-α、IL-6、IL-1β、IFN-α mRNA表达水平 PR8模型组肺组织中TNF-α、IL-6、IL-1β、IFN-α mRNA表达量较正常对照组明显减少(P<0.01),黄芪多糖治疗组、预防组和利巴韦林对照组TNF-α、IL-6、IL-1β、IFN-α 表达与PR8模型组比较显著降低(P<0.01)。见图2 。
2.5凋亡相关蛋白表达情况 PR8模型组肺组织中Caspase-3、8、9蛋白表达量较正常对照组明显增加(P<0.01);黄芪多糖治疗组、预防组和利巴韦林对照组Caspase-3、8、9蛋白表达量较PR8模型组明显减少(P<0.01)。见图3、4。
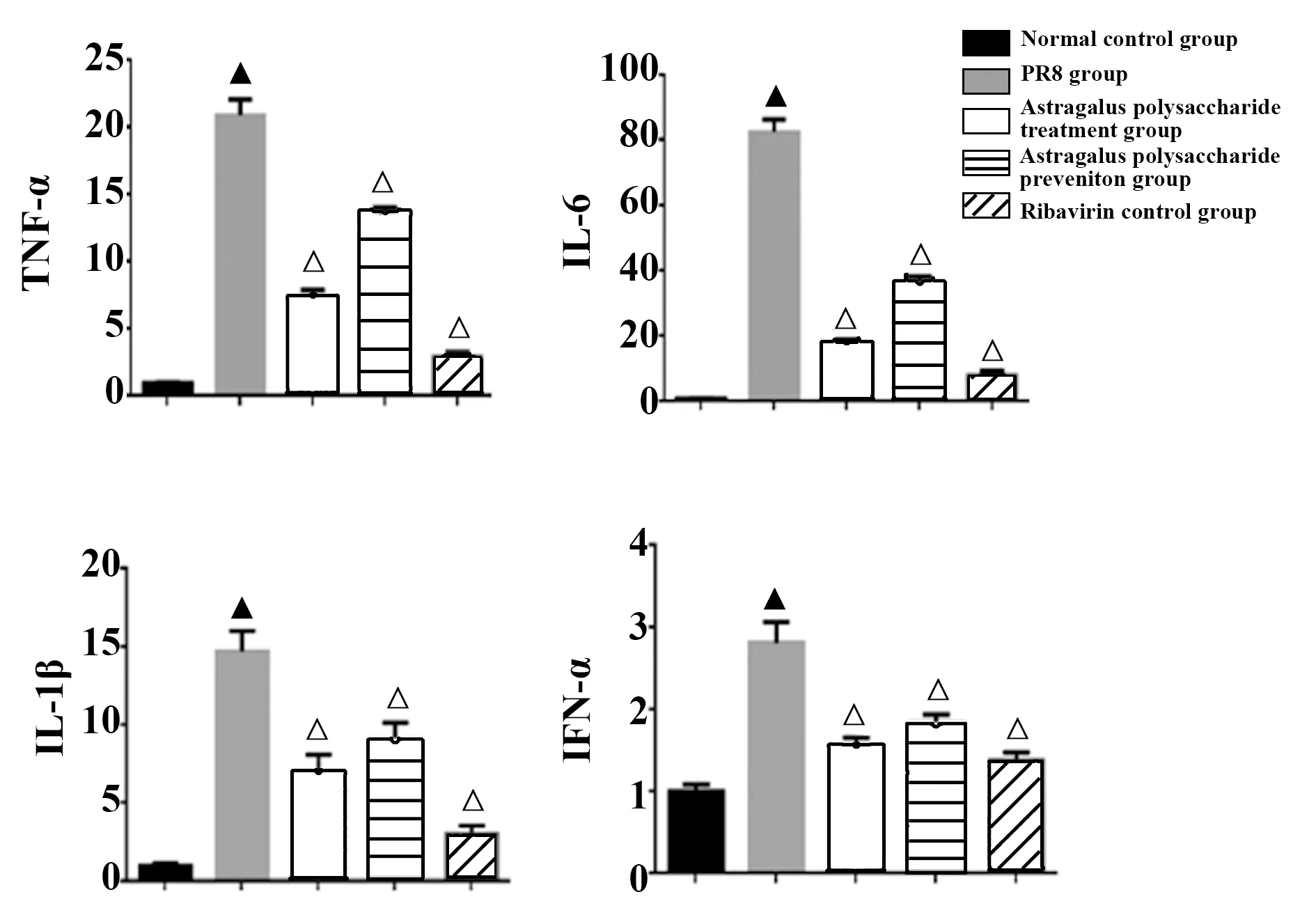
图2 肺组织TNF-α、IL-6、IL-1、IFN-α mRNA相对表达量Fig.2 Relative expression levels of TNF-α,IL-6,IL-1 and IFN-α mRNA of lung tissueNote: Compared to normal control group,▲.P<0.01;compared to PR8 group,△.P<0.01.
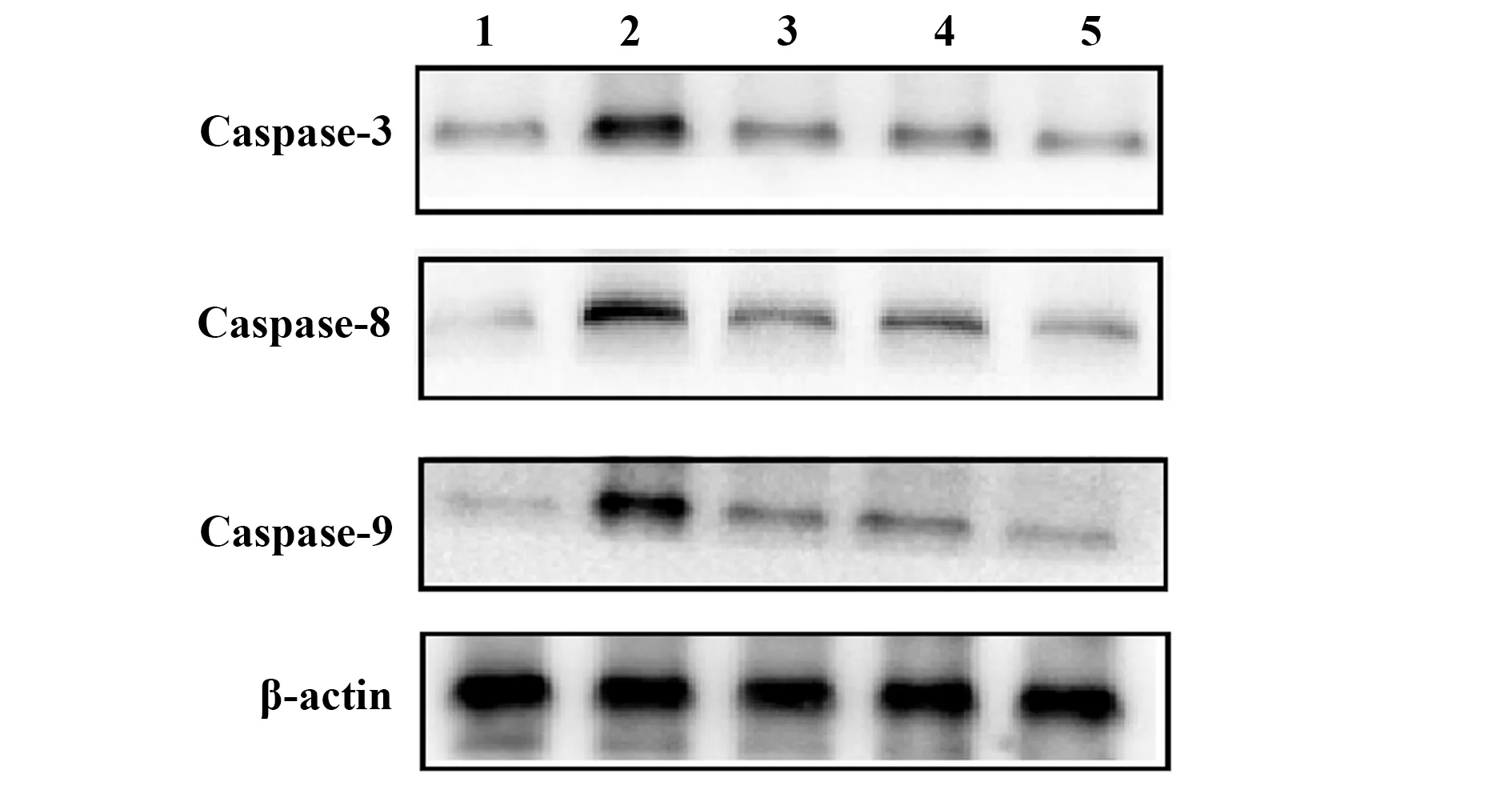
图3 肺组织凋亡相关蛋白Caspase-3、8、9的表达Fig.3 Expression of apoptosis-associated protein Caspase-3,8,and 9 in lung tissueNote: 1.Normal control group;2.PR8 group;3.Astragalus polysaccharide treatment group;4.Astragalus polysaccharide prevention group;5.Ribavirin control group.
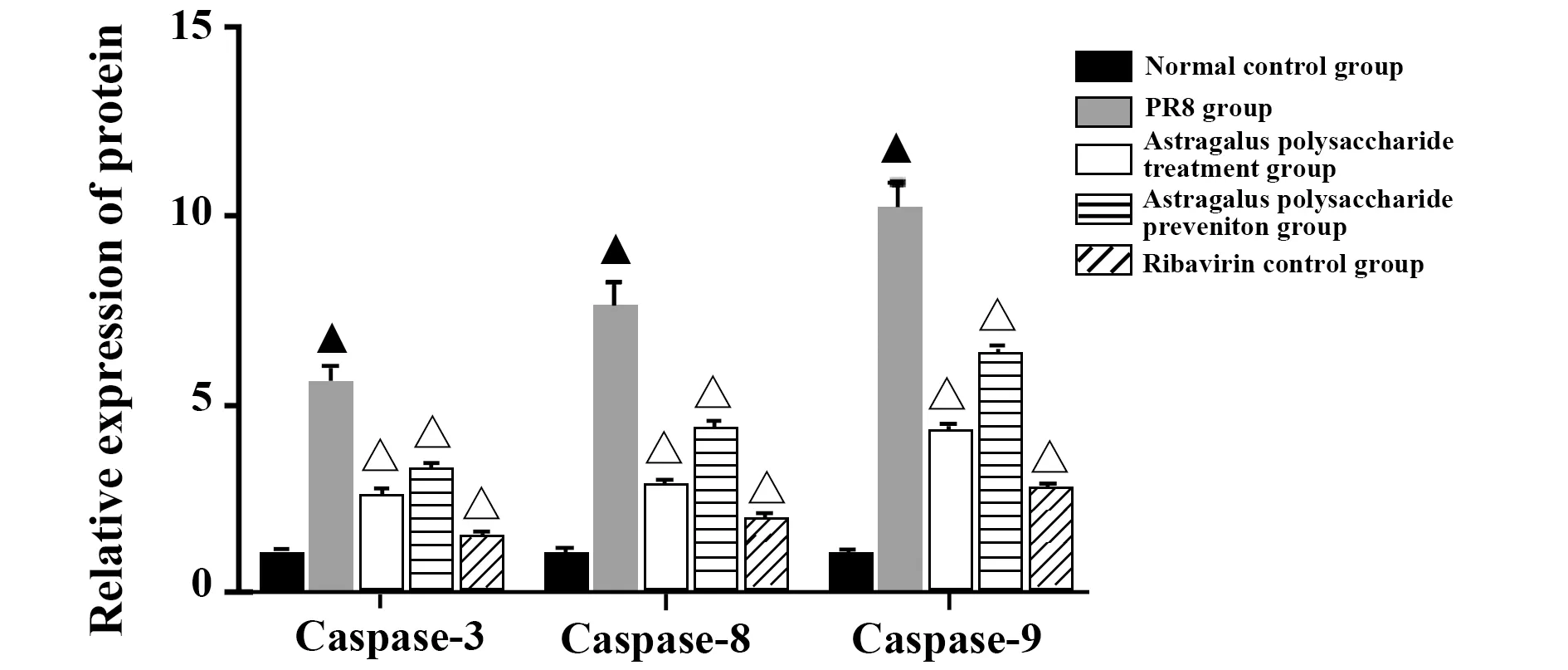
图4 肺组织凋亡相关蛋白Caspase-3、8、9的相对表达量Fig.4 Relative expression levels of apoptosis-related proteins Caspase-3,8,and 9 of lung tissueNote: Compared to normal contrl group,▲.P<0.01;compared to PR8 group,△.P<0.01.
3 讨论
流感病毒所致机体急性肺损伤主要机制“细胞因子风暴”,流感病毒感染机体后通过级联放大效应,诱导细胞因子如TNF-α、IFN-α、IL-6、IL-1β的大量产生。炎症介质失衡诱发脂质过氧化,最终导致组织损伤。抗氧化物谷胱甘肽(GSH)、超氧化物歧化酶(SOD)等所维持的氧化还原平衡失调,导致外源性或内源性氧化物堆积,激发机体氧化应激反应。大量研究结果表明,氧化损伤是病毒诱发细胞损伤或凋亡的主要途径,通过启动JNK对转录因子磷酸化修饰并调节下游靶基因转录,激活Caspase蛋白家族,诱导细胞凋亡[7]。
实践证明,黄芪多糖是中医治疗肺热咳嗽,高热烦渴的有效药物,具有免疫调节、抗氧化和抗炎以及抗癌等多种功效[8]。Abdullahi等[9]报道黄芪多糖和人参多糖能提高血清IgG抗体水平和细胞因子(IL-2、IL-10和IFN-γ)表达,具备改善免疫应答的潜力,可用作H5N1疫苗制剂的佐剂。本实验结果显示,黄芪多糖治疗和预防性给药均显著改善PR8小鼠肺病理损伤,对小鼠急性肺损伤发挥保护作用,可见,黄芪多糖不仅可应用于治疗流感感染,还可作为流感的预防性用药。而黄芪多糖是否可以用于甲型H1N1疫苗的佐剂以提高疫苗的预防效果仍需要进一步的研究。本研究发现,黄芪多糖治疗和预防给药降低细胞因子TNF-α、IFN-α、IL-6、IL-1β表达,缓解因炎症介质失衡而引起的脂质过氧化,并能显著上调抗氧化物GSH-Px、SOD活性以改善机体的氧化还原状态,提高机体的抗氧化水平。Zhang等[10]实验表明黄芪多糖下调炎症相关因子IL-1β、IL-6、IL-8和TNF-α mRNA水平,抑制禽传染性支气管炎病毒(IBV)在鸡胚肾细胞中复制。Xue等[11]研究发现黄芪多糖降低氧化应激反应以抑制猪圆环病毒2型(PCV2)复制,降低细胞中MDA水平,提高GSH-Px和SOD活性。由此可见,炎症反应、氧化应激与病毒感染紧密相关,黄芪多糖能下调流感病毒引发的过度炎症损伤和氧化应激水平。
PR8组凋亡相关蛋白Caspase-3、8、9显著上升,提示PR8通过诱导细胞凋亡引发肺损伤。应用黄芪多糖干预后,机体通过下调Caspase-3、8、9表达,发挥对肺组织的保护作用。由此可见,黄芪多糖在缓解流感急性肺损伤进程中具有积极作用。Xie等[12]在对黄芪多糖干预人心脏微血管内皮细胞(HCMEC)缺氧/复氧(HR)损伤机制时发现,黄芪多糖通过降低ROS、MDA和Bax水平,抑制Caspase-3的活性,提高NO、SOD、Bcl-2、PI3K水平,以保护HCMEC免受缺氧/复氧损伤。Liu等[13]研究发现黄芪多糖下调Caspase-3、Bax及上调Bcl-2蛋白水平,减少细胞内活性氧水平,逆转心肌缺血再灌注诱导的细胞凋亡。结合MDA、GSH-Px、SOD指标,分析可见PR8所致的脂质超氧化产物堆积及细胞抗氧化水平降低,这两方面共同促进细胞凋亡,而黄芪多糖通过提高胞内过氧化物分解酶活性,缓解脂质过氧化进程,提高机体抗氧化水平,缓解细胞凋亡进程。最新研究显示,细胞凋亡在甲型流感病毒感染的早期阶段增加,在感染的晚期细胞焦亡占主体。提示在H1N1感染的早期阶段病毒诱导机体发生细胞凋亡,但细胞死亡途径在感染的晚期向细胞焦亡转变[14]。下一步本课题组将研究黄芪多糖对PR8感染小鼠晚期细胞焦亡的影响,以期探索H1N1感染过程中细胞焦亡的发生及黄芪多糖的免疫调节机制。
综上所述,黄芪多糖通过下调炎性细胞因子的表达,有效减少PR8所致急性肺损伤氧自由基的产生,提高对氧自由基的清除力,下调凋亡相关蛋白Caspase-3、8、9的表达,从而发挥抗细胞凋亡及保护肺组织的作用,为临床应用中药黄芪多糖治疗流感提供依据,为中医药治疗流感提供新思路。