气相色谱法同时测定复方丹参片中樟脑残留量及冰片含量
刘 斌,李祥兰,王晓晓,尹亚玲
(四川省德阳市食品药品安全检验检测中心,四川 德阳 618000)
复方丹参片组方中,冰片为佐使药,有开窍醒神、清热止痛功效,可引诸药入心经[1]。由于其具有挥发性,在加工与存储过程中含量易下降[2],且市售冰片与樟脑气味相似,功效不同,价格差异较大,易被冒用。而药典该品种项下只有冰片的鉴别而无含量测定项;原国家食品药品监督管理总局药品检验项下补充检验方法和检验项目批准件(复方丹参片批准件编号为2008010,以下简称“批准件”),对樟脑残留量进行了检测;文献[3]报道了毛细管气相色谱法测定复方丹参片中冰片的含量。本研究中参考文献[4-9]建立了同时测定上述两指标的方法。由于冰片的主要成分是龙脑和异龙脑[10],故以2种成分含量之和来判断冰片的含量[11]。现报道如下。
1 仪器与试药
1.1 仪器
7890B型气相色谱仪、7693型进样器、氢火焰离子化检测器(FID)(美国安捷伦公司);SPH-300A型氢气发生器、SPB-3全自动空气源(北京中惠普分析技术研究所);XS205型电子天平(梅特勒-托利多仪器<上海>有限公司);KQ-700DV型数控超声波清洗器(昆山市超声仪器有限公司)。
1.2 试药
樟脑对照品(批号为 110747-201409,含量为98.7%)、龙脑对照品(批号为110881-201709,含量为99.6%)、异龙脑对照品(批号为111512-201603,含量为96.7%),均购于中国食品药品检定研究院;水为纯化水,无水乙醇和乙醇均为分析纯(成都市科隆化学品有限公司);复方丹参片样品均来自2018年四川省食品药品监督管理局药品评价性抽样,详见表1。
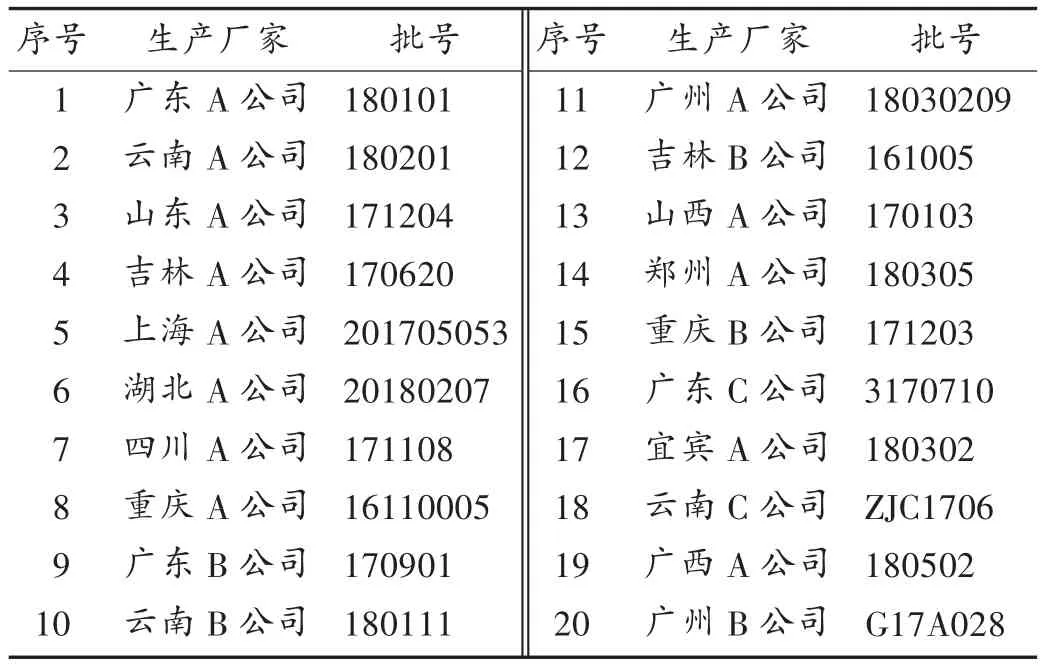
表1 复方丹参片样品来源
2 方法与结果
2.1 色谱条件
色谱柱:Agilent 17903-113I聚乙二醇-20 m毛细管色谱柱(30 m ×0.25 mm,0.25 μm);温度:进样口为220℃,气化室为250℃,FID为 250℃;流速:载气高纯度氮气为3 mL/min,氢气为40 mL/min,空气为400 mL/min,尾吹为 35 mL/min;柱温:程序升温,初始温度为100℃,保持5 min,以10℃ /min的速率升温至110℃,保持5 min,再以相同速率升温至160℃,保持 4 min;分流比为 5∶1。
2.2 溶液制备
对照品溶液:称取樟脑、龙脑、异龙脑对照品适量,精密称定,加无水乙醇溶解,制成每1 mL含樟脑0.1 mg、龙脑0.3mg、异龙脑0.2mg的混合对照品溶液。
供试品溶液:取样品10片,包衣片除去包衣,研细,取约60 mg,精密称定,置10 mL容量瓶中,加入无水乙醇 8 mL,超声(40 kHz,320 W)处理 30 min,放冷,加无水乙醇定容,摇匀,滤过,滤液经0.45 μm微孔滤膜滤过,取续滤液,即得。
阴性对照溶液:按复方丹参片处方比例,配制缺冰片的阴性样品,再按供试品溶液制备方法制备,即得[12]。
2.3 方法学考察
专属性试验:精密吸取2.2项下3种溶液各1 μL,按拟订色谱条件分别进样检测,色谱图见图1。结果樟脑、龙脑和异龙脑对照品的理论板数分别为23 147,35 822,35 380,远大于“批准件”规定的 5 000。供试品溶液色谱图中,未检出与樟脑对照品溶液保留时间相同的色谱峰,阴性对照品溶液色谱图中在与龙脑和异龙脑相同保留时间处无干扰峰,表明该方法专属性良好。
线性关系考察:精密量取樟脑对照品溶液,龙脑、异龙脑混合对照品溶液各适量,分别置10 mL容量瓶中,加无水乙醇稀释定容,摇匀。分别取1 μL注入气相色谱仪,以待测成分质量浓度(X)为横坐标、峰面积(Y)为纵坐标进行线性回归,得回归方程分别为Y1=3.045X1+0.997(r=0.9998,n=5);Y2=2.930X2+0.633(r=0.9997,n=5);Y3=3.188X3+0.723(r=0.999 6,n=5)。质量浓度线性范围分别为4.513~56.407 μg/mL,13.932~174.151 μg/mL,9.098 ~ 113.719 μg/mL。
精密度试验:精密吸取2.2项下对照品溶液及混合对照品溶液各适量,按拟订色谱条件重复进样6次,测定峰面积。结果樟脑、龙脑与异龙脑峰面积的RSD分别为0.87%,0.63%,0.30%(n=6),表明仪器精密度良好。
稳定性试验:精密吸取同一供试品溶液(批号为161005),室温下分别放置 0,4,8,12,16,20,24 h 时按拟订色谱条件进样,记录峰面积。结果均未检出樟脑,龙脑与异龙脑峰面积的RSD分别为1.85%和1.05%(n=7),表明供试品溶液室温下放置24 h稳定。
重复性试验:精密称取同一批(批号为161005)样品6份,按拟订色谱条件测定,结果均未检出樟脑,龙脑和异龙脑平均含量的RSD分别为1.40%和1.10%(n=6),表明该方法的重复性良好。
樟脑检出限及定量限:取2.2项下对照品溶液和混合对照品溶液倍比稀释,进行测定。当信噪比(S/N)为3∶1时,樟脑检出限为0.187 6 mg/kg,当S/N为10∶1时,其定量限为0.746 6 mg/kg。
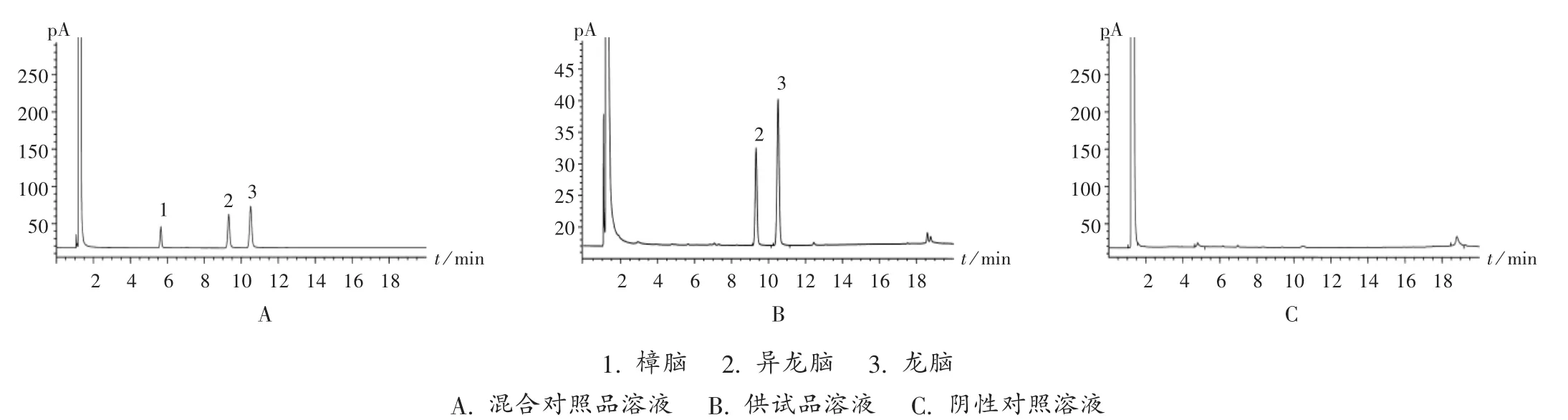
图1 气相色谱图
回收率试验:称取已知樟脑、龙脑、异龙脑含量的样品6份,精密称定,分别精密加入樟脑、龙脑、异龙脑对照品适量,按拟订色谱条件进样测定,记录峰面积,并计算含量。结果见表2和表3。

表2 樟脑回收率试验(n=6)
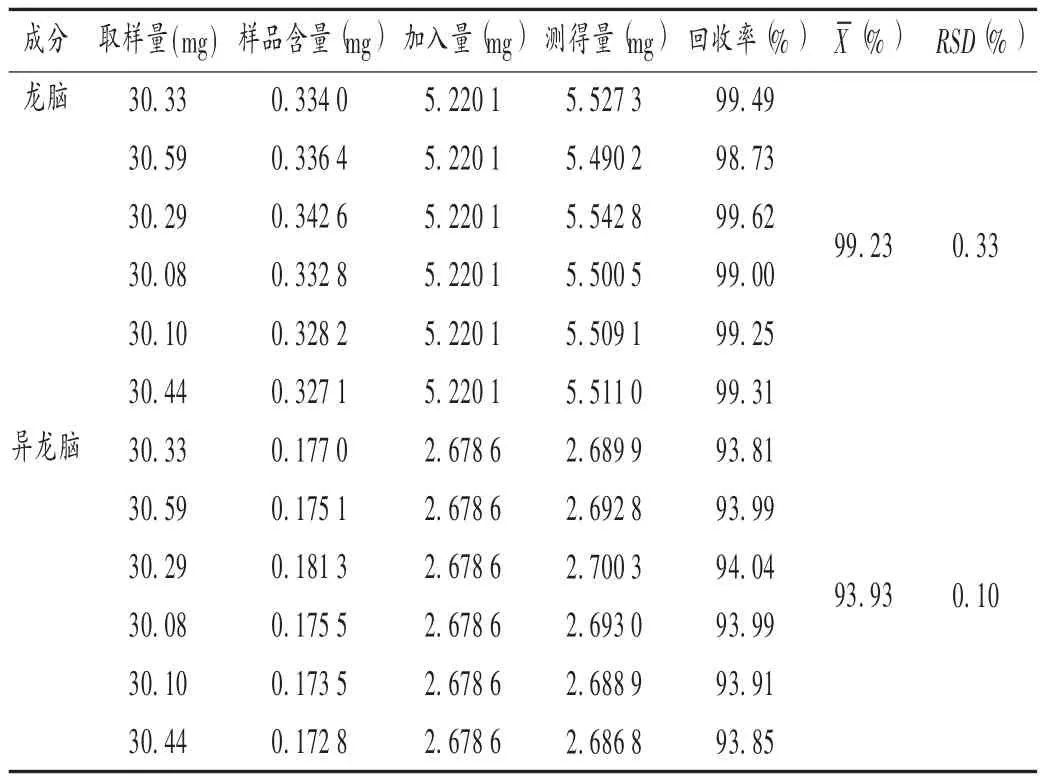
表3 龙脑、异龙脑加样回收试验(n=6)
2.4 样品含量测定
取20批复方丹参片样品粉末,各2份,依法制备供试品溶液,再按拟订色谱条件进样,测定样品含量[12]。结果见表4。
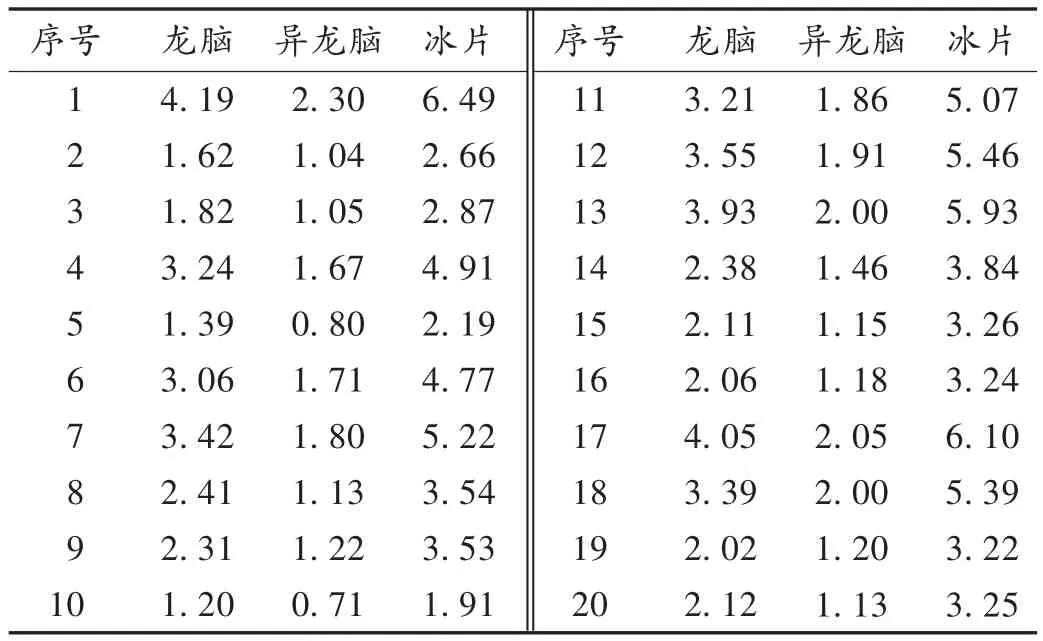
表4 复方丹参片中樟脑残留量与冰片含量测定结果(mg/片)
3 讨论
陈玉谊等[13]已对复方丹参片中冰片的2种提取方法——超声提取法和回流提取法进行了比较[13],但未对浸渍方法进行说明,为了更有效地提取制剂中的冰片,故采用超声提取30 min和浸渍过夜方法进行比较,溶剂仍采用易溶解冰片的无水乙醇,结果显示,2种提取方法样品含量无显著差异。为方便起见,采用超声提取30 min的方法。
各厂家生产的复方丹参片内在质量参差不齐,参考杨建龙等[14]的方法测定复方丹参片中异龙脑和龙脑的含量。由于其法定标准中只规定了丹参的丹参酮ⅡA、丹酚酸B及三七的含量限度,未规定冰片的含量限度,导致不同厂家经不同工艺生产出的产品中冰片含量差异较大,最低含量甚至不到理论含量的1/4,而按规定标准检验均符合规定。故若能控制冰片含量,则既能充分发挥其芳香走窜特性,又能减少寒凉特性对胃肠道的刺激[15]。建议对冰片的含量进行控制,严格监管药品生产企业关于冰片的投料和生产工艺,并采用气相色谱法同时测定多家复方丹参片并进行比较,以保证其临床用药的有效性。

