藿夏胶囊的提取和成型工艺研究*
梁丽莉 ,王柳萍 ,林忠秋 ,黄光明 ,谭承梅 ,杨 斌 ,黄兴振 △
(1.广西医科大学药学院,广西 南宁 530021; 2.广西中医药大学药学院,广西 南宁 530299;3.广西医科大学第一附属医院,广西 南宁 530000)
藿夏胶囊源于民间验方,主要由淫羊藿、夏枯草等中药提取物组方。方中淫羊藿Epimedium brevicornuMaxim.多用于高血压、乳房肿块等症的临床治疗。淫羊藿苷抗肿瘤作用显著,可抑制肿瘤细胞增殖、诱导细胞分化、促进细胞凋亡及增强机体免疫力等[1]。夏枯草Prunella vulgarisL.为唇形科双子叶植物夏枯草的干燥果穗,有软坚散结、清火明目功效[2]。本课题组前期开展的安全性和药效学研究结果显示,在藿夏胶囊治疗剂量下,试验动物多项生理指标及临床检验指标均未显示出毒性反应。血清药理学试验结果表明,其含药血清对人大细胞肺癌H460细胞的抑制率24 h时达65.7%,48 h时达68.84%(P<0.01)。为建立藿夏胶囊的质量标准,本研究中采用正交试验法优选其提取工艺并确定成型工艺,为该制剂提供合理的提取和制剂成型方案。现报道如下。
1 仪器与试药
1.1 仪器
LC-20A型高效液相色谱仪(日本Shimadzu公司);H2050R型医用离心机(湖南湘仪实验仪器开发有限公司);101-1型电热鼓风恒温干燥箱(绍兴道墟浦鸿烘箱电炉厂);AL-104型电子分析天平(梅特勒-托利多仪器<上海>有限公司);BJ-800A型多功能粉碎机(湖州德清拜杰电器有限公司);YPGSD250型综合药品稳定性试验箱(上海苏盈试验仪器有限公司)。
1.2 试药
淫羊藿、夏枯草药材(北海天洄技术有限公司),经广西中医药大学药学院王柳萍教授鉴定为正品;淫羊藿苷对照品(批号为110737-201516,含量为95.0%)、迷迭香酸对照品(批号为 111871-201505,含量为95.0%),均购于中国食品药品检定研究院;乙腈、甲醇均为色谱纯,稀乙醇、三氟乙酸均为分析纯,硬脂酸镁、可溶性淀粉、糊精、磷酸钙等均为药用辅料级,水为纯化水。
2 方法与结果
2.1 提取工艺
2.1.1 吸水率试验
称取处方量药材(70.5 g,m1),加 12 倍量水,分别浸泡 30,60,90,120,150,180 min 后滤过蒸干,并称定药材质量(m2)。按公式W=(m2-m1)/m1×100%计算药材的吸水率。结果药材的吸水率为处方量的3倍。
2.1.2 含量测定
溶液制备:称取处方量药材(70.5 g),加3倍量水,浸泡30 min,回流提取,合并滤液,1 000 r/min离心10 min,减压抽滤,浓缩定容至250 mL,60℃烘干粉碎,得供试品,以水溶解,经0.22 μm微孔滤膜滤过,取续滤液,即得供试品溶液,置4℃保存,备用。取淫羊藿苷、迷迭香酸对照品各适量,分别加甲醇溶解,即得单一对照品溶液。
淫羊藿苷含量测定:色谱条件为色谱柱JADE-PAK ODS柱(250 mm×4.6mm,5μm),流动相乙腈-水(30∶70,V/V),流速 1 mL/min,检测波长 270 nm,柱温 30℃,进样量10 μL。取淫羊藿苷对照品适量,精密称定,加甲醇制成不同质量浓度的系列对照品溶液,按拟订色谱条件进样测定,记录峰面积,以峰面积积分值(Y)为纵坐标、质量浓度(X)为横坐标进行线性回归,得回归方程Y1=0.000 013 22X1-0.064 32(r=0.999 3)。结果表明,淫羊藿苷质量浓度在0.1~5.0 μg/mL范围内与峰面积积分值线性关系良好。取对照品溶液、供试品溶液各适量,按拟订色谱条件进样测定,记录色谱图,详见图1。结果理论板数按淫羊藿苷峰计大于6 000,分离度不小于1.5,基线分离良好。按标准进行精密度试验、稳定性试验、加样回收试验,结果日内、日间精密度试验的RSD分别为1.07%和1.36%(n=6),稳定性试验的RSD为0.44%(n=5),供试品溶液室温放置8 h内基本稳定;加样回收率为98.70%~100.50%,RSD为 1.48%(n=6)。
迷迭香酸含量测定:色谱条件为色谱柱JADE-PAK ODS-AQ 柱(250 mm × 4.6 mm,5 μm),流动相甲醇 -0.1%三氟乙酸溶液(42 ∶58,V/V),流速 1 mL/min,检测波长330 nm,柱温35℃,进样量10 μL。取迷迭香酸对照品适量,加稀乙醇制成不同质量浓度的系列对照品溶液,按拟订色谱条件进样测定,记录峰面积,以峰面积积分值(Y)为纵坐标、质量浓度(X)为横坐标进行线性回归,得回归方程Y2=0.000 015 00X2+0.114 9(r=0.999 4)。结果表明,迷迭香酸质量浓度在0.5~10.0 μg/mL范围内与峰面积积分值线性关系良好。取对照品溶液、供试品溶液各适量,按拟订色谱条件进样测定,记录色谱图,详见图1。结果理论板数按迷迭香酸峰计大于6 000,分离度不小于1.5,基线分离良好。按标准进行精密度试验、稳定性试验、加样回收试验,结果日内、日间精密度试验的RSD分别为1.34%和1.57%(n=6);稳定性试验的RSD为 0.84%(n=6),供试品溶液室温放置8 h内基本稳定;加样回收率为99.30%~101.40%,RSD为1.15%(n=6)。
样品含量测定:取供试品适量,依法制备供试品溶液,按拟订色谱条件进样测定,平行3次,记录峰面积并计算含量。
2.1.3 干膏率测定
取供试品溶液100 mL,置蒸发皿中,80℃水浴锅蒸干水分,100~105℃烘箱中干燥3 h,移至干燥器中,放冷30 min,取干膏,精密称定,按公式W1=m干膏/m生药×100%计算供试品的干膏率(%),式中W1为干膏率,m为质量。
2.1.4 单因素分析
参照文献[3-5],对药材提取影响较大的因素为提取时间、提取次数和提取水量,故分别对其做单因素分析。选择3个因素最佳的3个水平,提取时间分别为 1.0 h,1.5 h,2.0 h,提取水量分别为 10 倍,12 倍,14倍,提取次数分别为1次,2次,3次。
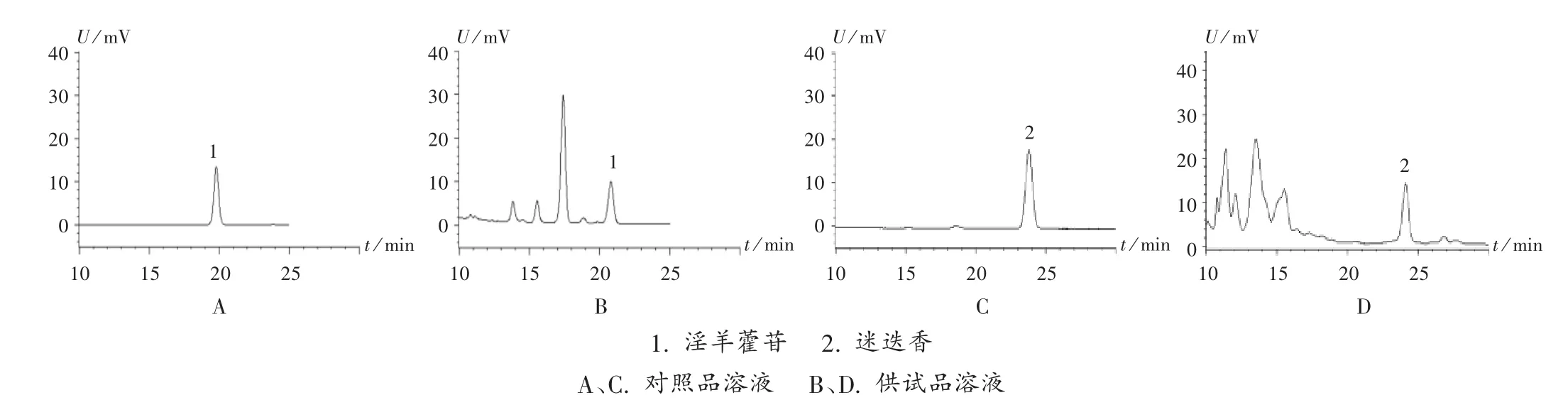
图1 高效液相色谱图
2.1.5 正交试验
以提取时间(因素 A)、提取水量(因素 B)、提取次数(因素 C)为 3因素,采用L9(34)正交试验法优选提取工艺。以淫羊藿苷含量(F1)、迷迭香酸含量(F2)及干膏率(F3)的综合评分作为指标[6-7],三者的权重系数分 别 为 0.3,0.3,0.4。综 合 评分 =(F1×0.3+F2×0.3+F3×0.4)×100%。因素与水平见表 1,正交试验设计及结果见表2,方差分析结果见表3。可见,3个因素对有效成分的提取率均无显著影响。直观分析结果表明,影响水提效果强度的因素依次为提取次数>提取时间>提取水量。得提取工艺最优条件为A3B1C3。即10倍量水(首次为13倍)提取3次,每次2 h。

表1 因素与水平

表2 正交试验设计及结果

表3 方差分析结果
2.2 成型工艺
2.2.1 流动性考察
采用固定漏斗法测定[8],平行3次。结果供试品的休止角平均值为45.5°(>40°),提示流动性不佳,不适合直接装填于空胶囊中。
2.2.2 填充剂种类
供试品黏性大,制粒困难,易吸湿,故需添加适宜的填充剂[9]。本试验中选用的填充剂分别为糊精、可溶性淀粉、硬脂酸镁和磷酸钙,供试品与各填充剂比例均为1∶3(m/m),50%乙醇制软材后过14目筛制粒,60℃干燥。以软材质量、颗粒状态为指标进行考察。结果以磷酸钙作为填充剂时制得的软材质量好,颗粒成型性佳,故以其为填充剂制粒。
2.2.3 填充剂比例
在填充剂种类相同的前提下,填充剂比例的不同可造成制得颗粒成型性出现差异。将供试品与磷酸钙分别按 1 ∶2,1 ∶3,1 ∶4,1 ∶5(m/m)的比例混合[10],50%乙醇制软材后过14目筛制粒,60℃干燥。以软材质量、颗粒状态为指标进行考察。结果当提取物与磷酸钙的比例为1∶4时(m/m),所制得的软材质量好,颗粒成型性佳,故选择供试品与磷酸钙的混合比例为1∶4(m/m)。
2.2.4 润湿剂体积分数
在不使用黏合剂的情况下,润湿剂直接影响颗粒的质量[11]。供试品与磷酸钙按1∶4(m/m)混合后,加入相同体积而体积分数不同的乙醇作为润湿剂。通过制粒情况、干燥后颗粒状态和相对湿度为50%时的吸湿率等指标对乙醇体积分数进行考察。结果见表4。可见,乙醇体积分数对吸湿性影响不大,但体积分数越高,含水量越少,颗粒越散,成型性越差。乙醇体积分数为50%时制粒情况最好,故本试验中选用50%乙醇作为润湿剂。

表4 不同乙醇体积分数的考察结果
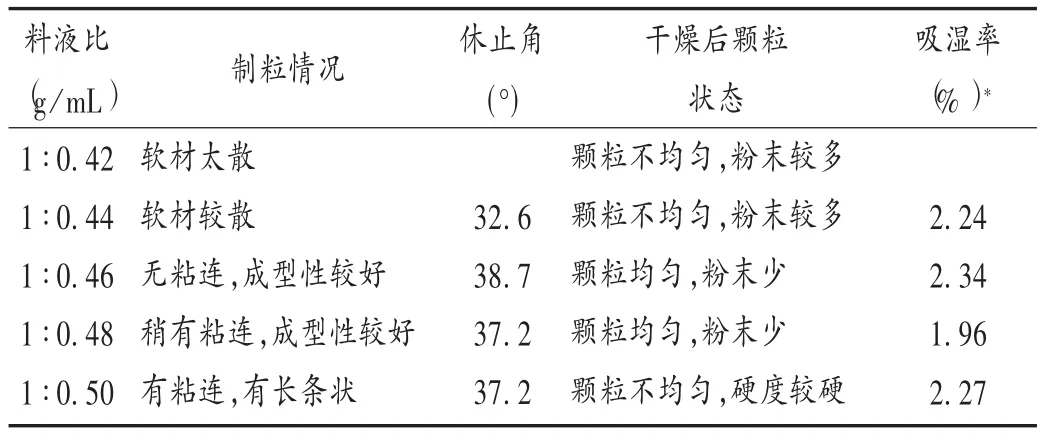
表5 乙醇用量的考察结果
2.2.5 润湿剂用量
根据湿法制粒“握之成团、触之即散”的经验原则操作。供试品与磷酸钙以1∶4(m/m)混合后,分别以表5中不同比例的50%乙醇作为润湿剂,通过制粒情况、休止角、干燥后颗粒状态和相对湿度为50%时的吸湿率等指标对润湿剂乙醇的用量进行考察,结果见表5。可见,当供试品与乙醇润湿剂的比例为1∶0.48(m/V,g/mL)时制得的颗粒均匀,休止角小于40°,流动性较好,相对湿度为50%时吸湿率最低,故本试验中选用原料与乙醇的比例为1∶0.48(m/V)。
2.2.6 颗粒干燥温度
干燥温度也是影响颗粒成型质量的关键因素。取3份用上述方法制得的等量颗粒(30 g),分别置40,60,80℃恒温干燥箱干燥1 h,以颗粒状态、颗粒含水量为指标确定最适干燥温度,水分含量要求符合2015年版《中国药典(四部)》通则 0103“胶囊剂”项下规定[12]。结果干燥温度为60℃时,颗粒无黏连,含水量为5.64%。
2.2.7 颗粒临界相对湿度(CRH)[13]
分别取若干份同等质量的供试品和颗粒,干燥至恒重后转入恒重称量瓶内,平铺于底部,分别放入恒温25℃,相对湿度分别为40%,50%,60%,70%,80%,90%的药物试验稳定箱中,12 h后取出,精密称定,计算吸湿百分率,以相对湿度为横坐标、颗粒吸湿百分率为纵坐标,作不同湿度条件下颗粒吸湿率的曲线图,用切线法求得CRH。结果见图2。在相同条件下,颗粒的吸湿率总是低于粉末的吸湿率,供试品与填充剂混合制成颗粒后吸湿性降低。由颗粒两端点的切线方程求得颗粒CRH为63.83%。因此在实际生产过程中,车间环境相对湿度应控制在该值以下。
2.2.8 颗粒堆密度测定
采用量筒法[14]。将制得的干燥颗粒缓慢加入干燥至恒重的10 mL量筒中,颗粒加至约9.6 mL,记录体积并称定总质量,精密称定,计算颗粒堆密度,平行操作6次。结果颗粒的堆密度为0.440 g/mL。

图2 浸膏粉末与颗粒的吸湿性对比
2.2.9 空胶囊的规格选择[15]
民间验方的干膏用量应为每天1.2 g,结合颗粒的堆密度和填充剂的比例,按公式胶囊壳的可装量=颗粒的堆密度×胶囊壳的容积计算,本试验确定胶囊每粒装0.33g,每天3次,每次6粒,故本试验中选用0号胶囊壳。
3 讨论
中药材多需经过炮制,且药材本身密度大,炮制后缝隙多,易吸水,为提高加液量的准确性,需确定药材本身的吸水率,故进行吸水性试验[16]。由本试验结果可知,该处方自身的吸水率为处方量的3倍,故首次提取需加13倍量水。
藿夏提取物多为糖类和黄酮类,黏性大,流动性不佳,制粒困难,故需加入适当的辅料使其容易制粒。通过对休止角、吸湿性和颗粒成型性的考察发现,磷酸钙可提高供试品吸湿性,因此选择磷酸钙作为辅料。与淀粉等辅料不同的是,磷酸钙作为脆性物料,其吸湿后可以形成结晶水,不会在很大程度上影响主药的形态,不仅利于主药的长期保存,同时也能使主药具有良好的成型性。
CRH可用于设定生产和贮存时的湿度范围,从而限制环境中水分对固体制剂的影响。经测定,颗粒的CRH为63.83%,因此,胶囊成型的环境相对湿度应控制在该值以下,防止颗粒吸湿而潮解导致药物降解变质,从而影响药物的疗效并减少不良反应。
综上所述,该工艺合理可行,所制得颗粒成型较好。

