重组SSB蛋白表达、鉴定及评价*
杜 琴,卢小岚,王 强,3,汪光蓉,3,罗文依,王舒琪,姚丽华,张国元,刘剑平,王东生△
(1.川北医学院附属医院检验科,四川南充 637000;2.川北医学院医学检验系,四川南充 637000;3.川北医学院医学转化医学研究中心,四川南充 637000;4.川北医学院附属医院医学风湿免疫科,四川南充 637000)
干燥综合征(SS)是临床常见的一种自身免疫性疾病,其血清中可检出多种自身抗体,以抗SSA抗体和抗SSB抗体最为常见,而抗SSB抗体较抗SSA抗体更为特异,是SS的血清特异性抗体,在原发性SS中阳性率可高达65%~85%。除此之外,抗SSB抗体亦可出现在其他自身免疫性疾病中,与血管炎[1]、高球蛋白血症[2]、肾脏受累和肺病变[1]、腮腺肿大[3]、冷球蛋白血症[4]等相关。目前抗SSB抗体的检测主要采用免疫印迹法(IB)和酶联免疫吸附试验(ELISA)进行检测[5],但与国外免疫微球技术的检测结果相距甚远[6]。随着我国自动化程度的不断提高,自身抗体的全自动定量检测是未来的必然趋势。因此本文通过基因克隆和重组DNA技术将SSB基因克隆至PET41a载体,构建原核表达质粒,表达并纯化出SSB蛋白,为进一步建立抗SSB抗体的全自动定量检测磁微粒化学发光试剂提供实验基础,现将研究结果报道如下。
1 材料与方法
1.1一般资料 收集川北医学院附属医院2016年1月至2017年12月经欧蒙免疫印迹法检出的抗SSB抗体阳性患者的血清115例。
1.2试剂 PET41a质粒购自德国Novagen公司,异丙基-β-D- 硫代半乳糖苷 (Isopropyl β-D-1-thiogalactopyranoside,IPTG)购自美国Sigma 公司;限制性内切酶BamHⅠ和XhoⅠ及T4 DNA连接酶和高保真聚合酶均购自日本TaKaRa公司;大肠埃希菌DH5α、DNA ladder、质粒提取试剂盒购自北京天根生化科技有限公司;胰蛋白胨和酵母粉购自美国Sigma公司;卡那霉素和氯霉素购自美国Gibco公司;Ni2+-树脂填料购自美国Millipore有限公司;WB所用重组SSB蛋白购自德国Diarect公司;其余试剂均为国产或进口分析纯试剂。
1.3方法
1.3.1引物设计、合成与PCR扩增 根据Genbank中SSB基因编码序列(NM_003142),设计PCR引物,并在引物的5′端分别引入BamHⅠ和XhoⅠ的酶切位点,由上海生工生物有限公司合成。引物序列见表1(下划线部分为酶切位点)。以Hela细胞提取总RNA后逆转录制备的cDNA为模板,用合成的引物进行扩增,产物经1%琼脂糖凝胶电泳鉴定,并切胶回收,获得目的基因片段SSB-flag。
1.3.2重组质粒的构建 将SSB-flag和PET41a质粒用BamHⅠ和XhoⅠ进行双酶切,琼脂糖凝胶电泳后切胶分别回收,再将两者以T4 DNA连接酶4 ℃连接过夜。连接产物转化感受态大肠埃希菌DH5α,在LB平板(卡那霉素50 μg/mL,氯霉素34 μg/mL)上进行初步筛选,对平板上长可生长的单个菌落进行菌落PCR和测序鉴定,鉴定正确的阳性克隆提取质粒,命名为GST-SSB-6*His-PET41a。
1.3.3SSB重组蛋白的表达形式 将GST-SSB-6*His-PET41a重组质粒转化入感受态大肠埃希菌OverExpress C41(DE3)中,涂布于LB平板(含抗生素,浓度同上)上,37 ℃培养过夜,待长出单个菌落后进行菌落PCR鉴定,阳性克隆接种于5 mL的LB液体培养基中(抗生素浓度同上),37 ℃培养12~14 h,加入甘油保存菌种。次日将菌种以1∶100接入5 mL的液体培养基中(抗生素浓度同上),37 ℃培养至OD为0.6时,加入0.1 mmol/L IPTG,16 ℃诱导表达6 h后,8 000 r/min、4 ℃离心1 min,收集菌体。加入1 mL破碎液进行超声波裂解。裂解条件:温度-冰浴、功率20%、超声2 s、间隔6 s、时间5 min。12 000 r/min、4 ℃离心1 min,收集上清液和沉淀。SDS-PAGE鉴定蛋白表达形式。
1.3.4GST-SSB-6*His重组蛋白的纯化
1.3.4.1菌种扩大培养及诱导表达 菌种活化后,按1∶100的接入500 mL LB液体培养基(卡那浓度50 μg/mL,氯霉素浓度34 μg/mL),37 ℃培养至OD=0.4-0.6,加入浓度为0.1 mmol/L的IPTG,16 ℃诱导表达12 h,12 000 r/min、4 ℃离心15 min,收集菌体。加入200 mL 20 mmol/L Tris,500 mmol/L NaCl,pH8.0,10%甘油溶液重悬菌体,超声波裂解菌体,4 ℃ 13 000 r/min离心15 min收集裂解上清。
1.3.4.2上清纯化用高亲和性Ni树脂,先以20 mmol/L Tris,500 mmol/L NaCl,pH8.0,10%甘油溶液平衡(平衡溶液),再将裂解上清上样至Ni树脂。上样后,用平衡溶液洗涤至OD280到0.100以下,分别用含不同浓度咪唑(20、60 mmol/L)的平衡溶液洗脱目的蛋白。
1.3.5GST-SSB-6*His重组蛋白免疫原性验证 用纯化的GST-SSB-6*His蛋白免疫BALB/c雌性小鼠,每只每次60 μg,腹腔注射。第1次免疫使用弗氏完全佐剂,第2次和第3次免疫使用弗氏不完全佐剂。第3次免疫后第7天采集小鼠血清,WB检测Diarect公司的重组SSB蛋白,分别上样5、10、20 ng。小鼠血清为一抗,羊抗鼠-HRP为二抗,参照文献方法[7]。
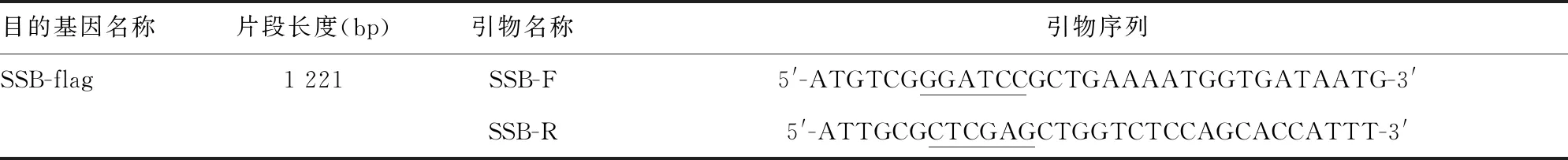
表1 SSB重组蛋白基因扩增引物序列(下划线为酶切位点)
1.3.6GST-SSB-6*His重组蛋白用于ELISA检测抗SSB抗体 使用GST-SSB-6*His蛋白包被酶标板,孵育不同效价的抗SSB蛋白自身抗体人血清样品。以diarect公司的重组SSB蛋白作为对照,包被酶标板,检测相同的人血清样品,将两种蛋白检测的OD值绘制相关性曲线。
1.3.7重组蛋白特异性验证 收集经免疫印迹法(LIA)检测抗U1-nRNP、SmD1、SS-A、Scl-70、PM-Scl、Jo-1、CENP-B、PCNA、dsDNA、NUC、Rib-P和AMA M2等不同自身抗体阳性的血清标本各6份,采用1.2.6方法建立的ELISA反应体系检测上述血清标本,以标本OD450nm/(0.10+阴性对照OD450nm)<1.00,即S/CO<1.00作为阴性判读标准。
2 结 果
2.1PCR扩增结果 扩增产物经1%琼脂糖凝胶电泳分析,可见1 200 bp左右的目的条带,与预期大小一致,见图1。
M:DNA marker(bp);1:SSB目的基因
图1SSB目的基因PCR扩增产物电泳图
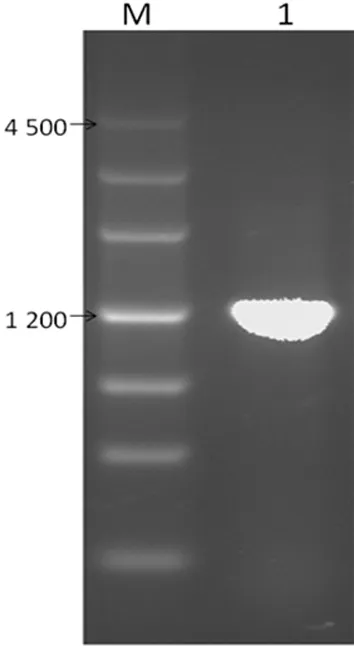
2.2重组质粒的菌落PCR及测序鉴定结果 SSB目的基因与PET41a质粒均经双酶切、胶回收后,用T4 DNA连接酶连接过夜,连接产物转化感受态大肠埃希菌DH5α,对LB平板(含抗生素)上生长的单个菌落进行菌落PCR,均扩增出1 200 bp左右的目的条带,测序结果显示与Genbank中SSB基因编码序列(NM_003142)一致,表明GST-SSB-6*His-PET41a重组质粒构建正确。菌落PCR结果见图2。
2.3诱导表达和纯化
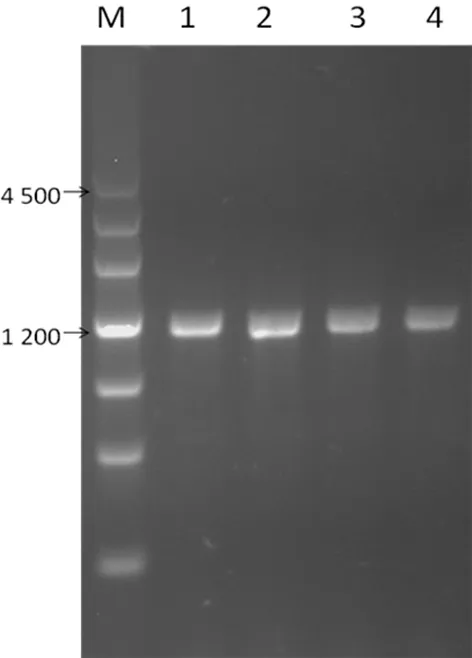
2.3.1重组蛋白表达形式鉴定 将正确构建的重组质粒GST-SSB-6*His-PET41a转化入OverExpress C41(DE3)中,16℃ IPTG诱导表达6 h,收集菌体经超声破碎后分别收集上清液和沉淀,SDS-PAGE鉴定,结果示GST-SSB-6*His重组蛋白是上清液可溶性表达,相对分子质量为72×103,见图3。
M:DNA marker(bp);1~4:挑取的单克隆菌落
图2GST-SSB-6*His-PET41a的菌落
PCR检测结果电泳图
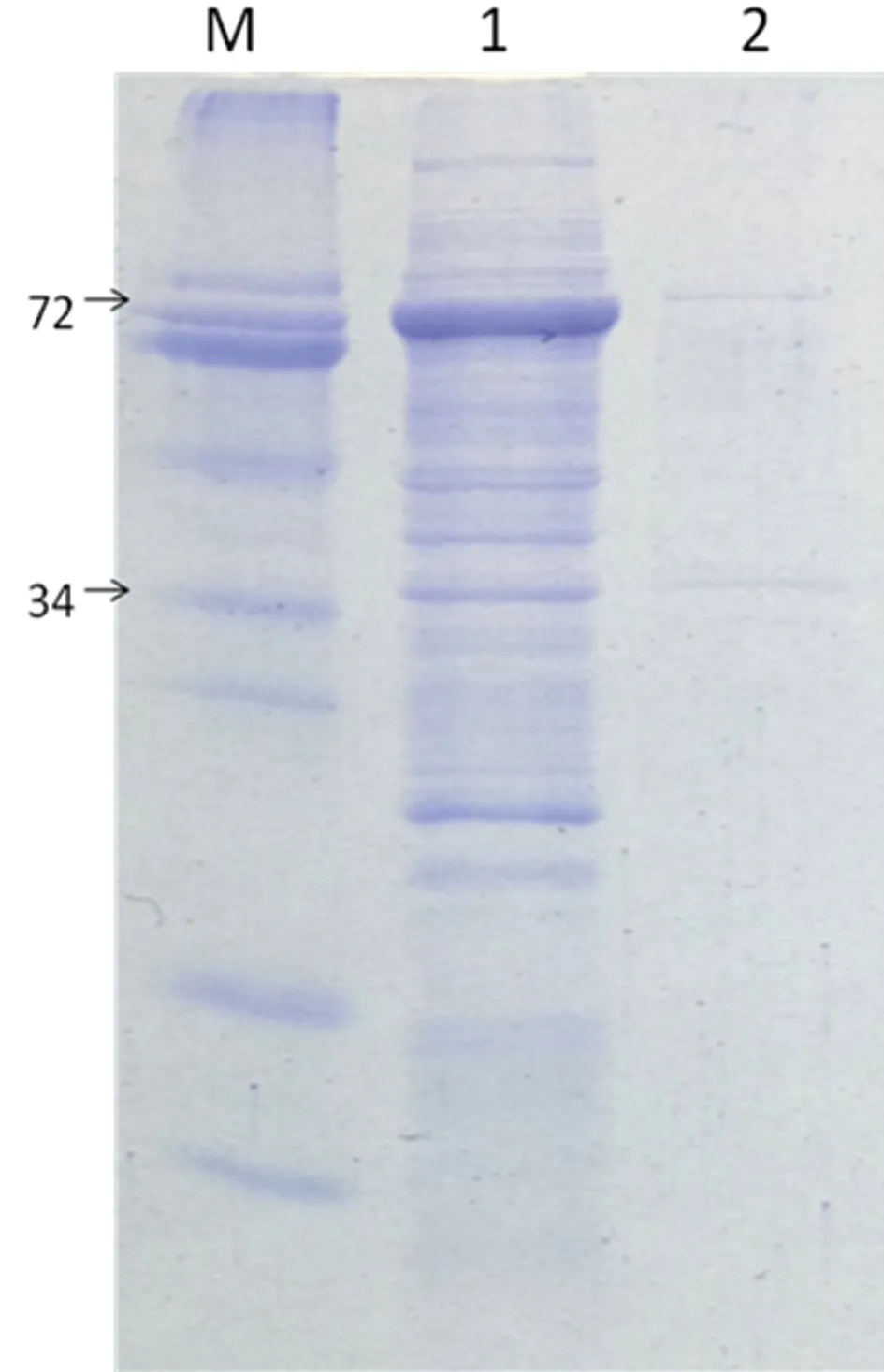
M:预染蛋白marker(KDa);1:IPTG 诱导后裂解上清液;2:IPTG 诱导后裂解沉淀
图3重组蛋白可溶性鉴定的SDS-PAGE电泳图
2.3.2重组蛋白大量表达后纯化 将含有重组质粒GST-SSB-6*His的OverExpress C41(DE3)菌种扩大培养,IPTG诱导表达后收集菌体,超声破碎,取上清过Ni2+树脂柱。用平衡溶液洗涤至OD280到0.100以下,分别用含不同浓度咪唑的平衡溶液(20、60 mmol/L)洗脱目的蛋白。目的蛋白在两个浓度咪唑下均有洗脱蛋白,电泳结果示:蛋白主带清楚,总体纯度大于90%。60 mmol/L组分产量更高,作为优选组分(图4)。
2.3.3重组蛋白免疫原性鉴定 用纯化的GST-SSB-6*His蛋白免疫BALB/c小鼠,采集小鼠血清,WB检测Diarect公司的重组SSB蛋白,分别上样5、10、20 ng。检测结果显示:GST-SSB-6*His重组蛋白免疫小鼠制备的抗血清能够与Diarect公司的重组SSB蛋白反应,表明融合蛋白具有足够的免疫原性(图5)。
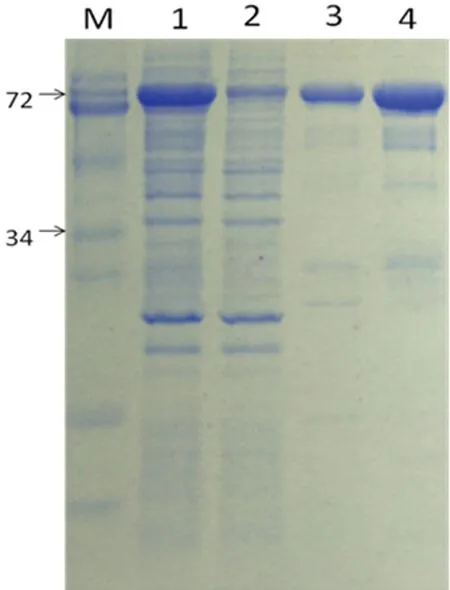
M:预染蛋白marker(KDa);1:IPTG 诱导后裂解上清;2:经Ni树脂柱的流穿液;3:20 mmol/L咪唑洗脱组分;4:60 mmol/L咪唑洗脱组分
图4扩大培养后重组蛋白洗脱条件的SDS-PAGE电泳图
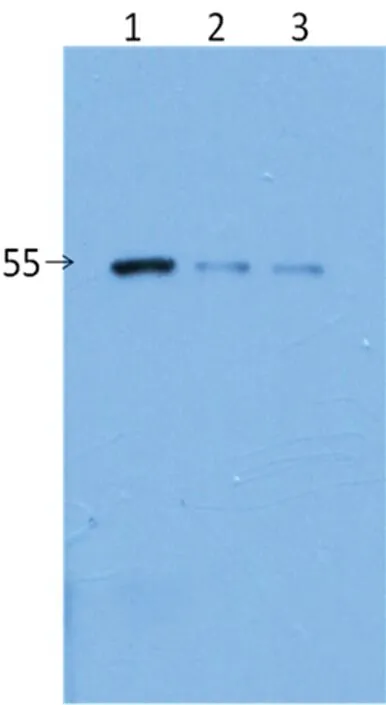
1:20 ng;2:10 ng;3:5 ng
图5重组蛋白免疫原性的WB鉴定结果
2.3.4重组蛋白用于ELISA检测抗SSB抗体 用GST-SSB-6*His蛋白和diarect公司的重组SSB蛋白,分别包被酶标板,检测相同的人血清样品(115例)。将两种蛋白检测的OD值做相关性曲线,表明GST-SSB-6*His蛋白检测人血清样品的临床相关性与德国Diarect公司的重组SSB蛋白一致,R2=0.932(图6)。
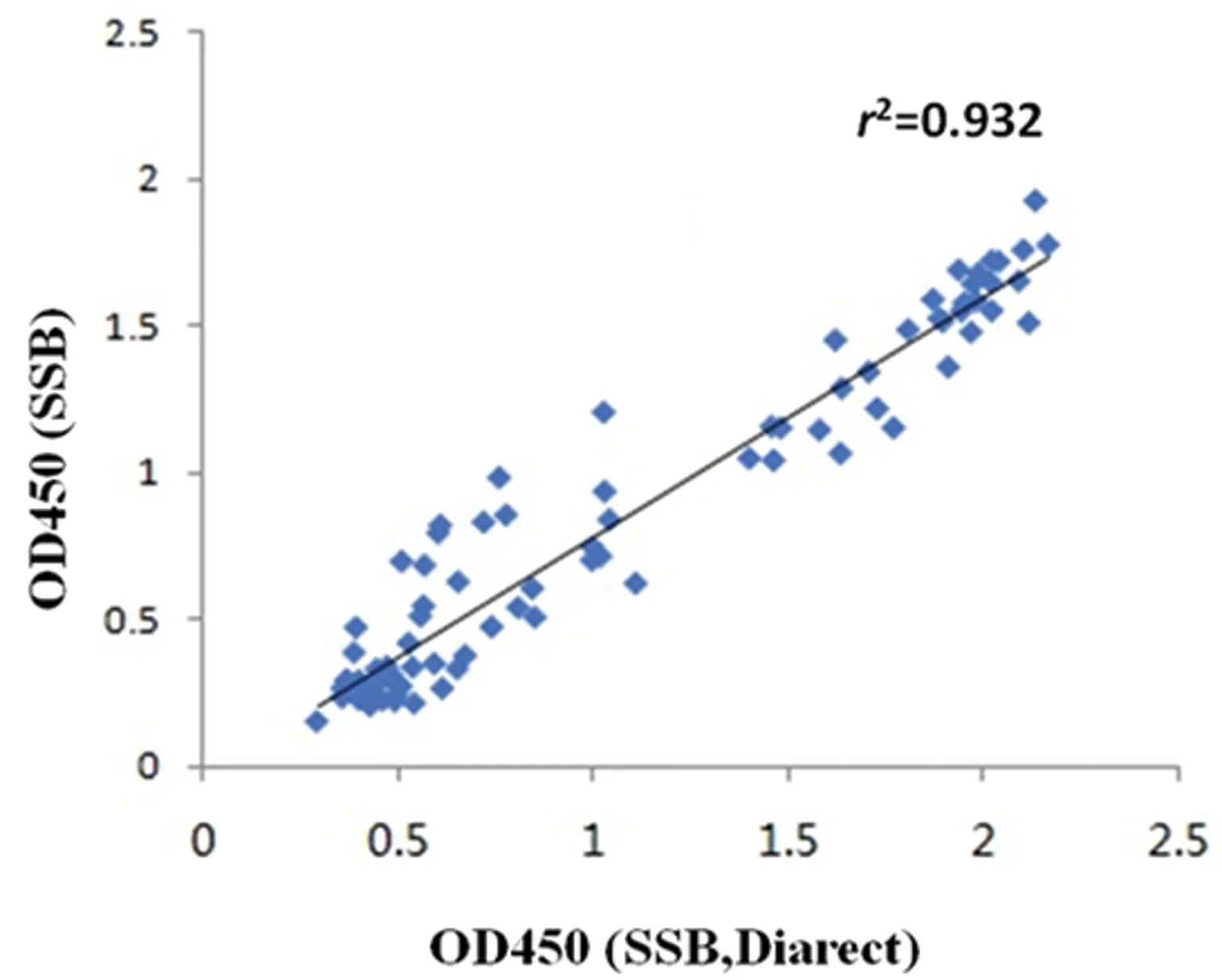
图6 GST-SSB-6*His蛋白和diarect公司的重组SSB蛋白检测人抗SSB抗体的相关性分析
2.3.5特异性鉴定 用GST-SSB-6*His蛋白包被建立的ELISA反应体系检测抗U1-nRNP、SmD1、SS-A、Scl-70、PM-Scl、Jo-1、CENP-B、PCNA、dsDNA、NUC、和AMA M2等常见自身抗体阳性血清标本,结果均为阴性。见表2。
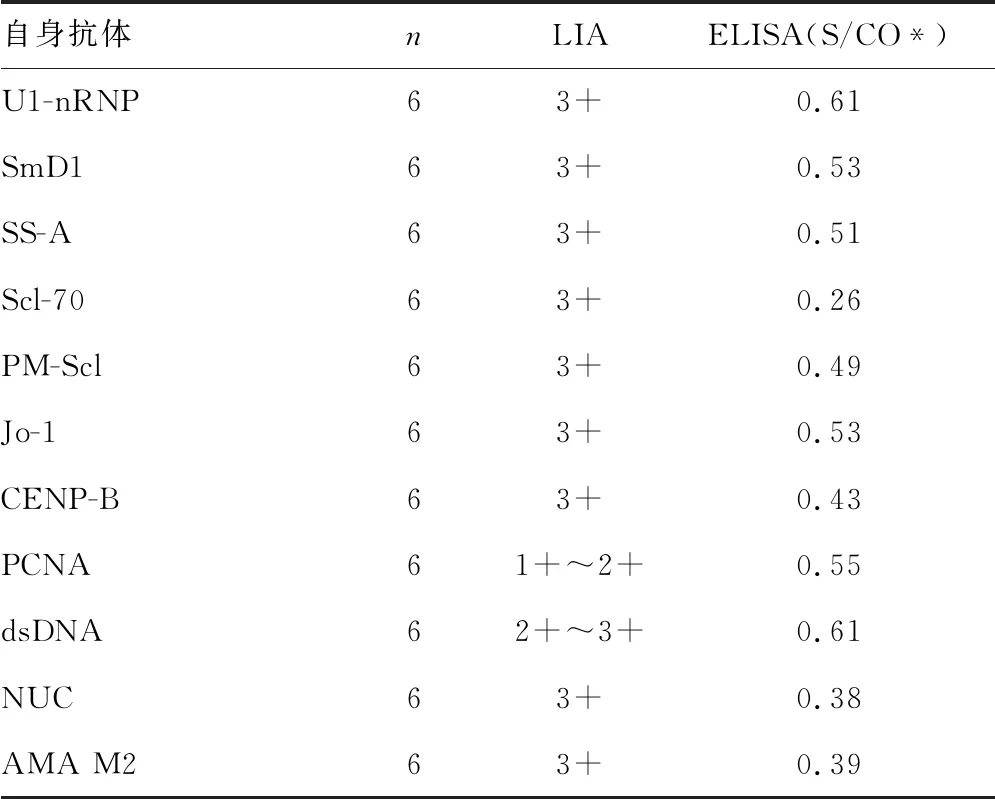
表2 GST-SSB-6*His蛋白与常见自身抗体交叉反应情况
*S/CO为样本检测结果均值
3 讨 论
SSB抗原是原发性干燥综合征(pSS)的特异性自身抗原之一,是ALSPAUGH等[8]在1975年用人淋巴细胞提取物检测pSS患者的血清时发现并命名的,后经证实与1974年发现的胞浆抗原La是同一种物质,故称之为SSB/La抗原。
SSB抗原是RNA聚合酶Ⅲ的辅助蛋白,参与基因的转录终止[9],帮助pre-tRNA的正确折叠和加工成熟[10]。SSB抗原主要定位于细胞核,在紫外线照射等异常情况下,SSB抗原会发生突变,且细胞内定位亦发生改变,进而刺激机体产生抗SSB抗体,引起自身免疫性疾病的发生[11]。
目前,抗SSB抗体的检测主要采用IB和ELISA进行检测[5]。IB法虽操作简单,无需特殊仪器,但其检测结果完全定性,且易受主观因素影响,难于质量控制[12]。而ELISA操作繁琐,重复性差,干扰因素较多。故建立一种全自动、高灵敏的定量方法才能更好满足临床需要。本研究构建了GST-SSB-6*His-PET41a原核表达载体,诱导纯化出有活性的GST-SSB-6*His蛋白。GST-SSB-6*His-PET41a重组质粒带有6×His和GST标签:6×His用于目的蛋白的亲和纯化,且能增加目的蛋白在体外的稳定性[13];来源于日本血吸虫的谷胱甘肽巯基转移酶(GST)标签,是目前应用最为广泛的融合标签之一[14],可提高目的蛋白的表达量和可溶性。
本实验重组质粒中插入目的蛋白序列长度为1 221 bp,测序结果与Genbank中SSB基因编码序列完全一致,其翻译的目的蛋白理论相对分子质量应为44.77×103;C端6×His 标签相对分子质量约为0.66×103;N端GST标签蛋白的相对分子质量约为26×103,故本研究诱导纯化出的目的蛋白相对分子质量大约为72 ×103,与SDS-PAGE鉴定结果一致,因此本实设计的重组蛋白制备路线正确。
本研究将GST-SSB-6*His重组蛋白免疫小鼠,所得到的小鼠抗血清能与德国Diarect公司的重组SSB蛋白发生反应,并且GST-SSB-6*His重组蛋白亦能与自身免疫性疾病患者血清中的抗SSB抗体结合,说明GST-SSB-6*His重组蛋白具有很好的免疫原性和免疫反应性,同时重组蛋白与其他常见的自身抗体之间不存在交叉反应,具有很好的特异性,其所携带的26×103GST标签未对重组蛋白的蛋白活性、生物学功能等产生影响,因而重组蛋白无需切除GST标签,直接作为抗原,为进一步建立应用于国产仪器的全自动定量检测抗SSB自身抗体的磁微粒化学发光试剂奠定基础。

