实时荧光定量聚合酶链式反应检测百日咳鲍特菌的效能研究
王青,刘莹,袁林,孟庆红,姚开虎
百日咳是由百日咳鲍特菌(bordetella pertussis,BP)引起的急性呼吸道感染性疾病,该病具有较强的传染性。尽管有疫苗接种预防措施,百日咳依然在全世界范围内流行[1]。近年来,多个疫苗接种率较高的国家,包括美国、英国和澳大利亚,相继报道百日咳发病率在保持多年低水平后再次升高[2-3],引发学者关注。同样,我国也存在百日咳反弹迹象。近期局部地区的血清学调查结果提示国内百日咳并不少见[4-5],但监测数据却显示在百日咳发病率下降或上升阶段,没有百日咳流行的周期性波动,提示百日咳上报数据可能未能反映其真实发生状况,可能是因为百日咳实验室检测方法不普及。百日咳实验室检测主要包括细菌培养、分子生物学检测细菌核酸、血清学检测抗体水平等,其中百日咳细菌培养耗时较长,距离契合临床需求具有一定的距离,而血清学要在病程后期才具有明确的诊断意义[6-7]。通过实时荧光定量聚合酶链式反应(Q-PCR)试剂盒进行快速的百日咳检测,不仅能迅速掌握疫情,也为尽早开展临床治疗提供病原学依据,且国内已有商品化的百日咳Q-PCR试剂盒。为了更客观地评价Q-PCR试剂盒在百日咳检测中的应用价值,开展了本次调查研究。
1 对象与方法
1.1 研究对象 2016年11月—2017年4月在首都医科大学附属北京儿童医院采集无热咳嗽患儿〔无热咳嗽为病程中有咳嗽,伴一过性低热(<24 h)或无热〕鼻咽拭子302例,以及临床诊断为百日咳患儿鼻咽拭子50例。纳入标准:无热咳嗽且年龄<1岁者;排除标准:严重呼吸道感染及先天性气道发育异常或畸形引发的咳嗽者,支气管哮喘、支气管异物、肺不张及胸腔积液等其他原因引起的咳嗽者。百日咳临床诊断标准:咳嗽持续时间≥2周且伴有下列至少1个症状:痉挛性咳嗽;鸡鸣样回声;无其他明显原因的咳嗽后呕吐[7]。本研究获得本院伦理委员会审批,患儿家属均知情同意。
1.2 主要试剂 碳琼脂选择培养基(CM0119 CHARCOAL AGAR)及选择性培养基添加物—头孢拉定购自OXOID;脱纤维羊血购自北京兰博利德商贸有限公司;采样用鼻咽拭子为藻酸钙拭子,购自Puritan Medical Products Company(25-801 A 50);Q-PCR 试剂盒(Cat.#DA-BN479)购自中山大学达安基因股份有限公司(中国)。
1.3 研究方法
1.3.1 细菌培养 鼻咽拭子标本采集采用美国疾病预防控制中心(CDC)推荐方法[8]。手持细长拭子,经鼻垂直于面部或人体冠状面插入直至鼻咽后壁,充分接触和擦拭鼻咽后壁表面后取出,建议双侧鼻咽分别采集一份拭子标本(见图1)。采集完毕的拭子即刻作为接种工具,反复“Z”字型划线接种于碳琼脂选择培养基,置于37 ℃孵箱培养。3 d后开始每天检查培养皿,至第7天结束。若见灰白色、圆形、半透明的疑似菌落,应继续分离提纯操作并对最终收集到的菌落进行BP血清玻片凝集试验,百日咳血清凝集试验确认为阳性的菌落为BP。鼻咽拭子在接种后立即放置-70 ℃备检。
1.3.2 DNA提取 鼻咽拭子标本管中加0.9%氯化钠溶液2 ml,充分振荡;取1.5 ml浸出液于EP管中,12 000 r/min离心5 min(离心半径8.6 cm),弃上清液;将沉淀加入50 μl DNA提取液中充分混匀,100 ℃干浴10 min,4 ℃冰浴1 min,12 000 r/min离心5 min(离心半径8.6 cm),吸取上清液备用。
1.3.3 PCR反应体系 (1)BP PCR反应液A 17 μl,BP PCR 反应液 B 3 μl,DNA 模板 5 μl,共 25 μl。(2)PCR扩增条件:50 ℃ 2 min,1个循环,激活UDG酶;95 ℃ 15 min,1 个循环,变性;94 ℃ 15 s,55 ℃ 45 s(收集荧光),40个循环,退火。(3)PCR结果判读:CT值<26 Hu为阳性,26~30 Hu为弱阳性,>30 Hu为阴性。
1.4 统计学方法 采用JMP 11.0软件进行统计学分析。计数资料以相对数或绝对数表示,组间比较采用χ2检验;绘制四格表,计算灵敏度、特异度、阳性预测值、阴性预测值。以P<0.05为差异有统计学意义。
2 结果
2.1 两种检测方法筛查302份无热咳嗽患儿鼻咽拭子302份无热咳嗽患儿鼻咽拭子标本中,细菌培养、Q-PCR检测的阳性率分别为4.6%(14/302)、7.6%(23/302)。以细菌培养为金标准,Q-PCR检测的灵敏度为78.6%(11/14),特异度为95.8%(276/288),阳性预测值为47.8%(11/23),阴性预测值为98.9%(276/279)(见表1)。
2.2 两种检测方法筛查50份临床诊断百日咳病例 在50例临床诊断百日咳病例的鼻咽拭子标本中,Q-PCR检测的阳性率为34.0%(17/50),细菌培养的阳性率为22.0%(11/50),两者阳性率比较,差异无统计学意义(χ2=3.125,P=0.077)。
3 讨论
百日咳是由BP引起的一种传染性强、发病率高、具有潜在致命风险的急性呼吸道传染病。百日咳病情严重程度不一,临床表现可从轻微呼吸道感染症状[9]到危及生命[10-11]。在疫苗广泛接种之前,百日咳曾是儿童致死率最高的感染性疾病之一。其典型临床表现为阵发性痉挛性咳嗽,咳嗽终末伴有鸡鸣样回声和外周血淋巴细胞增多。婴儿尤其是<3个月缺少保护性抗体的婴儿,百日咳表现不典型[12-13],早期误诊、漏诊率高,且婴儿病情常进展迅速,在合并心血管功能障碍时救治难度大,病死率高,严重威胁婴儿生命健康[14]。因此,提高百日咳临床诊断效率,实现百日咳的早发现、早诊断、早治疗意义重大。
百日咳流行具有一定的特点,每2~5年(平均3~4年)会出现一次百日咳流行高峰。欧美发达国家已建立健全的百日咳检测体系,其多年监测数据表明,尽管疫苗免疫推广后百日咳发病率显著降低,但其流行周期并未发生改变,病原菌仍在社区循环传播[15],我国也有类似情况。自1978年实施免疫规划以来,我国百日咳发病率从20世纪60—70年代的(100~200)/10万下降至20世纪90年代的1/10万以下[16],在经过一段时间的稳定后,近几年来多个地区报道其发病率开始显著上升[17-19]。尤其是在2018年7月百白破疫苗效价不足事件发生后,多家医院和疾病预防控制中心开始恢复相关检查,但实验室常规检测为百日咳诊断提供特异的线索非常有限。百日咳感染后常有白细胞计数升高,但通过白细胞计数的变化判断百日咳感染的特异性不高[20]。血清学检测方法也一直是流行病学调查的重要手段。然而,血清学检测常对于病程晚期的百日咳临床诊断更有价值[6-7]。据报道,人百日咳IgG(PT-IgG)诊断百日咳最为敏感[21],但检测时需采集双份血清检测其中PT-IgG,若第二份血清中抗体水平比第一份升高3~4倍则诊断为百日咳的准确率大幅提高[22]。但在实际操作中,采集双份血清较为困难,因此目前多数国家采用不同的血清PT-IgG界值进行单份血清检测。我国有研究者采用30 U/ml或40 U/ml作为单次血清学诊断界值[23-24]。细菌培养仍是诊断百日咳的“金标准”,其特异度高,方法成熟,是目前诊断百日咳的有效方法。但是,BP对生长环境要求较高,需在35~37 ℃、高湿度、低二氧化碳(CO2)的环境下生长,很多临床科室受限于以上条件而无法进行该项检测。此外,由于所需时间较长,容易造成培养过程中杂菌尤其是真菌污染。而临床标本采集方法、标本运送系统、培养基及培养条件以及是否进行过抗感染治疗等多种因素会导致培养阳性率较低[25-26]。自20世纪80年代末,Q-PCR已成为一种成熟的检测百日咳病原菌的方法。Q-PCR可通过TaqMan荧光探针进行检测,较传统PCR又进一步提高了灵敏度与特异度;且因整个反应在封闭的PCR管中进行,无须电泳步骤,可减少假阳性的可能。Q-PCR检测百日咳病原菌在临床实际应用中具有非常重要的意义。
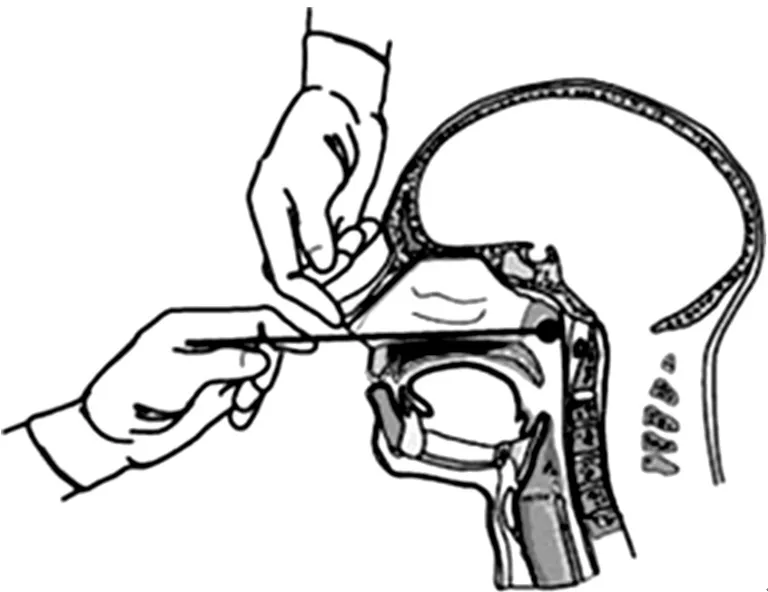
图1 鼻咽拭子采集方法示意图Figure 1 Proper technique for obtaining a nasopharyngeal specimen for isolation of bordetella pertussis
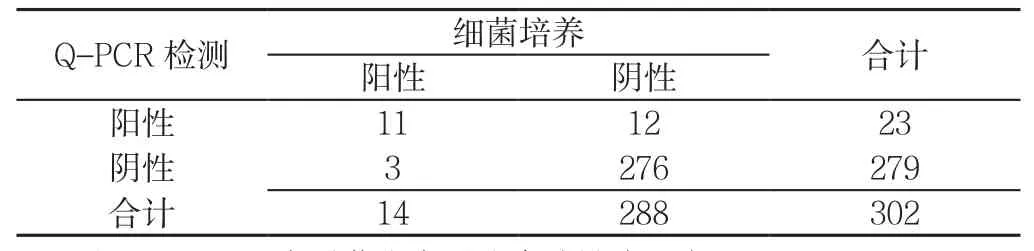
表1 两种检测方法筛查302份无热咳嗽患儿鼻咽拭子(例)Table 1 Nasopharyngeal swabs from 302 children with afebrile cough between two methods
本研究结果显示,以细菌培养为金标准,Q-PCR检测的灵敏度、特异度、阴性预测值均较高,对临床排除百日咳的诊断有一定指导意义,与相关研究结果一致[27]。本研究中Q-PCR检测的阳性率为7.6%,略低于韩玉玲等[28]的研究中用PCR检测方法筛查迁延性咳嗽(持续咳嗽≥2周)的阳性率,可能与筛查入组病例不同有关。Q-PCR筛查阳性的23例患儿中有11例细菌培养亦阳性,因此耗时短的Q-PCR检测对于及时发现百日咳病例有重要意义。
本研究中检测的50例临床诊断百日咳病例的标本中,Q-PCR检测的阳性率为34.0%,数值上稍高于细菌培养的阳性率(22.0%),可能与检测样本例数少、本院就诊患儿的病程偏晚已经错过细菌培养和Q-PCR检测的最佳时机有关。需要注意的是,临床诊断百日咳患儿中98.0%(49/50)在就诊前就已经使用了抗生素,但其细菌培养阳性率达到22.0%,与Q-PCR检测阳性率仍相当,可能由于BP对大环内酯类耐药情况严重[29],培养未受到抗生素使用的影响。
鼻咽拭子的材质对Q-PCR检测有一定影响。有学者认为,如果需要同时进行细菌培养及Q-PCR检测,可使用达克龙或尼龙材质的拭子(棉刷因含有对BP有毒物质,会影响培养结果,但可单独用于Q-PCR分析;藻酸钙拭子对Q-PCR检查可能产生影响,仅用于细菌培养)[30-33]。本研究中使用藻酸钙拭子同时进行细菌培养和Q-PCR检测。如果采用棉刷,Q-PCR检测的阳性率可能会有所增加。由于对Q-PCR方法的依赖,欧美近期研究中细菌培养确诊的数据缺乏,国内近年来细菌培养阳性报道也较少,但细菌培养仍然是诊断的金标准。因此本研究中,以细菌培养验证的Q-PCR检测结果分析更为客观和准确。
本研究以细菌培养为金标准,Q-PCR检测的灵敏度、特异度、阴性预测值均较高,阳性预测值略低。检测临床百日咳病例时,细菌培养和Q-PCR检测阳性率相当。且Q-PCR具有耗时短,有商品化试剂盒,操作平台也日益普及的优势,可靠的Q-PCR检测必将成为国内临床诊断和排除百日咳的重要选择。
作者贡献:王青、姚开虎进行文章的构思与设计,结果的分析与解释,论文修订,文章质量控制及审校;刘莹进行统计学处理;袁林、孟庆红进行研究的实施与可行性分析,数据收集、整理;王青进行论文的撰写;姚开虎对文章整体负责。
本文无利益冲突。

