3.0T动态增强MRI定量参数、表观扩散系数与乳腺癌预后因子及分子分型的相关性
王倩,刘万花,王瑞,叶媛媛
1.东南大学,江苏南京 210009;2.东南大学附属中大医院放射科,江苏南京 210009;
乳腺癌是世界范围内影响女性健康的重要疾病之一,新发和死亡病例高居榜首[1]。乳腺癌于分子水平呈现高度的异质性,不同分子亚型表现出不同的生物学行为,预后差异较大[2]。Luminal A型增殖率低;Luminal B型组织学分级较Luminal A型高,且多数伴有人类表皮生长因子受体-2(human epidermal growth factor receptor 2,HER-2)基因扩增;HER-2过表达型乳腺癌恶性程度高,内脏转移率高,生存率低[3]。三阴性乳腺癌(triple negative breast cancer,TNBC)具有很强的侵袭性及独特的生物学行为,预后差[4]。因此,深入探讨乳腺癌分子分型与影像特征及功能成像之间的关系,对乳腺癌的精准治疗及疗效随访具有重要价值。关于定量动态增强MRI(dynamic contrast enhanced MRI,DCE-MRI)定量参数及表观扩散系数(ADC)值与乳腺癌不同预后因子及分子分型的相关性已有部分报道[5-9]。本研究在同一研究对象获取DCE-MRI和ADC值,分析各功能参数与预后因子和分子分型间的相关性。
1 资料与方法
1.1 研究对象 回顾性分析东南大学附属中大医院2012—2018年符合以下标准的患者,纳入标准:①术前同时行MRI动态增强及扩散加权成像(DWI)扫描;②外科手术病理证实为乳腺癌;③术后经病理检查并取得免疫组化指标。排除标准:①MRI扫描图像不标准;②行穿刺活检,但未手术者;③行放疗、化疗或激素替代治疗后;④妊娠期及哺乳期女性;⑤分子分型研究中免疫组化检测指标不全者。
最终纳入123例乳腺癌患者,共127个病灶,年龄(52.16±10.56)岁。病理类型:浸润性导管癌107例、导管原位癌16例、浸润性小叶癌1例、乳头状癌1例、髓样癌1例及分泌基质癌1例。纳入分子分型研究123个病灶。
1.2 MRI检查 所有患者均于术前行3.0T MRI(Siemens Magnetom Verio)检查,使用双穴乳腺专用8通道表面线圈。扫描前于患者手背静脉或肘静脉放置留置针,并进行平静呼吸训练,扫描位置为俯卧位,双乳对称、自然悬垂于线圈内。DWI扫描于对比增强扫描前进行,采用平面回波序列,扫描参数:TR 7200 ms,TE 88 ms;层厚4.0 mm;层间距6 mm;激励次数2;视野340 mm;矩阵192 mm×192 mm;b值分别取0、800 s/mm2。DCE-MRI扫描序列是三维快速小角度激发扰相梯度回波及脂肪抑制T1WI序列,扫描参数:TR 5.08 ms,TE 1.68 ms,反转角2°、15°, 视野320 mm×320 mm,矩阵192×192,层厚3 mm。扫描过程:首先进行第一期T1原始值图(T1 map)扫描,然后在第4期经高压注射器团注Gd-DTPA 0.1 mmol/kg,随后团注20 ml生理盐水,注射速度均为2 ml/s。注射的同时继续行动态增强扫描,每一期采集时间为10 s,共扫描40期,总采集时间6 min 40 s。
1.3 图像后处理及数据测量 所有数据后处理均于Siemens 3.0T MRI Verio工作站进行。ADC值测量:参考MR动态增强图像找到病变所在位置,取病变的实性部分,注意避开囊变、坏死或出血区域,测量3个感兴趣区(ROI),取平均值。定量增强参数获取:应用4D tissue后处理软件,选择病变强化最明显区域作为ROI,避开囊变、坏死区,结合原始T1值,应用经典Tolfs参考模型,测量慢速模式下的容量转移常数(Ktrans)、速率常数(Kep)、血管外细胞外间隙容积比(Ve),同样选取3个ROI并取平均值。
1.4 免疫组化及分子分型判断标准 美国临床肿瘤学会[10]定义雌激素受体(estrogen receptor,ER)及孕激素受体(progesterone receptor,PR)阳性为侵袭性阳性肿瘤细胞核≥1%,反之为阴性。HER-2表达评分为0、+、++、+++,评分+++为HER-2表达阳性,评分0和+为HER-2表达阴性;HER-2评分为++者进一步行FISH法检测,若基因扩增则为HER-2阳性,反之为阴性。根据2011年St.Gallen国际乳腺癌会议[11]上提出的分子分型方法,将乳腺癌分为以下4种类型,①Luminal A型:ER和(或)PR阳性,HER-2阴性,Ki-67低表达(<14%);②Luminal B型:ER和(或)PR阳性,HER-2阴性,Ki-67高表达(≥14%);ER和(或)PR阳性,HER-2阳性,Ki-67任意表达;③HER-2过表达型:ER、PR阴性,HER-2阳性,Ki-67任意表达;④TNBC:ER、PR和HER-2均为阴性,Ki-67任意表达。
123个病灶分为Luminal A型24个、Luminal B型73个、HER-2过表达型15个和TNBC 11个。
1.5 统计学方法 采用SPSS 18.0软件,正态分布的计量资料以±s表示,各受体在不同表达状态下的Ktrans及Ve值比较采用t检验;非正态分布的计量资料用M(Q1,Q3)表示,采用Mann-Whitney U检验进行比较;用Spearman相关分析评价各定量参数及ADC值与各预后因子的相关性,不同分子分型间乳腺癌病灶的Ktrans及Ve值比较采用单因素方差分析,两两比较用SNK检验,采用Kruskal-Wallis检验比较不同分子分型乳腺癌患者的Kep值及ADC值,两两 比较采用Mann-Whitney U检验。采用ROC曲线下面积(AUC)比较各定量参数对不同分子分型的乳腺癌的预测价值,P<0.05表示差异有统计学意义。
2 结果
2.1 各预后因子在不同表达状态下的定量DCE-MRI参数及ADC值比较 ER、PR阳性患者的Ktrans、Kep值及ADC值均低于ER、PR阴性患者,差异有统计学意义(P<0.05),两组Ve值差异无统计学意义(P>0.05);HER-2阳性患者Ve值和ADC值均高于HER-2阴性患者,差异有统计学意义(P<0.05),两组Ktrans及Kep值差异无统计学意义(P>0.05)。见表1。
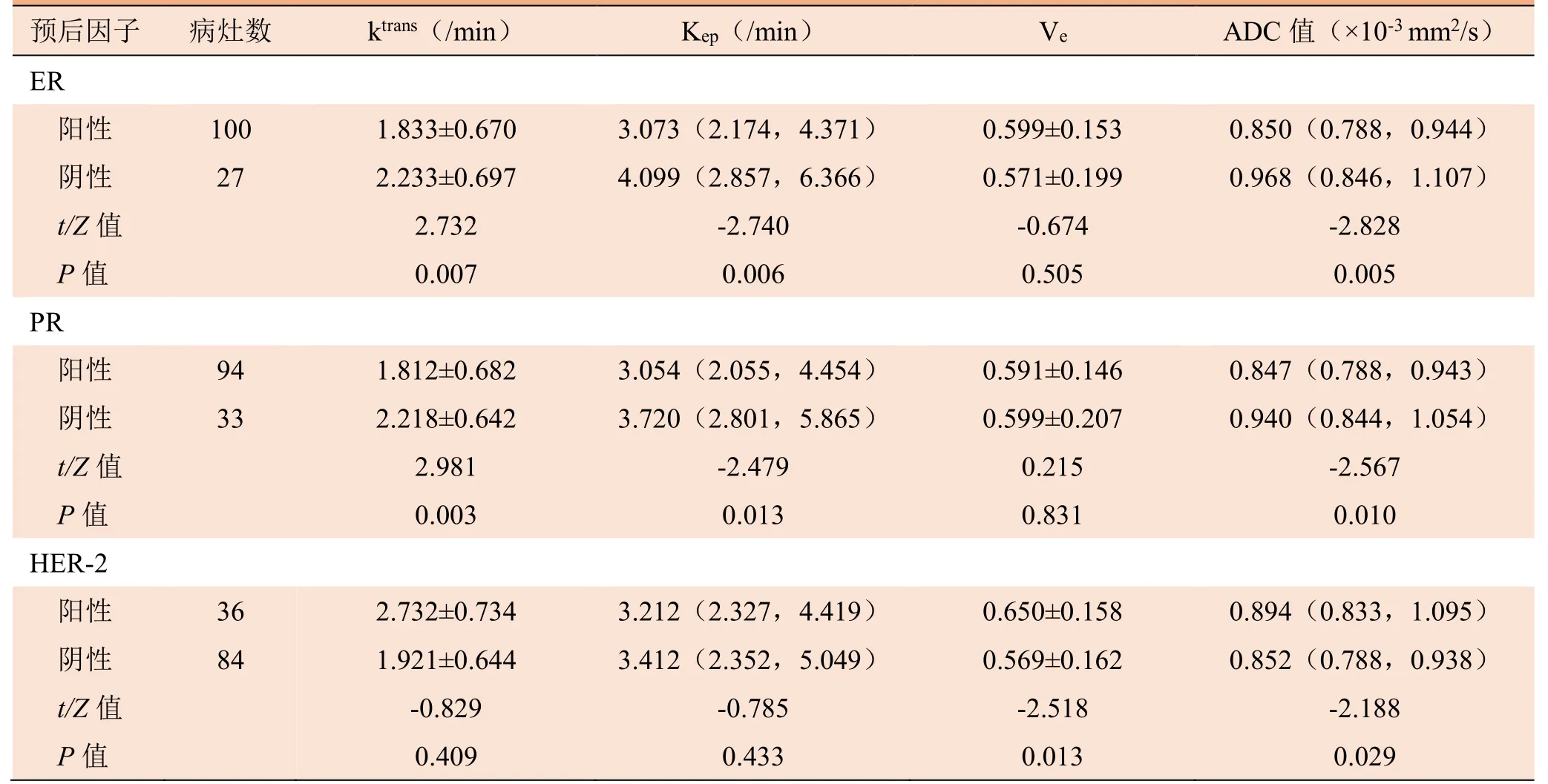
表1 各预后因子在不同表达状态下定量参数及ADC值比较
2.2 定量参数及ADC值与各预后因子阳性表达的相关性 ER及PR与Ktrans、Kep、ADC值均呈负相关,其中ER与ADC值的相关性最大(r=-0.252),PR与Ktrans值的相关性最大(r=-0.257)。HER-2与Ve值及ADC值呈正相关,且相关性相等(r=0.187)。Ki-67表达率与Ktrans呈正相关(r=0.226,P=0.006),与Kep、Ve及ADC值无相关性(P>0.05)。见表2。
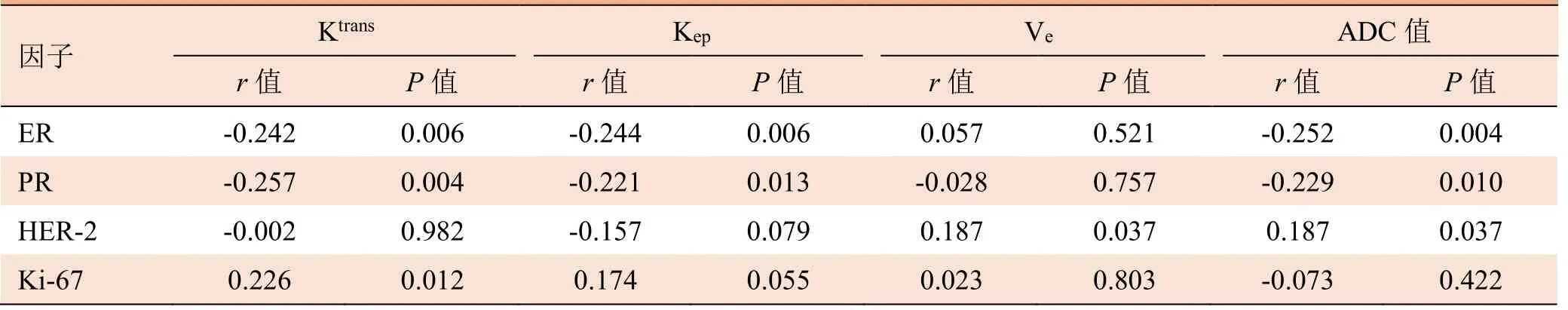
表2 定量参数及ADC值与各预后因子阳性表达的相关性
2.3 不同分子分型患者ADC值及定量参数结果 TNBC型患者Ktrans、Kep及ADC值均高于其他各型,Ve均低于其他各型。不同分子分型间Ktrans、Kep、Ve及ADC值差异有统计学意义(P<0.05)。进一步两两比较显示,Luminal A型及Luminal B型与TNBC型间Ktrans值、Kep值及Ve值差异均有统计学意义(P<0.05),Luminal B型与TNBC型和HER-2过表达型ADC值差异有统计学意义(P<0.05)。见表3。
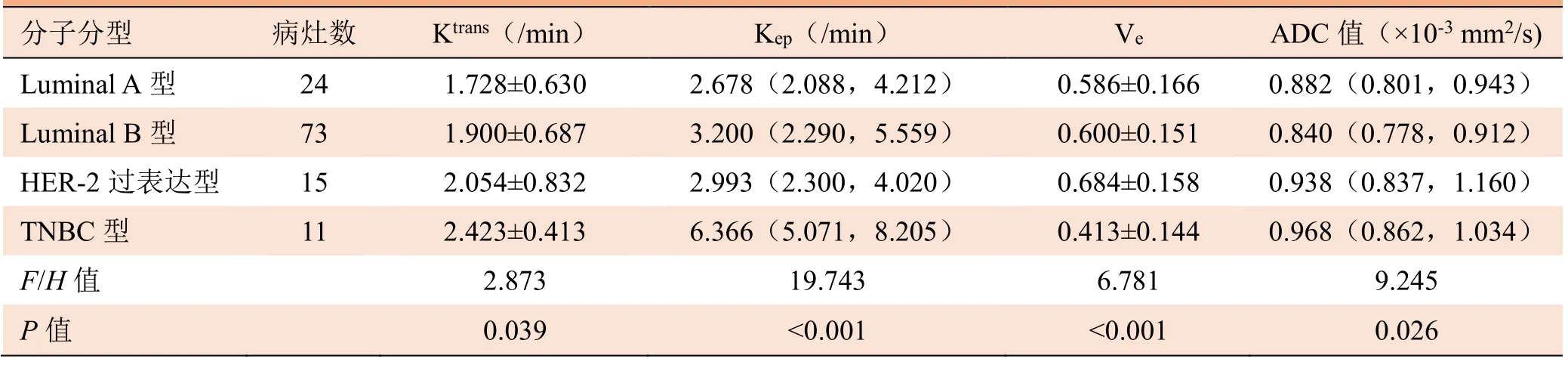
表3 不同分子分型患者定量参数及ADC值比较
2.4 应用定量参数及ADC值诊断不同分子分型的ROC曲线下面积(AUC)分析 各参数对不同分子分型诊断效能,除TNBC中Ktrans值及Kep值AUC>0.7外,其余AUC均<0.7,且Ve值诊断TNBC的AUC最小,为0.180。应用Kep值诊断TNBC的AUC最高,为0.904,截断点为最大约登指数,其敏感度为81.8%,特异度为85.7%。见表4。
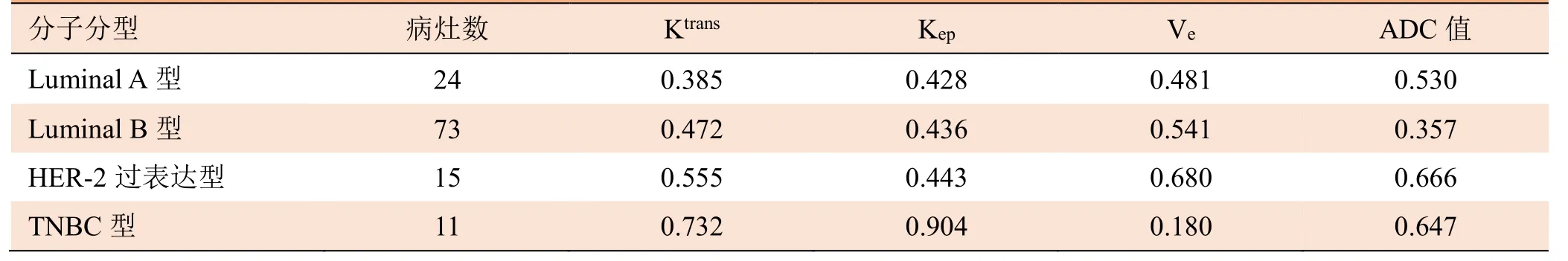
表4 应用定量参数及ADC值诊断不同分子分型乳腺癌的AUC
3 讨论
定量DCE-MRI是基于参数(模型)技术对对比剂进行灌注分析。通过监测ROI内对比剂的时间-信号强度变化特点,结合适当的药物代谢动力学模型,计算出具有生理学意义的定量增强参数,在分子水平反映肿瘤组织血流灌注、血管分布等情况[5]。基于水分子的布朗运动原理,DWI可反映人体组织中微观结构以及细胞内外水分子的扩散能力,ADC值是DWI的一个定量指标,细胞构成、细胞密度、细胞膜通透性及血流灌注均与ADC值相关。既往研究报道了定量参数及ADC值与乳腺癌预后因子及分子分型的相关性,但均基于各自独立的研究对象,不利于比较分析。本研究从同一研究对象同时获取定量动态增强参数及ADC值,以期得到更为可靠的对比分析结果。
本研究结果显示,ER、PR阳性患者的Ktrans、Kep及ADC值均低于ER、PR阴性患者,且ER、PR与Ktrans、Kep及ADC值均呈负相关,而Ve值差异无统计学意义,提示ER、PR阳性肿瘤毛细血管通透性减小,这一结果可借助Ali等[12]研究提示ER能够下调血管内皮生长因子水平,从而抑制血管生成通路,因此ER阳性肿瘤毛细血管较ER阴性少,血流灌注下 降,肿瘤组织中微血管灌注对ADC值的影响较小得 以解释,与Suo等[7]及Martincich等[8]的研究结果一 致。关于定量参数与HER-2表达是否有相关性,既往报道结果不一[13-14]。本研究显示,HER-2阳性患者的Ve值及ADC值高于阴性患者,且HER-2与Ve值及ADC值的相关性相同。关于文献报道结果不一致的原因考虑与研究样本量、HER-2的蛋白质表达与基因扩增不一致等因素有关,Makkat等[15]研究证实,HER-2基因无扩增组与扩增组间组织相对血流量差异有统计学意义,而HER-2表达阴性组和阳性组间差异无统计学意义。本研究基于相对较大样本量、相同患者定量参数间进行对比分析,因此研究结果更具可靠性。
不同分子分型的乳腺癌的治疗效果及生存结果存在显著差异,是临床内分泌治疗的重要依据。因此活体预测乳腺癌分子分型的研究具有重要临床指导价值。本研究显示,TNBC型乳腺癌Ktrans、Kep及ADC值均高于其他各型,Ve均低于其他各型,提示TNBC型乳腺癌的新生毛细血管密度高,微血管灌注更明显。Wang等[16]报道血管内皮生长因子在TNBC乳腺癌中表达更频繁,即肿瘤侵袭性较高。TNBC型ADC值高于其他各型除血管灌注明显外,另一个原因为肿 瘤细胞以推挤的方式生长,病灶坏死率较高,大片坏死导致ADC值升高[17]。本研究显示仅Ktrans值及Kep值对TNBC具有较高的预测价值,且Kep值的预测价值最高,敏感性为81.8%,特异性为85.7%。而其他各参数以及Ktrans值及Kep值对其他类型乳腺癌的预测价值均较低,AUC均低于0.7,与Li等[18]的研究结果不一致,Li等[18]研究显示Ve值是较好的TNBC肿瘤预测指标。研究样本量的多少及Ve值容易受病变周围水肿影响[19]等因素,因此关于Ve值作为TNBC的预测指标尚存在争论,需要进一步研究。
本研究具有一定的局限性,某些肿瘤亚型样本量较少,因此统计数据估算精度有所降低;其次没有控制影响血流灌注的因素(如高血压及心脏输出功能)对定量参数测量的影响。
总之,通过DCE-MRI定量参数及ADC值可在一定程度上预测乳腺癌的分子分型,且Kep值对TNBC的预测价值最高。

