两种抗菌剂对不同温度下形成的单增李斯特菌生物膜的清除作用
何美珊,丁楠,卢承蓉,上官文丹,钟青萍*
1(广东省食品质量与安全重点实验室,华南农业大学 食品学院,广东 广州,510642)2(华农(潮州)食品研究院有限公司,广东 潮州,521000) 3(广东展翠食品股份有限公司,广东 潮州,521000)
细菌生物膜(biofilm,BF)是细菌群体由自身分泌的胞外多聚物包裹,并紧紧黏附于物体上的一种生存模式。生物膜内复杂结构,代谢废物的沉积、中心区域缺氧、有限的营养物质和酸性环境等因素促进生物膜中“活的非可培养”(viable but non-culturable state,VBNC)细菌的形成,导致与浮游细胞相比,生物膜内的细菌更难以被抗生素清除[1-2]。单增李斯特菌(Listeriamonocytogenes)为革兰氏阳性菌,是一种重要的食源性致病菌,能引起人类和动物严重的疾病,致死率较高(16%~38%)[3]。目前李斯特菌导致的疾病呈逐年上升的趋势,在德国,2016年李斯特菌致死率达7%,是几种常见肠道致病菌中引起死亡人数最高的细菌[4]。2018年南非爆发李斯特菌感染疫情,共915例感染,180人死亡。在国内,根据历年李斯特菌病的统计,1999年~2014年李斯特菌病的病例数呈明显上升趋势,特别是新生儿感染者或中枢神经系统感染者病情严重,死亡率较高[5]。李斯特菌可在低温下生长,而且其形成的生物膜难以从食品加工设施中根除[6]。但目前对生物膜的研究主要集中于常温下形成的生物膜,对低温下生物膜中致病菌的生存机制的研究还比较欠缺。
目前国内外控制生物膜的方法主要有采用抗生素、酸性和碱性消毒剂、氧化剂、植物精油、中草药、超声波、等离子体和酸性电解水等进行处理[7-14]。但因价格等方面问题,在食品加工中,大多仍使用乳酸、次氯酸钠、过氧化氢等消毒剂进行杀菌处理,但并不能完全清除生物膜。而作为常规抗生素替代品的植物精油是目前研究的一个热点,是食品防腐保鲜的新型天然抗菌剂。目前发现薰衣草精油对多种真菌和细菌都有抑制作用,其可作用于细菌的不同部位,如细胞膜、细胞壁或细胞内的蛋白质和核酸[15-16]。84消 毒液是食品行业最常用的消毒剂之一。但目前有关薰衣草精油和84消毒液对单增李斯特菌生物膜清除效果的研究较少,因此本研究首先考察单增李斯特菌在32 ℃和10 ℃下生物膜的形成情况,在此基础上进一步分析不同浓度的薰衣草精油和84消毒液对其形成的生物膜的清除效果,并探究低温环境对单增李斯特菌生物膜抗性的影响,对控制单增李斯特菌,消除其残留,保障食品安全具有重要意义。
1 材料与方法
1.1 材料与试剂
单增李斯特菌ATCC19115,购于广东微生物菌种保藏中心;脑心浸液肉汤(brainheart infusion broth, BHI),广东环凯微生物科技有限公司;薰衣草精油(纯度99%),青岛优索化学科技有限公司;84消毒液,蓝月亮(中国)有限公司;2×SGExcel FastSYBR mixture(plus)、细菌基因组DNA提取试剂盒,上海生工生物工程股份有限公司;叠氮溴化丙锭(propidium monoazade,PMA),美国Biotium公司。
1.2 仪器与设备
Multiskan FC酶标仪,Thermo公司;650W卤钨灯,德国Osram公司;CFX96 Touch荧光定量PCR仪,美国Bio-Rad公司。
1.3 方法
1.3.1 菌悬液制备
单增李斯特菌接种于BHI培养液中,37 ℃、150 r/min 培养12 h后,4 ℃ 4 000 r/min离心15 min收集菌体,以无菌生理盐水调整菌液浓度为107CFU/mL待用。
1.3.2 生物膜的形成及其测定
1.3.2.1 生物膜的培养和生物量的测定
生物膜的培养和定量检测参考BRENDA等的方法[17],具体步骤如下:在无菌12孔板中垂直放置无菌玻璃片(20 mm×20 mm),将菌悬液与BHI按1∶4体积比混匀后再按5 mL/孔加入到12孔板中,菌初始浓度为107CFU/mL。将孔板在32 ℃及10 ℃分别孵育1 d及30 d,定期测定生物膜的形成量。
采用结晶紫染色法(crystal violet staining,CV法)测定生物膜的形成量,将附着生物膜的玻璃片用10 mL 无菌磷酸盐缓冲液(phosphate buffersalino,PBS)洗涤3次去除浮游细胞。65 ℃干燥固定30 min,并在室温下用5 mL 0.1%结晶紫染色30 min。用无菌蒸馏水清洗3次。干燥后,溶解于5 mL 33%乙酸中,以酶标仪测定595 nm处的吸光度。
1.3.2.2 生物膜的代谢活性测定
采用XTT法,将形成生物膜的玻璃片转移至含有5颗玻璃珠和10 mL PBS的无菌离心管中,使用涡旋剧烈振荡2 min,将生物膜细胞收集在无菌的10 mL离心管中。在96孔板中每孔中加入100 μL生物膜悬液,然后将XTT溶液和甲萘醌溶液按12.5∶1(体积比)混合后,每孔加入50 μL,37 ℃避光孵育4 h,在450 nm下测定吸光值。
1.3.3 PMA-qPCR测定活菌数
1.3.3.1 PMA处理菌体及DNA模板的制备
取0.5 mL菌液于1.5 mL离心管中,加入终浓度为40 μmol/L的PMA,充分混匀,黑暗孵育5 min,然后置于冰上,距离650 W卤钨灯20 cm曝光5 min,离心(8 000 r/min,2 min)收集菌体,加入40 g/L溶菌酶37 ℃处理1 h,用试剂盒提取模板DNA,-20 ℃保存备用。
1.3.3.2 引物设计与合成
根据GenBank中的单增李斯特菌的hly基因,在保守区域用Primer 5.0设计PCR引物,上游引物序列(5’→3’)GGTGGCTCCGCAAAAGATGAAG,下游引物序列(5’→3’)AGGCAATGGGAACTCCTGGTGT,由上海生工有限公司合成。
1.3.3.3 荧光定量PCR反应
反应体系为25 μL:2×Taq PCR Master mix 12.5 μL, 上下游引物各0.5 μL(终浓度20 μmol/L),DNA模版5 μL,补水至25 μL。反应程序:95 ℃、3 min; 95 ℃、10 s,56 ℃、40 s;72 ℃、40 s;39个循环。循环结束后72 ℃保持5 min。熔解曲线:65~95 ℃, 升温速率为0.5 ℃/s。
1.3.4 可培养菌数的测定
采用稀释平板法测定可培养菌数。吸取100 μL经过稀释的菌液,均匀涂布于营养琼脂平板上,于37 ℃ 培养24~48 h后进行菌落计数,每个稀释浓度均设置3个平行。
1.3.5 不同制剂对不同温度下形成的单增李斯特菌生物膜的作用
1.3.5.1 最低抑菌浓度(MIC)的测定
用96孔板微量稀释法测定84消毒液、薰衣草精油的最小抑菌浓度。将84消毒液、薰衣草精油以MH肉汤培养基2倍稀释成8个梯度。每个孔中加入100 μL MH肉汤培养基,第一个孔中加入100 μL制剂混匀,然后吸取100 μL至第2孔,混匀后再吸取100 μL到第3个孔,以此类推到第8孔,从第8孔吸取100 μL弃去,再在每个孔中加入100 μL菌液,使菌液的终浓度是107CFU/mL。每个实验做3次重复,同时设置阴性对照和阳性对照。在32 ℃培养24 h, 用酶标仪在595 nm处测定OD值。
1.3.5.2 测定2种制剂对成熟生物膜的清除作用
12孔板中菌液的初始浓度为107CFU/mL,将玻璃片置于其中,分别在32 ℃及10 ℃孵育12 h及19 d, 使其成熟生物膜得到相同活菌数,把成熟生物膜取出用PBS清洗2次,弃去浮游菌,放入无菌培养皿中,分别加入不同浓度(1/2、1、2、4 MIC)的制剂5 mL, 分别在10和32 ℃处理0.5、1、2、3、6 h,按照上述方法测定生物膜生物量和代谢活性的变化,以及活菌数和可培养数,并计算清除率,如公式(1)所示。
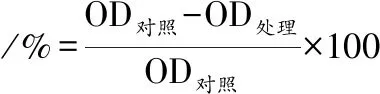
(1)
1.4 统计分析
应用SPSS 13.0 软件进行方差分析,并以最小显著差(least significant difference,LSD)进行组间比较。
2 结果与分析
2.1 不同温度下单增李斯特菌生物膜的形成
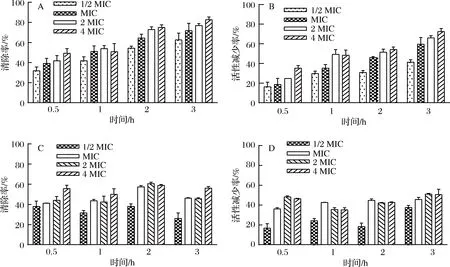
由图1-A所示,单增李斯特菌在32 ℃下培养16 h后,形成的生物膜总量最多,代谢最旺盛,随着培养时间延长,生物膜总量和代谢活性也随之减少,结果表明,单增李斯特菌生物膜在32 ℃、16 h后达到成熟。图1-B表明,单增李斯特菌在10 ℃下第19天时生物量以及代谢活性最大。取单增李斯特菌在32 ℃、12 h和10 ℃、19 d下的生物膜计算活菌数,结果分别为(8.81±0.42)lg CFU/cm2、(9.09±0.05)lg CFU/cm2,通过T检验没有显著差异。
2.2 薰衣草精油对不同温度下形成的单增李斯特菌生物膜的清除作用
经测定薰衣草精油对单增李斯特菌的MIC值为1.6%(体积分数)。采用1/2、1、2、4 MIC的薰衣草精油处理10 ℃和32 ℃形成的生物膜,结果表明,随着薰衣草浓度和处理时间的增加,对生物膜的清除作用逐渐增强,4 MIC的薰衣草精油处理3 h时对32 ℃生物膜的生物量清除率和代谢活性的减少率分别为82%和73%,对低温生物膜的清除作用为56%和50%(图2)。

A-32 ℃;B-10 ℃图1 不同温度下单增李斯特菌的生物膜的形成Fig.1 Biofilm formation of L. monocytogenes at different temperatures
A-32 ℃生物膜的生物量清除率;B-32 ℃生物膜的代谢活性减少率;C-10 ℃生物膜的生物量清除率;D-10 ℃生物膜的代谢活性减少率图2 薰衣草精油对32 ℃和10 ℃下形成的单增李斯特菌生物膜的作用Fig.2 Effects of lavender essential oil on L. monocytogenes biofilm formed at 32 ℃ and 10 ℃
2.3 84消毒液对不同温度下形成的单增李斯特菌生物膜的清除作用
经测定84消毒液对单增李斯特菌的MIC值为2.5%(体积分数)。采用1/2、1、2、4 MIC的84消毒液处理10 ℃和32 ℃形成的生物膜,结果显示,随着84消毒液浓度的升高和处理时间的延长,清除率逐渐增加,4 MIC处理32 ℃生物膜3 h时,生物量和代谢清除率为78%和60%,对10 ℃生物膜的清除率为56%和48%。低温生物膜的抗性更强。两种制剂对常温生物膜的清除能力均比低温生物膜效果显著(图3)。

A-32 ℃生物膜的生物量清除率;B-32 ℃生物膜的代谢活性减少率;C-10 ℃生物膜的生物量清除率;D-10 ℃生物膜的代谢活性减少率图3 84消毒液对32 ℃和10 ℃下形成的单增李斯特菌生物膜的作用Fig.3 Effects of 84 disinfectant on L. monocytogenes biofilm formed at 32 ℃ and 10 ℃
2.4 不同制剂处理对不同温度下形成的生物膜细胞的影响
采用4种浓度的薰衣草精油和84消毒液处理两种温度下形成的单增李斯特生物膜3 h,活菌数和可培养数如图4所示。
经过薰衣草精油处理后,32 ℃生物膜较10 ℃生物膜的菌数下降明显,4 MIC处理下,32 ℃生物膜活菌数减少6.35 lg CFU/cm2,可培养数减少9.01 lg CFU/cm2。低温生物膜处理前活菌数为9.09 lg CFU/cm2,可培养菌数为5.78 lg CFU/cm2,约有3.32 lg CFU/cm2细胞进入VBNC状态;经4 MIC薰衣草精油处理后活菌数为5.94 lg CFU/cm2,减少了3.16 lg CFU/cm2,可培养数为3.85 lg CFU/cm2,减少了1.93 lg CFU/cm2,仍存有VBNC细胞。4 MIC浓度处理下,10 ℃生物膜中残留更多的活菌和VBNC细胞(图4-A)。图4-B显示,4 MIC的84消毒液处理后,32 ℃生物膜中生物膜活菌减少量为3.68 lg CFU/cm2,而10 ℃生物膜减少量约2.88 lg CFU/cm2。薰衣草精油比84消毒液对生物膜中活菌数的减少更加显著。
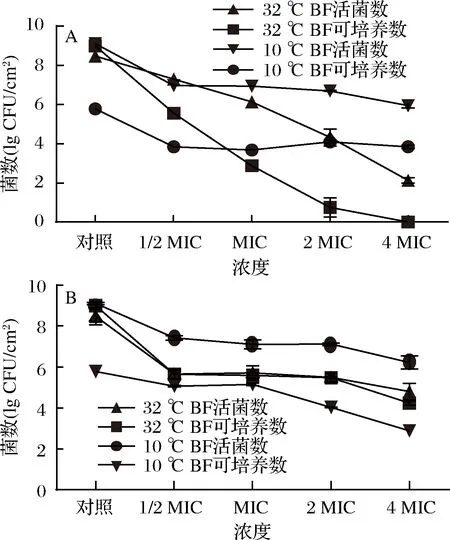
A-薰衣草精油;B-84消毒液图4 两种制剂对两种温度下形成的单增李斯特菌生物膜细胞的影响Fig.4 Effects of two agents on L. monocytogenes cells in biofilms formed at two temperatures
3 讨论
本研究考察了32 ℃和10 ℃下单核细胞增生李斯特菌的生物膜的形成,并分析了2种制剂对其成熟生物膜的清除作用。选择32 ℃主要为该菌的适宜生长温度且为夏季常见温度。另外,果蔬及肉制品通常储存于0~4 ℃,但实际上,在冷藏条件和运输过程中,温度可能升高至10 ℃[18]。基于单增李斯特菌能耐低温,因此本研究亦考察10 ℃低温对其生物膜形成及其抗性的影响。
DI BONAVENTURA等[19]发现与聚苯乙烯、不锈钢相比,在玻璃表面上单增李斯特菌在4、12和22 ℃更易形成生物膜,而在37 ℃时,在不锈钢和玻璃表面上能形成相当量的生物膜。玻璃为食品加工及储藏中常见的接触面,因此本研究在玻璃面上考察不同温度下单增李斯特菌生物膜的形成特性,研究结果表明,单增李斯特菌在低温下能形成稳定的生物膜,但生物膜量显著低于32 ℃,在32 ℃时单增李斯特菌能更快形成生物膜。这可能是由于温度升高细胞生长加快,而且细胞疏水性随温度升高而增加,从而增强了细胞黏附能力[20]。此外,鞭毛是细胞运动所必须的,与生物膜形成密切相关,VATANYOOPAISARN等[21]发现单核增生李斯特菌的运动性在较低温度下急剧下降,可能导致细胞附着量较低,形成的生物膜较少。然而随着培养时间延长,单增李斯特菌在10 ℃下培养19 d时生物膜活菌数为(9.09±0.05)lg CFU/cm2,表明其在低温下能长期存活并形成生物膜。
本研究以不同浓度的薰衣草精油和84消毒液处理单增李斯特菌在32 ℃和10 ℃下形成的成熟生物膜,采用结晶紫法和XTT法分析其对生物膜清除的效果。结果表明,随着浓度和处理时间的增加,薰衣草精油和84消毒液对生物膜的代谢活性和生物量清除效果逐渐增强,但对32 ℃生物膜的效果优于对10 ℃下形成的生物膜(图2和图3)。低温下形成的生物膜对防腐消毒剂的耐受性的机制有待于进一步研究。
为分析其抗性,本研究首先测得32 ℃孵育12 h与10 ℃孵育19 d的生物膜具有相当的活菌数,以此为材料进一步定量评估薰衣草精油和84消毒液对两种温度下形成的生物膜中细菌的杀灭能力,分别测定处理3 h后的可培养菌数和活菌数。总的来说,10 ℃生物膜对两种制剂的敏感性比32 ℃下形成的生物膜更低。PUGA等[22]以壳聚糖处理20 ℃和4 ℃形成的单增李斯特菌生物膜,发现4 ℃形成的生物膜更薄但对壳聚糖的抗性更强,可能是在低温形成的膜基质致密性增加从而影响壳聚糖渗透。细菌VBNC状态是指其不能在传统培养基上生长繁殖,但仍具有活性,并可在适宜条件下复苏的特殊状态[23],与正常细胞相比,VBNC细胞表现出比可培养的细胞更低的代谢活性,能继续保持膜完整性。我们发现,在低温形成的生物膜中,约有1/3的单增李斯特菌细胞进入VBNC状态,这可能与低温生物膜对防腐消毒剂的抗性增强密切相关。NOWAKOWSKA等[24]发现低温诱导的VBNC创伤弧菌具有更强的对热、氧化应激、渗透压、pH、乙醇、重金属和抗生素的耐受性。
薰衣草精油主要成分为乙酸芳樟酯和芳樟醇,CHERRAT等[25]以5种精油分别处理单增李斯特菌和大肠杆菌280 min或24 h后,使用荧光探针监测细菌的膜流动性和完整性,发现香薄荷精油和月桂精油能使细胞膜表面硬化,可渗透在细胞质膜中与膜中存在的蛋白质相互作用并扰乱它们的功能。DI PASQUA等[26]研究发现一些细菌可以改变膜脂肪酸组成,以抵消精油活性成分对细胞膜流动性的影响,从而维持细胞膜的结构和功能。
84消毒液的主要成分为次氯酸钠,次氯酸钠是食品工业中常用的消毒剂,在水中形成次氯酸,其主要作用机理为次氯酸能与质粒DNA直接反应导致双链断裂,以及侵入细胞内部与蛋白质发生氧化作用[27-28]。徐冬旸等[29]研究表明,常规浓度的84消毒液处理可抑制李斯特菌的生长,而LEE等[30]研究发现游离氯只能使外部生物膜失活,而内部生物膜不受游离氯的影响,游离氯不能完全渗透生物膜。NORWOOD[31]以1 000 mg/L的次氯酸钠处理单增李斯特菌生物膜20 min, 结果可培养细胞减少2 lg CFU/mL,而去除相同量的浮游细胞仅需要10 mg/L的次氯酸钠。VBNC细胞的低呼吸活动意味着与细胞外环境的营养和能量交换减少,使其在饥饿坏境及氯和氯胺消毒中存活[32]。本研究发现84消毒液和薰衣草精油处理0.5~1 h对32 ℃生物膜与10 ℃生物膜的清除效果差异不大,随着时间延长,对32 ℃生物膜的清除作用高于10 ℃生物膜。薰衣草精油对32 ℃生物膜活菌的清除能力高于84消毒液,而2种制剂对10 ℃生物膜活菌的清除效果相差不大。2种制剂均能诱导部分生物膜细胞进入VBNC状态,使平板计数结果远低于活菌数。低温生物膜可增强单增李斯特菌对防腐消毒剂的抗性,需增加剂量或延长处理时间才能有效清除生物膜细胞。

