大麦β-淀粉酶在枯草芽孢杆菌中异源表达
汪薛良,钮成拓,包敏,李崎,王金晶*
1(江南大学,酿酒科学与工程研究室,江苏 无锡,214122) 2(江南大学 生物工程学院,江苏 无锡,214122)
β-淀粉酶,又称麦芽糖苷酶[1],是一种外切型糖化酶。它能从淀粉的非还原性末端开始依次切开间隔的α-1,4糖苷键生成麦芽糖和β-极限糊精[2]。β-淀粉酶被广泛应用于食品粮食加工、发酵工业、医药等行业[3],是一种需求量巨大的重要工业用酶,在啤酒酿造,β-淀粉酶作为糖化剂也有着不可替代的作用[4]。
β-淀粉酶主要来源于一些高等植物及少数微生物,如大麦、甘薯、水稻、芽孢杆菌等。植物来源的β-淀粉酶的酶活力普遍较高,温度稳定性较好,作用pH范围较广[5],相比于植物来源的β-淀粉酶,微生物来源的β-淀粉酶最适温度和热稳定性普遍较低[6]。目前,工业所使用的β-淀粉酶主要来自于植物提取与微生物发酵,其中大麦提取的β-淀粉酶由于其应用效果好而深受工厂的青睐,但是大麦中的β-淀粉酶含量不高,提取工艺复杂导致其提取成本较高,且耗费大量粮食[7]。微生物发酵产酶虽然产量高,但是通常由于其稳定性不够而难以达到好的使用效果,因此研究者们开始关注于微生物异源表达植物来源的β-淀粉酶。张萧萧等构建并筛选得到了1株高分泌表达大麦β-淀粉酶的重组巴斯德毕赤酵母GS-BBA,重组酵母在摇瓶发酵条件下的酶活为180 U/mL[8];许黎明等还将大豆β-淀粉酶在毕赤酵母中实现了高密度发酵表达,经过混合碳源诱导后的酶活达到了310 U/mL[9]。但是由于毕赤酵母的诱导表达往往需要添加甲醇,难以直接应用于工业生产。另外还有大量研究者将大麦β-淀粉酶导入大肠杆菌实现了重组表达,但是发现异源表达出的β-淀粉酶的热稳定性较差,容易被降解而失去活力[10-11]。
由于目前阶段大麦β-淀粉酶的微生物重组表达均存在一定的缺陷,需要找到一个合适的宿主来进行大麦β-淀粉酶的重组表达。枯草芽孢杆菌是非致病性的革兰氏阳性菌,不含内毒素,且发酵条件简单,细胞生长密度高,分泌蛋白能力强,是一类重要的工业酶制剂生产菌种。全球大约有50%的工业酶制剂是由枯草芽孢杆菌生产[12],是美国食品药品监督管理局授予GRAS(公认安全)的微生物,被归入食品级微生物范畴[13]。因此开发利用枯草芽孢杆菌表达系统生产食品添加剂将成为主要趋势。WB800为敲除了8个蛋白酶基因的枯草芽孢杆菌菌株,可更加高效地表达重组蛋白且便于后续的蛋白质提纯。因此,本研究选用枯草芽孢杆菌WB800作为宿主来异源表达大麦来源的β-淀粉酶,探索其分泌表达大麦β-淀粉酶基因的可行性并对重组表达的β-淀粉酶酶学性质进行了测定。
1 材料与方法
1.1 材料
1.1.1 菌株质粒与试剂
大肠杆菌JM109、枯草芽孢杆菌WB800,均为本研究室前期保藏;大麦β-淀粉酶基因的载体pET-28a(+)-amyB,为本研究室前期所构建[10];pP43NMK,为张晓舟博士所构建的枯草芽孢杆菌分泌表达质粒载体[14],于本研究室保藏。载体限制性内切酶、大肠杆菌感受态细胞制备试剂盒,购自大连TaKaRa生物工程有限公司;无缝克隆试剂盒SoSoo,购自北京擎科新业生物技术有限公司;质粒小提试剂盒、Cycle Pure PCR产物回收试剂盒等,购自OMEGA Bio-tek公司;β-淀粉酶试剂盒、BETAMYL-3,购自爱尔兰Megazyme公司;商品β-淀粉酶,购自北京生东科技公司;其他试剂均为国药集团有限公司产品。
1.1.2 培养基配制
LB培养基(g/L):酵母膏5、蛋白胨10、NaCl 10。
Superrich培养基(g/L):葡萄糖30、酵母膏20、蛋白胨25、K2HPO43。
SP-A盐溶液(g/L):(NH4)2SO44、K2HPO4·3H2O 28、 KH2PO412、二水合柠檬酸三钠2。
SP-B盐溶液(g/L):MgSO4·7H2O 0.4。
100×CAYE溶液(g/L):酪蛋白水解物20、酵母膏100。
SPI培养基(20 mL):9.8 mL SP-A盐溶液、9.8 mL SP-B盐溶液、200 μL葡萄糖溶液、200 μL 100×CAYE溶液。
SPⅡ培养基(6 mL):5.8 mL SPI培养基、60 μL 50 mmol/L CaCl2溶液、60 μL 250 mmol/L MgCl2溶液、80 μL双蒸水。
1.2 实验方法
1.2.1 枯草芽孢杆菌表达载体的构建
本研究中表达载体的构建采用的是无缝克隆的方法,相比于传统的双酶切连接法更加高效。以pET-28a(+)-amyB为模板,根据pP43NMK中插入的基因两端酶切位点设计引物如下:
P1(F): AACACATGCCTCAGCATGGAAGTTAATGTGAAGGGCAAC;
P2(R): TGATTACGCCAAGCTTTACATTGTCGCAGGCAGTTCG。
PCR反应条件为95 ℃预变性3 min,95 ℃变性1 min; 56 ℃退火45 s;72 ℃延伸2 min;72 ℃再延伸5 min,循环30次。同时采用Hind Ⅲ、PstI限制性内切酶将pP43NMK线性化后,切胶回收纯化后按照说明书上的反应体系进行连接反应并转化大肠杆菌[15]。双酶切验证正确后采用EGTA螯合的方法将得到的重组质粒pP43NMK-amyB转化枯草芽孢杆菌[16]。
1.2.2 重组酶的表达与纯化
将重组枯草芽孢杆菌接种至50 mL含Kan的Superrich液体培养基中,于37 ℃、180 r/min振荡培养。定时取培养液测定OD600与酶活力值,在酶活力值得到峰值时收集菌液,于4 ℃、6 000 r/min离心20 min收集上清液。向上清液中缓慢加入粉末状(NH4)2SO4至不同终点饱和度(10%、20%、30%、40%、50%、60%、70%),4 ℃静置过夜。次日将得到的溶液分别离心后测定上清液的酶活力值,确定二次盐析最适饱和度后,取发酵上清液加入低饱和度的(NH4)2SO4去除杂蛋白,再加入高饱和度(NH4)2SO4沉淀蛋白。用20 mmol/L Tris-HCl(pH 7.5)缓冲液溶解沉淀后放入截留分子质量为3 500 kDa的透析袋中并置于去离子水中透析过夜,期间数次更换去离子水。得到的溶液采用Hi Trap QHP阴离子交换柱纯化,柱体积为5 mL, 上样量为30 mL,流速为2 mL/min,先后采用含0.1、0.2、0.3 mol/L NaCl的Tris-HCl缓冲液进行梯度洗脱。收集洗脱峰并测定酶活,采用截留分子质量为10 kDa的蛋白超滤浓缩离心管对洗脱液进行浓缩,经SDS-PAGE鉴定后将得到的溶液置于4 ℃保存。
1.2.3 重组酶的酶活力测定
β-淀粉酶酶活力的测定采用DNS(3,5-dinitrosalicylic acid)法,首先取6支25 mL具塞比色管,分别加入0.0、0.4、0.8、1.2、1.6、2.0 mL麦芽糖标准溶液(1 g/L),然后向各管中加入蒸馏水至2 mL,再加入3 mL DNS试剂,沸水浴加热10 min,取出冷却至室温,取2 mL反应液加蒸馏水稀释至10 mL。混匀后以未加麦芽糖标准溶液的比色管为对照在 540 nm 下测量吸光度,绘制标准曲线,得出其线性回归方程为y=2 979+0.022 6(R2=0.993 5)。进行样品测定时分别加入1 mL酶液(20 mmol/L磷酸盐缓冲液稀释)与1 mL 1%淀粉溶液,55 ℃恒温水浴10 min,置于冰水浴2 min终止反应,然后加入3 mL DNS试剂,混匀,沸水浴中煮沸10 min,取出冷却至室温,取2 mL反应液用蒸馏水定容至10 mL,以蒸馏水代替酶液为空白,在540 nm处测定吸光度,计算酶活力,如公式(1):
(1)
式中:E,样品溶液吸光度;n,样品溶液的稀释倍数;5,2 mL反应液换算成10 mL的倍数;6,10 min反应时间换算成1 h;h,标准曲线的斜率。
酶活单位定义为1 mL酶液最适条件下1 h水解质量分数1%可溶性淀粉液生成1 mg麦芽糖为1个酶活力单位,以U/mL表示。
1.2.4 重组酶的酶学性质
最适温度,以5 ℃为1个间隔,分别测定纯化后β-淀粉酶酶液在40 ~70 ℃下的酶活力值(每次测定设置3份平行样,下同),设酶活力值最高值为100%,计算其他温度下的相对酶活,以确定最适温度。
最适pH,采用不同pH的缓冲液体系配制底物反应缓冲液,以0.5个pH单位为一个间隔,分别测定β-淀粉酶在pH 3~8的酶活力,以酶活力最高值为100%,计算其他pH下的相对酶活,以确定最适pH。
温度稳定性,将β-淀粉酶酶液分别在50和 60 ℃ 条件下处理不同时间再测定酶活,以未经过热处理的酶液作为对照,测定其反应液在540 nm处的吸光度,并将其酶活值设为100%,不同处理时间下的酶活值除以最大值所得百分数即为该处理时间下的剩余酶活。剩余酶活降低至50%时所需的时间即为酶活力半衰期。
1.2.5 糖化实验
配制质量分数为30%的麦芽糊精样品4份,调溶液pH值至5.5并在55 ℃下预热一段时间,分别加入50 U/g(干基)的重组β-淀粉酶、1 U/g的普鲁兰酶和50 U/g(干基)的重组β-淀粉酶、50 U/g(干基)的大麦β-淀粉酶和50 U/g(干基)商品β-淀粉酶,于恒温水浴锅中55 ℃糖化48 h,定时取样用高效液相色谱检测麦芽糖生成量。
1.2.6 高效液相色谱分析条件
首先对糖液样品进行70%乙醇沉淀处理,静置2 h 后离心10 min,取上清液用0.45 μm微孔膜过滤后进样。色谱条件:Agilent Waters X-Bridge氨基柱(4.6 mm×250 mm,5 μm);示差检测器;流动相乙腈体积分数为75%;流速1 mL/min;柱温:室温。麦芽糖生成率以生成的麦芽糖总量除以麦芽糊精(绝干)总质量表示。
2 结果与分析
2.1 重组菌的构建与鉴定
将PCR扩增得到的amyB基因与线性化的在质粒载体进行连接反应并转化大肠杆菌,筛选得到片段与载体成功连接的阳性转化子并进行双酶切验证,结果如图1-A所示,可以看出片段大小在1.6 kbp处,与目的片段大小相符,说明重组表达载体pP43NMK-amyB构建成功。将其转化枯草芽孢杆菌WB800,菌落PCR结果如图1-B,其中约80%为阳性转化子,将转化子接种至含kan的液体培养基中可正常生长,说明重组枯草芽孢杆菌B.subtilisWB800/pP43NMK-amyB(WB-amyB)构建成功。

A-重组质粒pP43NMK-amyB的双酶切电泳图;B-重组枯草芽孢杆菌WB800菌落PCR结果图1 重组菌的构建与验证Fig.1 Construction and verification of recombinant B. subtilis WB800/pP43NMK-amyB注:M-DNA分子质量标准; 图1-A中,1-pP43NMK-amyB的双酶切;图1-B中,1~10-单菌落编号。
2.2 重组菌的发酵产酶进程
在1 L三角瓶中进行重组菌的发酵实验,定时取样测定OD600与酶活力,结果如图2所示。重组菌WB-amyB在培养12 h后进入对数生长期,生长至24 h 后菌体进入稳定期,生长速率维持稳定,β-淀粉酶酶活力不断上升,说明重组菌进入稳定期后能够持续地合成与分泌β-淀粉酶。在培养约80 h时产酶水平达到峰值,此时酶活力值为386 U/mL,此后酶活力值稍有减低,之后基本维持不变,即培养80 h为最佳产酶时间。

图2 重组菌的生长曲线与产酶曲线Fig.2 Growth curve and enzyme production curve of recombinant strain
2.3 重组β-淀粉酶与大麦β-淀粉酶的分离纯化
摇瓶发酵约80 h时将发酵液离心收集上清液,首先采用盐析的方法对上清液进行粗提纯。分别加入饱和度为10%~70%的(NH4)2SO4,测定每一步中上清液与沉淀的酶活力,得到盐析曲线如图3所示,可以看出当(NH4)2SO4饱和度为20%时β-淀粉酶开始析出,60%时完全析出。所以在进行盐析提纯时先加入20%饱和度的(NH4)2SO4去除杂蛋白,离心弃沉淀后再向上清中加入40%的(NH4)2SO4,收集沉淀并用去离子水复溶,得到的样品透析过夜之后采用QHP阴离子交换柱纯化蛋白样品。纯化过程中测定每个步骤酶的比活力与回收率,结果如表1所示,可以看出经过QHP离子交换纯化后酶的比活力达到613 U/mg,回收率为41%。同时采用凝胶色谱柱Superdex G75对同一品种大麦β-淀粉酶制剂进行纯化[10]。收集重组β-淀粉酶与大麦β-淀粉酶的蛋白洗脱峰进行SDS-PAGE验证,结果如图4所示,可以看出纯化后的重组β-淀粉酶与大麦β-淀粉酶均为单一条带,大小约为59 kDa。
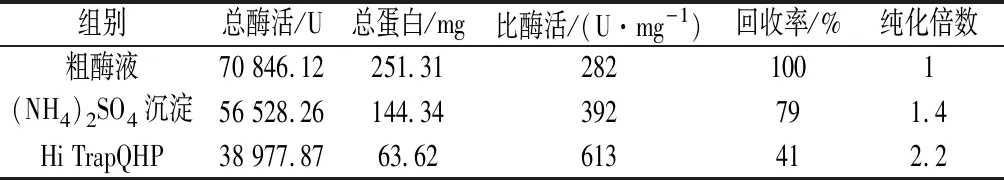
表1 重组枯草芽孢杆菌分泌β-淀粉酶纯化过程Table 1 Purification process of β-amylase produced by recombinant B.subtilis
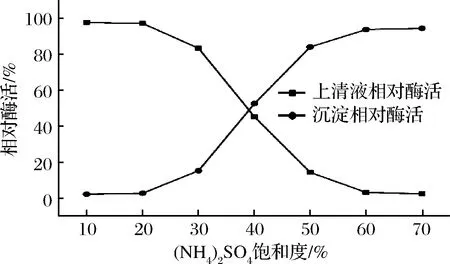
图3 (NH4)2SO4分级沉淀提纯重组β-淀粉酶Fig.3 Purification of recombinant β-amylase by ammonium sulfate fractional precipitation
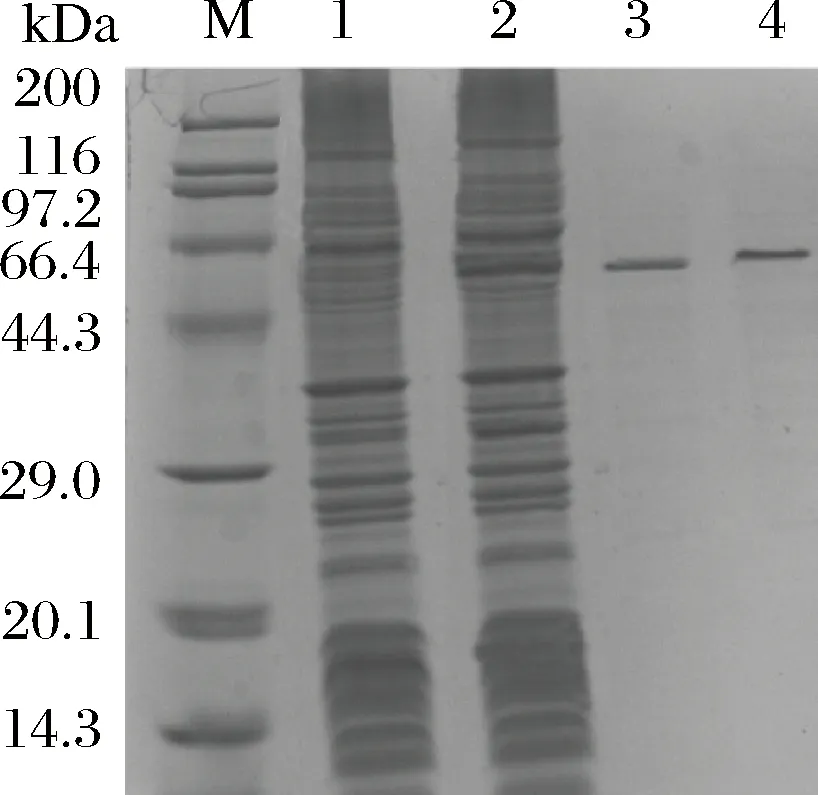
M-蛋白质标准分子质量;1-含空质粒的枯草芽孢杆菌发酵液;2-含重组质粒的重组枯草芽孢杆菌发酵液;3-纯化后的重组β-淀粉酶;4-纯化后的大麦β-淀粉酶图4 纯化的重组β-淀粉酶与大麦β-淀粉酶SDS-PAGE结果Fig.4 SDS-PAGE results of recombinant β-amylase and barley β-amylase
2.4 重组酶的酶学性质
分别测定和比较了纯化后重组β-淀粉酶与大麦β-淀粉酶的比酶活以及最适温度、最适pH值和50、60 ℃条件下的温度稳定性,结果如表2与图5所示。纯化后的重组β-淀粉酶与大麦β-淀粉酶的比酶活分别为613和661 U/mg,说明枯草芽孢杆菌分泌表达的重组β-淀粉酶的催化性质没有改变。

表2 大麦β-淀粉酶与重组β-淀粉酶的酶学性质比较Table 2 Comparative of enzymatic properties between recombinant β-amylase and purified barley β-amylase
将纯化后的β-淀粉酶在不同温度下反应10 min测定其最适反应温度。从图5-A可以看出重组β-淀粉酶与大麦β-淀粉酶的最适温度均为55 ℃,且在温度高于55 ℃后酶活迅速下降,重组β-淀粉酶在65 ℃ 下的相对酶活约为40%。
将纯化后的β-淀粉酶用不同pH的磷酸盐缓冲液稀释后测定其相对酶活。从图5-B中可以看出重组β-淀粉酶的最适pH值为5.0,其在pH 3.5~5.5能保持较高的酶活力,在pH>5.5时酶活力下降明显。而大麦β-淀粉酶的最适pH值 为6.0,在pH 4.5~7 相对酶活能维持在80%左右。与大麦β-淀粉酶相比,重组β-淀粉酶的最适pH降低了1.0,且在pH 3~5的相对酶活也要高于大麦β-淀粉酶,其适应的pH范围也向酸性方向发生了偏移。这说明枯草芽孢杆菌重组表达的β-淀粉酶的耐酸性增强了。
将纯化后的β-淀粉酶分别放置在50、60 ℃条件下,每隔10 min取样测其相对酶活,得到温度稳定性曲线,结果如图5-C与图5-D所示。由图5-C可以看出重组β-淀粉酶与大麦β-淀粉酶在50 ℃条件下作用时酶活力均缓慢下降,作用80 min后仍能保持60%左右的酶活力,且50 ℃条件下大麦β-淀粉酶的温度稳定性稍优于重组β-淀粉酶。由图5-D可以看出60 ℃条件下作用时大麦β-淀粉酶的热失活曲线也比重组β-淀粉酶稍微缓慢,重组β-淀粉酶与大麦β-淀粉酶在60 ℃时的半衰期分别为49和41 min,60 ℃作用1 h后酶活力残留30%和40%。
2.5 重组β-淀粉酶的应用效果
为了考察重组β-淀粉酶单独使用以及与普鲁兰酶联合使用的实际应用效果,以质量分数30%的麦芽糊精作为底物溶液进行水解实验。并以大麦β-淀粉酶、商品β-淀粉酶作为对照,麦芽糖生成量采用高效液相色谱进行定量检测,结果如图6所示。

A-最适温度;B-最适pH;C-50 ℃温度稳定性;D- 60 ℃温度稳定性图5 纯化的大麦β-淀粉酶与重组β-淀粉酶的酶学性质比较Fig.5 Comparative of enzymatic properties between recombinant β-amylase and purified barley β-amylase
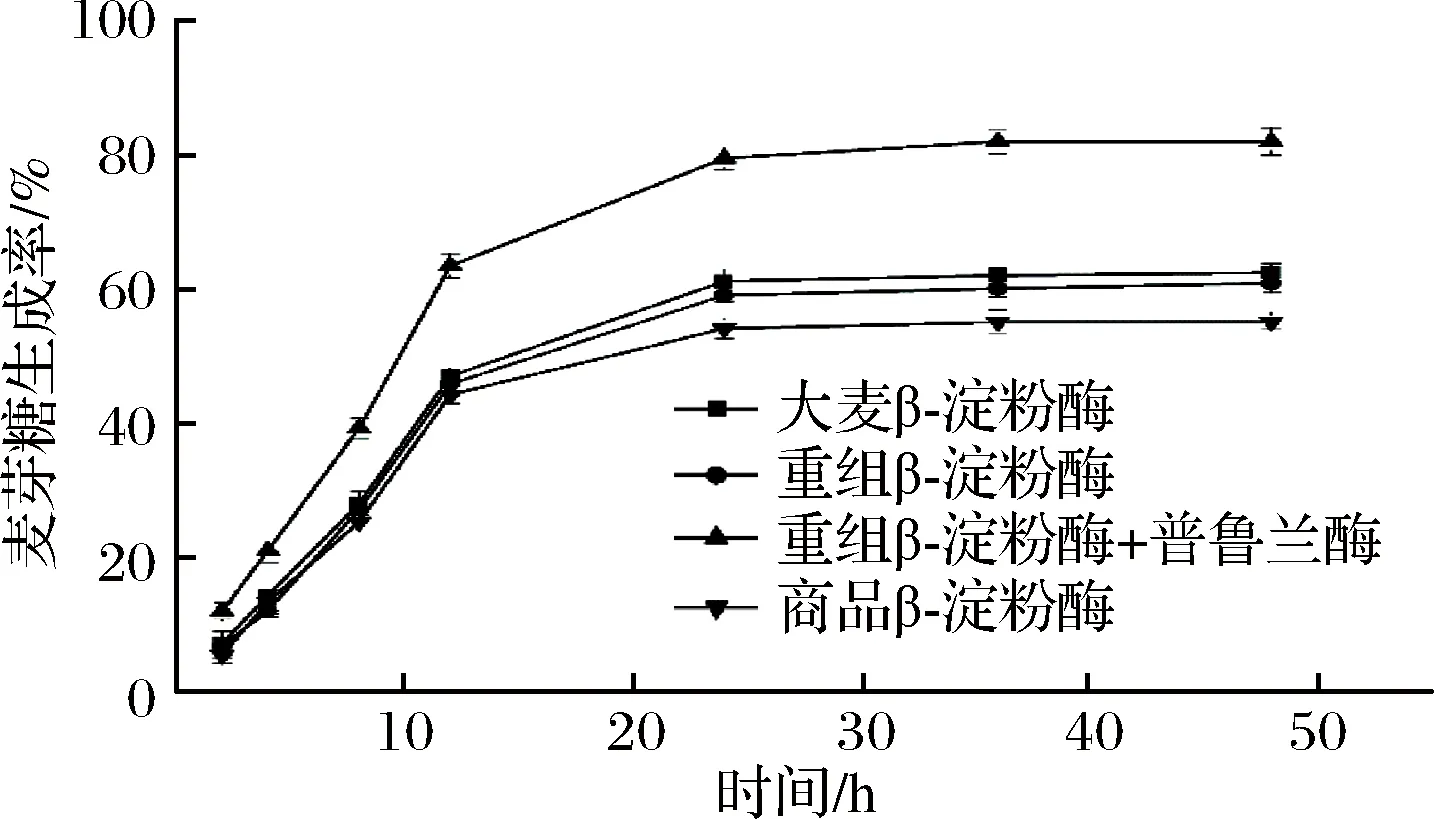
图6 不同来源β-淀粉酶水解麦芽糊精产生麦芽糖过程Fig.6 Maltose production from maltodextrin hydrolyzed by different sources of β-amylase
添加相同酶活的重组β-淀粉酶、大麦β-淀粉酶水解生成麦芽糖的能力相似,其麦芽糖最终转化率分别为60.77%和62.41%,而商品来源β-淀粉酶的麦芽糖转化率则为55.04%,略低于前两者,这说明枯芽孢杆菌重组表达的β-淀粉酶完全可以替代大麦β-淀 粉酶的作用。在重组β-淀粉酶中添加普鲁兰酶之后,可明显提高麦芽糖的生成速率以及转化率,在相同的条件下添加普鲁兰酶的重组β-淀粉酶的麦芽糖最终转化率达到81.87%,说明重组β-淀粉酶与普鲁兰酶联用达到的效果可以满足高麦芽糖浆的生产。
3 讨论
β淀粉酶主要来源于植物和微生物,如大麦,甘薯,芽孢杆菌等。植物来源的β-淀粉酶通常具有更高的耐热性和催化活性,但是其提取效率低、成本高且受季节因素影响。微生物来源的β-淀粉酶在生产上不受季节的影响,更适合规模化生产和自动化控制[17],因此使用微生物表达植物来源β-淀粉酶成为淀粉酶应用领域中的一个重要目标。而枯草芽孢杆菌本身就有产淀粉酶系的菌株,且发酵条件简单,细胞生长密度高,分泌蛋白能力强,因此枯草芽孢杆菌是异源表达β-淀粉酶的理想宿主。
本研究将大麦来源的β-淀粉酶基因amyB导入枯草芽孢杆菌WB800,构建的重组菌WB-amyB可以稳定分泌表达β-淀粉酶,将本研究与其他异源表达的β-淀粉酶研究相比较,结果见表3。
在异源表达大麦β-淀粉酶的研究中,目前未见文章报道过在枯草芽孢杆菌中实现大麦β-淀粉酶的异源表达,枯草芽孢杆菌是一种食品安全的宿主,其表达的重组酶可直接分泌到胞外,便于酶的提纯。本研究以枯草芽孢杆菌WB800作为宿主,在摇瓶发酵水平中的酶活力值可以达到386 U/mL,高于已有文献报道[8,18-20]。重组β-淀粉酶的酶学性质与大麦β-淀粉酶相比几乎相同,保留了大麦β-淀粉酶相对较好的耐热性与稳定性,且重组β-淀粉酶在偏酸性的环境中稳定性更强,因此在需要耐酸性β-淀粉酶的工业中具有一定的应用潜力。重组β-淀粉酶水解产生麦芽糖的能力与大麦β-淀粉酶相当,与普鲁兰酶联用时麦芽糖转化率可达81.8%,可直接用于生产高麦芽糖浆。
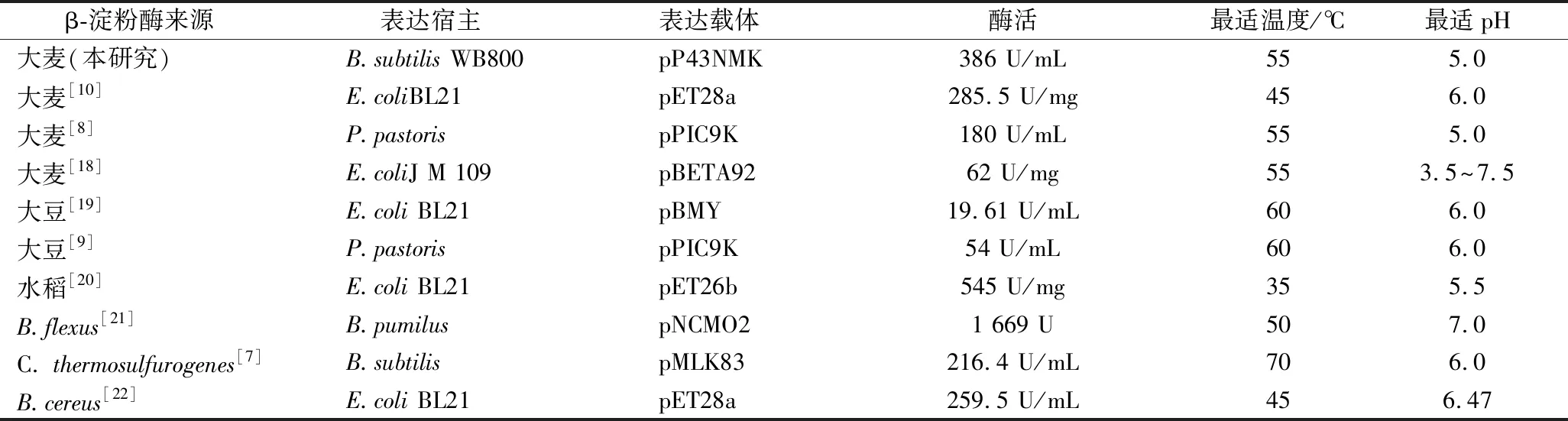
表3 不同来源β-淀粉酶表达情况的比较Table 3 Comparison ofexpression properties of different sources of β-amylase
有文献报道采用大肠杆菌异源表达的植物β-淀粉酶热稳定性下降,容易被降解而失去活力[10-11],采用毕赤酵母作为宿主异源表达的β-淀粉酶虽然酶学性质没有发生改变,但是酵母表达系统难以实现淀粉酶水解酶系的异源高表达,其原因尚不清楚[23]。枯草芽孢杆菌表达的异源蛋白一般通过普通分泌途径(Sec)分泌到胞外,在蛋白穿膜之后,信号肽酶会切除信号肽,使蛋白质折叠成正确的构象[24],而大肠杆菌表达异源蛋白时一般为胞内表达,不存在跨膜过程,因此异源蛋白可能会出现错误的折叠,且大肠杆菌在表达异源蛋白时容易形成包涵体,酶的性质可能也会因此受到一定的影响。
本研究仅测定了重组枯草芽孢杆菌在摇瓶发酵水平上的产酶活力,下一步将采用罐式发酵对发酵条件进行探究,使重组枯草芽孢杆菌产酶量进一步提高。此外,对大麦β-淀粉酶基因改造的研究一直以来也颇受关注,有学者通过比对不同热稳定性的大麦等位基因,采用定点突变的方法提高了大麦β-淀粉酶的热稳定性与催化活性[25],另外还有学者通过移除大麦β-淀粉酶C末端4个富含甘氨酸的片段发现其与底物的亲和力以及热稳定性都有了显著提高[26]。本研究所表达的大麦β-淀粉酶基因来自于一株野生大麦品种Haruna Nijo (GenBank:BAA04815.1)。故在枯草芽孢杆菌异源表达的基础上可通过氨基酸序列比对等手段对其基因序列进行改造,提高其稳定性与催化活性,从而获得性质更加优良的重组β-淀粉酶。

