果酒酵母菌多菌种混合培养的生长规律及挥发性风味物质的差异性分析
白梦洋 吴祖芳 李若云 熊国通 翁佩芳
(宁波大学食品科学与工程系 应用海洋生物技术教育部重点实验室 浙江宁波 315211)
果酒的风味是衡量果酒品质的最重要特征之一,其风味成分十分丰富,由果酒酵母发酵形成的风味物质影响果酒的化学特性和感官特性[1]。果酒的香气成分主要由两类组成,一类是萜烯类化合物,是由酿酒使用的原料品种及产地决定,而更多的风味来源于二类香气物质,主要包括醇类、酯类、酸类、醛酮类、脂肪酸、挥发性酚类、含硫化合物、烃类、羰基化合物及杂环类化合物等,其种类和产量与所用酵母密切相关[2-4]。果酒香气的形成是一个复杂的内部反应,由多种挥发性化合物以及这些化合物之间通过各种方式相互作用,最终形成果酒的香气和风味[5]。
传统果酒的发酵是一个复杂的多种微生物共同作用的过程,酵母在其中起着重要的作用,是影响果酒风味独特性的最主要因素。与单菌种发酵相比,酵母的混合发酵能表现出更好的特性,如增加甘油含量和总酸度及产生多种酯类、酮类、挥发性酚类等特殊物质,改善果酒的质量和品质,增强果酒风味多样性[6-8]。在葡萄酒酿造过程中,酿酒酵母表现出很弱的β-葡萄糖苷酶活性,因此在发酵完成后大多数葡萄糖苷风味前体物质仍未被水解,而接种Debaryomyces vanriji后,能产生较高活力的β-葡萄糖苷酶,从而有效地释放出风味化合物[9]。Garcia等[10]研究发现,采用酵母菌联合发酵72 h后,酶活力是对照葡萄酒中的2倍,且联合培养发酵液中的几种酸、醇、酯和萜烯醇的浓度明显增强,使果酒的风味得以增强和改善。
作者所在团队在前期研究中已筛选获得对发酵风味有重要贡献的毕氏酵母菌65(Pichia fabianii 65,简称Pf)和东方伊萨酵母菌(Issatchenkia orientalis 166,简称Io)以及酒精发酵的重要菌株——酿酒酵母菌131(Saccharomyces cerevisiae 131,简称Sc),在细胞混合培养相互影响因素及转录组测序研究基础上(另文发表),进行单菌种及混合培养,分析酵母菌混合发酵时生长变化规律和挥发性风味代谢产物。本研究结果可丰富果酒酿造混合菌发酵技术理论及探明风味发酵形成的微生物作用机制,对改善果酒品质和提高果酒酿造技术水平具有一定的指导意义。
1 材料与方法
1.1 材料与试剂
菌种:酿酒酵母菌(Saccharomyces cerevisiae)131(简称 Sc)、毕氏酵母菌(Pichia fabianii) 65(简称Pf)、 东方伊萨酵母菌 (Issatchenkia orientalis)166(简称Io)均保藏于宁波大学海洋学院食品生物技术实验室。
酵母浸出粉胨葡萄糖培养基 (Yeast Extract Peptone Dextrose Medium,YPD):葡萄糖 20 g/L、蛋白胨20 g/L、酵母浸粉10 g/L(固体加入20 g/L琼脂粉),pH 5.5±0.2。
含山梨醇的基本培养基 (minimal medium,MM):5 g/L 蛋白胨、1 g/L 酵母浸粉、15 g/L 琼脂、5 g/L山梨醇,pH 5.5±0.2。
1.2 仪器与设备
PHS-3C pH计,上海精密科学仪器有限公司;电子天平,上海民桥精密科学仪器有限公司;岛津QP 2010气相色谱-质谱联用仪,日本岛津公司;LDZX-40BⅠ型立式蒸汽灭菌器,上海申安医疗器械厂;XPX智能型生化培养箱,宁波江南仪器厂;高速冷冻离心机,德国Eppendorf公司;超净工作台,苏州净化设备有限公司;超声波振荡仪,昆山市淀山湖检测仪器厂。
1.3 方法
1.3.1 菌种的活化 取甘油保藏菌种,划线于YPD固体培养基上,于30℃的恒温培养箱中培养48 h,取一环平板活化的菌体于50 mL YPD液体培养基中,30℃,150 r/min恒温培养24 h后于4℃冰箱中保藏备用。
1.3.2 发酵方法及生长的测定 将活化好的酵母菌以同等比例混合接种于装有50 mL灭菌YPD液体培养基的锥形瓶中,并分别接种3种酵母菌作为纯培养对照,30℃、150 r/min恒温培养。混合培养及纯培养接种后培养液起始浓度均为2×105CFU/mL。
细胞数量测定采用平板计数法。在混合培养条件下,因酿酒酵母Sc和非酿酒酵母Pf生长形态一致,肉眼难以区分,而Sc在含山梨醇的培养基上不能正常生长,Pf可以正常生长,故采用含山梨醇的基本培养基进行选择计数。
1.3.3 挥发性风味物质的检测 固相微萃取:取3 mL发酵液样品于15mL顶空样品瓶中,将装有PDMS萃取头的SPME手动进样器的针头通过隔垫插入瓶中,推出纤维头,于50℃ 恒温吸附40 min,再移至20℃恒温水浴锅中平衡10 min,缩回纤维头,并迅速将萃取头插入气相色谱进样口进行分析。
GC 条件:色谱柱为 Vocol1.8 μm×60 m×0.32 mm,0.32 mm;柱温:起始温度 35℃,保持 3 min,然后以3℃/min升至40℃,保持1 min,再以5℃/min升至210℃,保持16 min;载气:氦气;流速:0.8 mL/min;进样口温度:210℃。
MS条件:电离方式为EI+,电子能量70 eV,接口温度210℃,离子源温度200℃,检测器电压0.8 kV;质谱扫描范围:30~650amu;检索谱库:WILEY和NIST谱库。
1.4 数据处理
所有试验平行进行3次,利用SAS 8.1软件进行统计分析,Mev 4.9.0进行热图归纳分析。
2 结果与分析
2.1 不同混合培养条件下酵母菌的生长变化
考察3种酵母菌纯培养及不同混合培养条件下生长曲线,结果如图1所示。
从图1可以看出,在发酵过程中,3种酵母菌均在12 h进入稳定期。纯培养时,Pf和Sc均在24 h达到最大成长量,分别为2.3×108CFU/mL和4.5×107CFU/mL,而Io在 20 h达到最大生长量1.0×108CFU/mL。在3种酵母混合培养体系,酵母生长量均未达到其纯培养时的生长量,这是由于混菌培养时三者相互竞争营养资源且相互抑制造成的[11]。非酿酒酵母Pf在竞争中处于优势地位,最大生长量为1.9×108CFU/mL,基本达到其纯培养时生长量。Io生长受到一定程度的抑制,为6.5×107CFU/mL。酿酒酵母Sc生长受到严重抑制,仅为6.8×106CFU/mL。以上说明在三者混合培养时,非酿酒酵母Pf生长最为良好,而其它两种酵母均受到不同程度的抑制。据研究报道,毕赤酵母能耐受低pH、低水分活度、高渗透压、厌氧等极端环境,相比于酿酒酵母更能适应外界环境胁迫[12],且发酵过程中,非酿酒酵母产生的中长链脂肪酸、寡聚肽、乳酸、环化高级醇等可能会抑制其它菌种的生长[13],因此在混合培养竞争时处于优势地位。
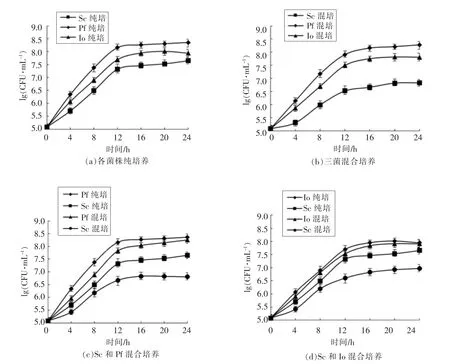
图1 不同混合培养方式的酵母菌生长动态变化Fig.1 Dynamic growth changes of yeasts by different culture
在两两混合培养体系中,非酿酒酵母均能良好生长,生长量和纯培养时基本一致。在Sc和Pf混合体系中,Pf最大为 1.8×108CFU/mL,Sc 仅为6.4×106CFU/mL。 在 Sc和 Io混合时,Io最大为8.2×107CFU/mL,Sc 为 9.3×106CFU/mL。 可以看出,Pf对酿酒酵母Sc的抑制程度更高,一些研究证明非酿酒酵母在发酵初期会产生一些有毒化合物,类似糖蛋白、多肽、小分子质量的信号分子等会抑制酿酒酵母的生长[14]。在后续试验中,非酿酒酵母生长量不断降低,逐渐被酒精耐受能力较高的酿酒酵母所取代,这可能是由于环境中酒精浓度升高,有机酸积累等导致的非酿酒酵母的衰亡[15]。
2.2 不同培养方式下挥发性风味物质成分分析
香气作为果酒品质最重要的特征之一,代表多种挥发性物质的总和,混菌发酵能够产生、增强一些有益风味化合物如乙酸苯乙酯等,降解某些异味物质如乙醛等,最终改变发酵产物的风味特征[16]。对3种酵母分别纯培养、两两混合培养及三者混合培养,取稳定期发酵液,处理后用气相色谱法分析挥发性风味物质成分。将得到的色谱及质谱图与WILEY和NIST检索谱库分析比对,采用面积归一化法计算各成分的相对含量,结果见表1。作代谢热图分析见图2。
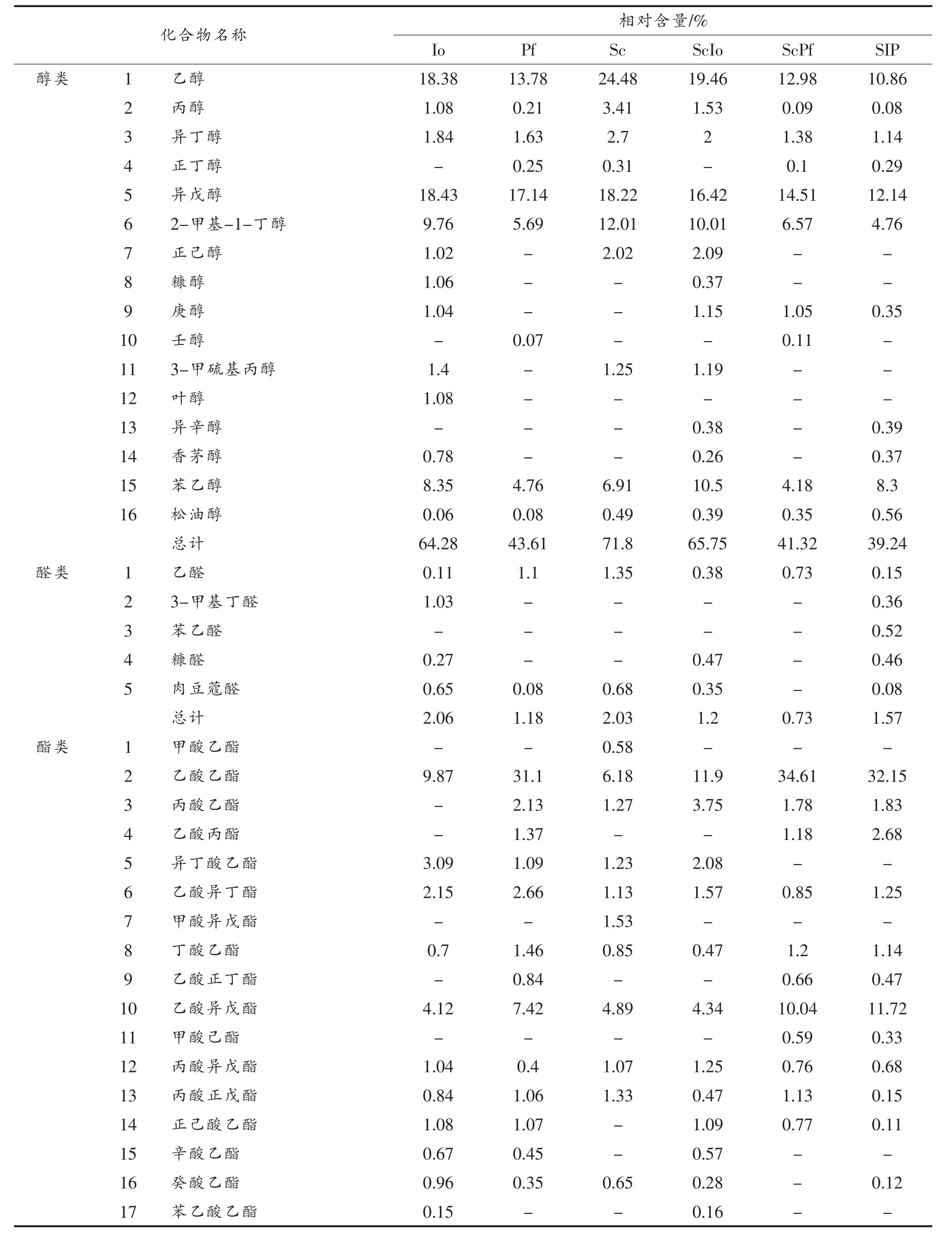
表1 不同培养方式的挥发性风味物质成分分析Table1 Volatile flavor components by different culture methods
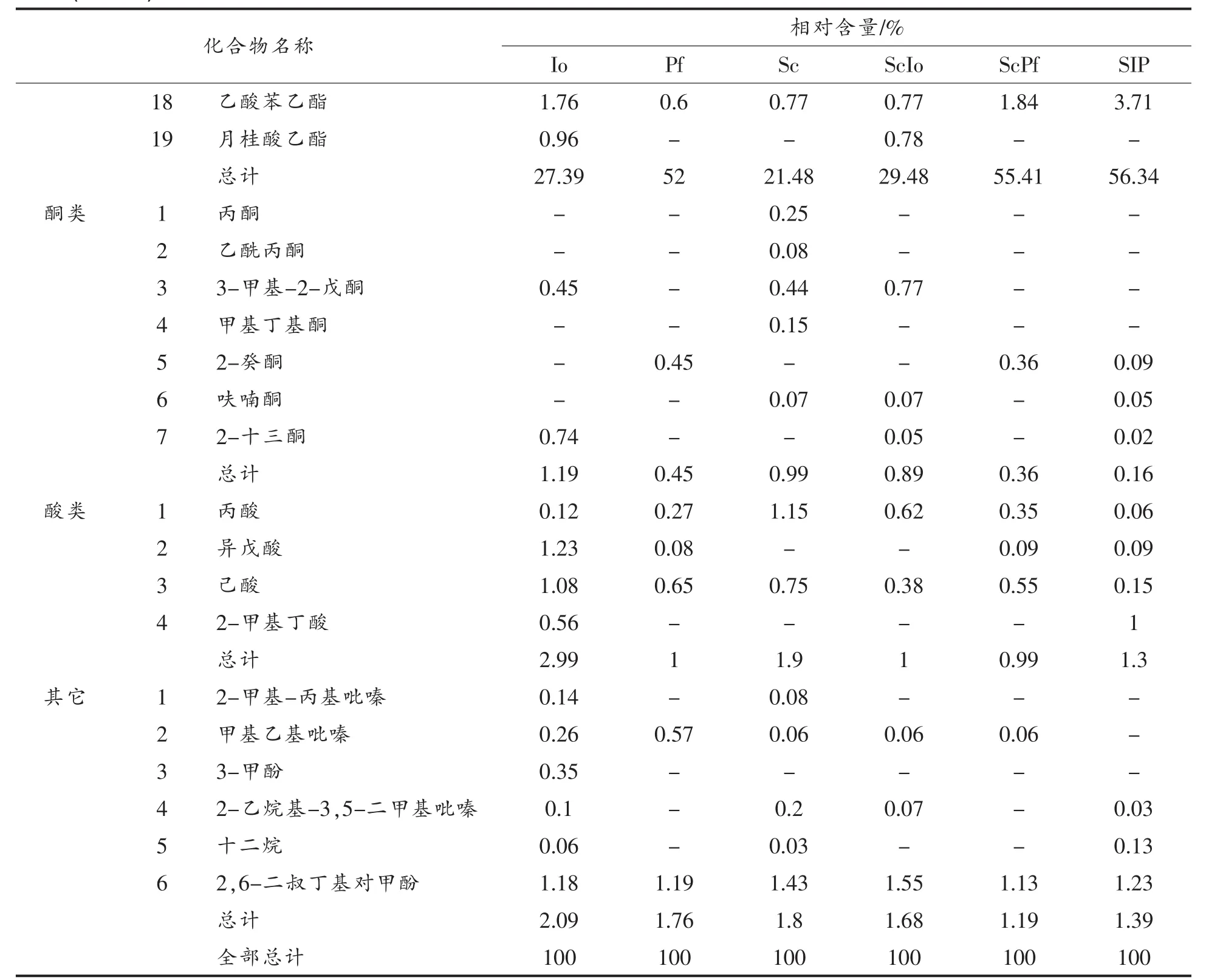
(续表1)
由表1、图2可以看出,不同培养方式所产生的挥发性成分数目及含量有所不同,共检测出57种挥发性物质成分,其中醇类16种,醛类5种,酯类19种,酮类7种,酸类4种,其它成分6种。其中22种是共有的香味物质,6种为酿酒酵母Sc所独有,11种为非酿酒酵母Io所独有,4种为非酿酒酵母Pf所独有。
在两两混合培养体系中,Io与Sc混合培养和Io纯培养体系挥发性物质成分相似度较高,Pf与Sc混合培养和Pf纯培养体系挥发性物质成分相似度较高,推测可能是由于Io和Pf对Sc产生抑制,这与前期试验结果相符。在挥发性风味物质检测中,含量比例占最高的是醇类和酯类,分别检测到16种和19种。其中酿酒酵母Sc所产生的醇类最多,醇作为酵母代谢产生的主要代谢产物[17],达71.80%;非酿酒酵母Io为64.28%,Pf为43.61%,说明酿酒酵母较非酿酒酵母代谢产生的醇类物质能力强,3种酵母产生醇类含量最多的均为乙醇、异戊醇、2-甲基-1-丁醇和苯乙醇,苯乙醇具有花香,且具有一定的杀菌能力,会发出诱人且香甜的茉莉花香,有柔和愉悦的感受[18]。有研究表明,少量高级醇能赋予果酒特殊的香气,同时也是其它香气物质的良好溶剂,它们的嗅觉阈值一般很低,香气值较高,对风味组成具有重要作用[19]。挥发性酯类作为香气化合物的重要组成,赋予果酒特殊的水果香气,对果酒风味贡献最大,在酯类物质检测中,单独培养时,非酿酒酵母Pf可产生大量的乙酸乙酯,占31.1%,有浓郁的菠萝香气[20]。Pf和Sc混合培养时,乙酸乙酯含量有所升高,占34.61%,乙酸异戊酯相对含量由7.42%升为10.04%,具有一定的香蕉香气[21]。两两混合培养时,产生的酯类物质整体上较纯培养时多,可见混合发酵可丰富酒体的酯类物质风味,例如产生具有清甜苹果香气的甲酸乙酯及杏仁香的乙酸苯甲酯等[22]。此外,混合培养时,酸类和酮类的也发生一些变化,其种类和相对含量与单独培养时有所不同,酸类和酮类均为烷烃类有机化合物氧化的最终产物,属于果酒中典型的呈味物质,特别是乙酰丙酮、呋喃酮对果酒风味贡献较高[23]。在醛类物质检测中,不同培养方式的乙醛都占有很高比例,其对香气起着重要作用,同时,乙醛也是乙酸、乙偶姻合乙醇的合成前体,低含量的乙醛就能起到很好的媒介功能[24]。

图2 不同培养方式的挥发性风味物质代谢热图Fig.2 H-Clustering-Heat Map of volatile flavor components by different culture methods
将3种酵母作混合培养处理时,可以看出醇类相对含量有所下降,占41.32%,均低于单独及两两培养时的醇类含量,推测产醇类的酿酒酵母可能受到明显抑制。酯类相对含量显著增加,达56.34%,其中含量最高的是乙酸乙酯、乙酸异戊酯、乙酸苯乙酯和乙酸丙酯,分别为32.15%,11.72%,3.71%和2.68%,含量均高于纯培养或两两混合培养,说明3种酵母混合可大大增强果酒发酵的特殊风味。此外,在培养过程中,也发现酚类、吡嗪及含硫化合物,这些物质的阈值很低,具有强烈的芬芳,例如甲基乙基吡嗪、3-甲酚等产生的泥土味、金属味等特殊气味共同构成果酒发酵独特的风味[25]。
3 结论
比较酿酒酵母Sc和非酿酒酵母Pf、Io纯培养及混合培养时的生长差异,结果表明,两两混合培养时,非酿酒酵母均能良好生长,生长量和纯培养基本一致,而酿酒酵母Sc受到不同程度的抑制,且Pf对酿酒酵母的抑制程度更高;三者混合培养时,由于相互竞争营养资源且相互抑制,所以3种酵母均未达到其纯培养时生长量,非酿酒酵母Pf在竞争中处于优势地位,Io生长受到抑制,酿酒酵母Sc受抑制程度严重。
从不同混合方式发酵的菌种中共检测到57种挥发性物质成分,其中醇类16种、醛类5种、酯类19种、酮类7种、酸类4种和其它6种,有22种是共有的香味物质,6种为酿酒酵母Sc所独有,11种为非酿酒酵母Io所独有,4种为非酿酒酵母Pf所独有。Io与Sc混合培养和Io纯培养相比挥发性物质成分相似度较高,Pf与Sc混合培养和Pf纯培养相比挥发性物质成分相似度较高,相对含量比例最高的是醇类和酯类,酿酒酵母Sc产生的醇类最高达71.80%,非酿酒酵母Io为64.28%,Pf为43.61%。3种酵母产生醇类含量最多的依次为乙醇、异戊醇、2-甲基-1-丁醇和苯乙醇,酯类物质中乙酸乙酯和乙酸异戊酯含量最高,提供果酒特殊风味。3种酵母混合培养时醇类相对含量有所下降,占41.32%,均低于单独及两菌混合培养时的醇类含量,而酯类相对含量显著增加,达56.34%,其中含量最高的是乙酸乙酯(32.15%)、乙酸异戊酯(11.72%)、乙酸苯乙酯(3.71%)和乙酸丙酯(2.68%),均高于纯培养或两菌混合培养,说明3种酵母菌混合培养可大大增强果酒发酵的特殊风味。此外,也发现酚类、吡嗪及含硫化合物共同构成果酒发酵独特的风味。

