黑曲霉M00988菌株来源的降解赭曲霉毒素A羧肽酶基因的原核表达及其固定化
熊 科 支慧伟 王小艺 赵峙尧 柳佳芸 裴鹏刚 邓 蕾 李秀婷
(1北京工商大学 北京食品营养与人类健康高精尖创新中心 北京 100048
2北京工商大学 北京市食品添加剂工程技术研究中心 北京 100048
3北京工商大学 北京市风味化学重点实验室 北京 100048
4北京工商大学 北京市质量与安全重点实验室 北京 100048)
赭曲霉毒素是一类由曲霉和青霉等丝状产毒真菌产生的次级代谢产物,其中赭曲霉毒素A(Ochratoxins,OTA)的毒性最强,主要污染谷物、咖啡豆、坚果、可可、葡萄及相关产品[1]。经食品法典委员会认定,OTA污染最为严重的食品类别依次为谷类>葡萄及其制品>咖啡豆及其制品>其它[2]。动物试验表明:OTA的主要靶器官为肾脏和肝脏,具有致癌、致畸和致突变性。降低或脱除食品及其原料中的OTA含量对保障食品安全意义重大[3-7]。传统降解OTA的方法主要是物理化学方法,该方法存在二次污染和解毒不彻底等问题,在食品行业中的应用受较大局限。而生物脱毒法不破坏产品的营养价值,具有脱毒高效、特异性强等优点,受到越来越多研究者的关注,具有广阔的应用前景[8-9]。
生物脱毒法,主要包括生物的物理吸附和降解。由于生物吸附的可逆性,因此生物降解才是最彻底的脱毒方法。目前研究较多的生物降解的微生物菌株主要有黑曲霉 (Aspergillus niger)[10]、芽孢杆菌(Bacillus spp.)[11]、乳酸菌(Lactic acidbacteria)[12]、红发夫酵母(Phaffia rhodozyma)[13]等。 这些微生物菌株均能脱除OTA,其脱毒机制有待进一步研究。也有研究表明,部分蛋白酶也存在降解OTA的作用,其中来源于牛胰脏的羧肽酶(CP;EC.3.4.17.1)是研究最早的OTA 降解酶[14]。现在许多研究将CP作为筛选OTA降解菌株的对照酶。如Luis Abrunhosa[15]在筛选降解OTA的黑曲霉时便采用CP作为菌株筛选的对照。
CP是一类能水解蛋白质和多肽底物C端芳香族或中性脂肪族氨基酸残基释放C端氨基酸的酶,它的活性与锌离子有关。动物来源的羧肽酶的数量非常有限且价格昂贵,导致其应用受到限制;而微生物来源的羧肽酶具有广阔的应用前景。借助基因工程策略,采用微生物为宿主大量生产重组羧肽酶,有望克服羧肽酶生产过程所遇到的动、植物原料来源受限等问题,进一步降低生产成本,提高产品质量,扩展其应用范围。然而,天然羧肽酶稳定性差,易失活,不能重复使用,反应后混入产品,纯化困难,使其难以在工业中更为广泛的应用。此外,分离和提纯酶以及它们的一次性使用又大大增加了其作为催化剂的成本。固定化羧肽酶是实现其在食品领域应用的研究重点。目前羧肽酶的固定化研究除了传统的固定化方法外,主要集中在定点固定化方面[16]。这种固定化酶的成本较高,不适宜应用于食品加工领域;而传统的固定化方法又存在酶活性差,固定化程度弱等问题。本研究在传统固定化方法的基础上采用复合固定化[17]方法对异源表达的羧肽酶进行吸附-交联复合固定化,以期对固定化的羧肽酶在食品领域的应用提供理论基础。
1 材料与方法
1.1 材料
1.1.1 菌株及主要试剂 M00988菌株、OTA标品,Pribolab 生物工程有限公司;BL21(DE3)感受态细胞、DH5α感受态细胞,天根生化科技有限公司;真菌基因组提取试剂盒、质粒提取试剂盒、胶回收试剂盒,OMEGA生物技术有限公司;S-8、AB-8、D4020、D201GF、D152 大孔树脂,勤实科技有限公司;LA Taq酶,Takara生物工程有限公司;Nco1、Not1、T4连接酶,NEB生物工程有限公司。
1.1.2 主要仪器、设备 PCR仪,Biolab有限公司;高效液相色谱,Agilent有限公司;凝胶成像仪,GE有限公司;傅里叶变换红外光谱,Thermo有限公司;低温冷冻离心机,Beckman有限公司。
1.2 方法
1.2.1 构建重组质粒pET28a-cp 采用基因组提取试剂盒获得菌株M00988基因组,依据NCBI数据库中同源菌株设计引物:
Otase-F:gggAATTCATggTCCgCCgCCgAATTg
Otase-R:AAgCgggCgCCAgAAAAggATTACgTg
通过PCR获得全长片段,PCR反应体系:选择 LA Taq酶,94℃预变性 5 min,94℃ 30 s,50℃1 min,72℃ 1 min,循环 30次,72℃ 10 min。 由PCR获得羧肽酶全长基因(cp),经1%琼脂糖凝胶电泳纯化后连接PMD18-T,热激导入DH5α感受态细胞进行蓝白斑筛选,并测序分析。在经测序验证的cp两端引入Nco1和Not1的酶切位点,双酶切cp及载体pET28a。酶切产物经胶回收试剂盒纯化后接体构建重组质粒pET28a-cp。
1.2.2 解毒能力测定 构建1 mL反应体系:OTA终质量浓度为 1 μg/mL,加入 50 μL 重组酶,其余用pH 7.5的磷酸盐缓冲液补齐。将反应体系在37℃下保温1 h,采用Bradford蛋白浓度测定试剂盒检测重组酶蛋白浓度,计算脱毒能力(式1)。
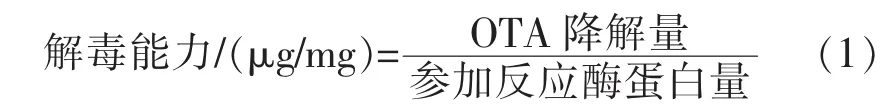
OTA采用高效液相色谱测定,反应体系与70%甲醇水溶液 1∶1(V∶V)混合,过 0.22 μm 有机滤膜后完成样品制备。HPLC测定OTA条件:进样量 20 μL,流量 0.5 mL/min,流动相 V乙腈∶V水∶V乙酸=99∶99∶2,荧光检测器激发波长 333 nm,发射波长460 nm。
1.2.3 重组羧肽酶的表达及诱导条件优化 将连接体系导入BL21(DE3)感受态细胞中,整理克隆子。将克隆子挑入kan抗性LB培养基中富集,待菌体浓度到达0.6~0.8时加入IPTG低温诱导18 h。将菌液离心,去除培养基,加入pH7.5的磷酸盐缓冲液进行超声破壁,获得粗酶液。对粗酶液进行脱毒试验,测定OTA降解率(式2),确定重组酶活性。之后对IPTG浓度、诱导时机、诱导时间及诱导温度进行优化:分别选择 0.25,0.375,0.50,0.635,0.75 mmol/L作为IPTG终浓度,分别选择16,20,24,28 ℃作为诱导温度,分别选择 12,16,20,24,28 h作为诱导时间,测定生长曲线确定诱导条件。
构建1 mL粗酶液测定体系:OTA终质量浓度为 1 μg/mL,加入 100 μL 粗酶液,其余用pH 7.5的磷酸盐缓冲液补齐。将反应体系在37℃下保温4 h,HPLC测定 OTA浓度,确定 OTA降解率(式2)。
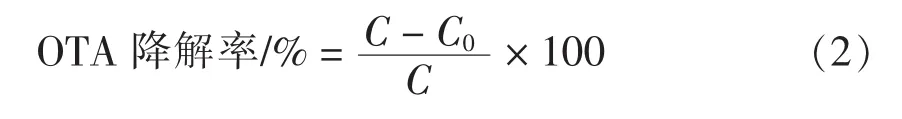
式中:C——初始OTA的质量浓度(μg/mL);C0——脱毒反应后样品中OTA的质量浓度(μg/mL)。
1.2.4 重组羧肽酶的纯化 利用Pet28a载体上携带的His+标签,采用镍柱亲和层析,pH7.5的磷酸盐为平衡缓冲液,加入高咪唑浓度洗脱,得到电泳纯的重组羧肽酶。
1.2.5 重组酶的固定化研究
1.2.5.1 固定化载体及活化方式的选择 选择5种具有代表性的大孔树脂分别经过酸碱浸泡和乙醇活化[18],选择 100 μL 上样量,37℃、180 r/min 吸附8 h,0.25%戊二醛37℃交联4 h为初始固定化条件,测定酶活回收率(式3)作为验证指标。


表1 大孔树脂种类Table1 The species of macroporous resin
1.2.5.2 固定化条件的优化 对吸附温度(20,25,30,35,40,45 ℃)、 吸附时间(3,6,9,12,15,18 h)、戊二醛质量分数(0.05,0.15,0.25,0.35,0.45,0.55%)、交联时间(1,2,3,4,5,6 h)、交联温度(4,16,25,37℃)进行单因素试验设计,确定最终固定化条件。
1.2.5.3 固定化酶动力学参数测定 将重组酶与固定化酶分别置于不同OTA浓度下反应并测定解毒能力。 根据米氏方程 V=Vmax×[S]/(Km+[S]),用双倒数法作图,即以酶促反应的倒数1/V对底物浓度的倒数1/[S]作一直线,根据其斜率及截距求Km及Vmax,在1.2.4节条件下测定解毒能力。
1.2.5.4 固定化酶结构的初步探究 采用红外色谱测定重组酶和固定化酶的二级结构,同时用SWISS-MODEL在线模拟羧肽酶三维结构,初步探索固定化后重组酶二级结构的变化。
2 结果与分析
2.1 重组质粒pET28a-cp的构建
采用引物Otase-F和Otase-R进行扩增,泳道1、2中为cp基因约1 500 bp左右的片段 (图1a)。测序(华大测序公司)后,与NCBI上的模式片段进行比对,确定其氨基酸组成一致。比对质粒和基因片段,选择Not1和Nco1两种限制性内切酶,设计引物在片段两端连接酶切位点并进行双酶切,构建pET28a-cp重组质粒(图1b)。
2.2 羧肽酶全长生物信息学分析
羧肽酶基因cp全长1 443 bp,GC含量53.85%,序列中无内含子,编码481aa,软件预测编码的蛋白质分子质量为51.1 ku,等电点PI=6.24。经信号肽预测,确定此序列无信号肽,如图2所示。
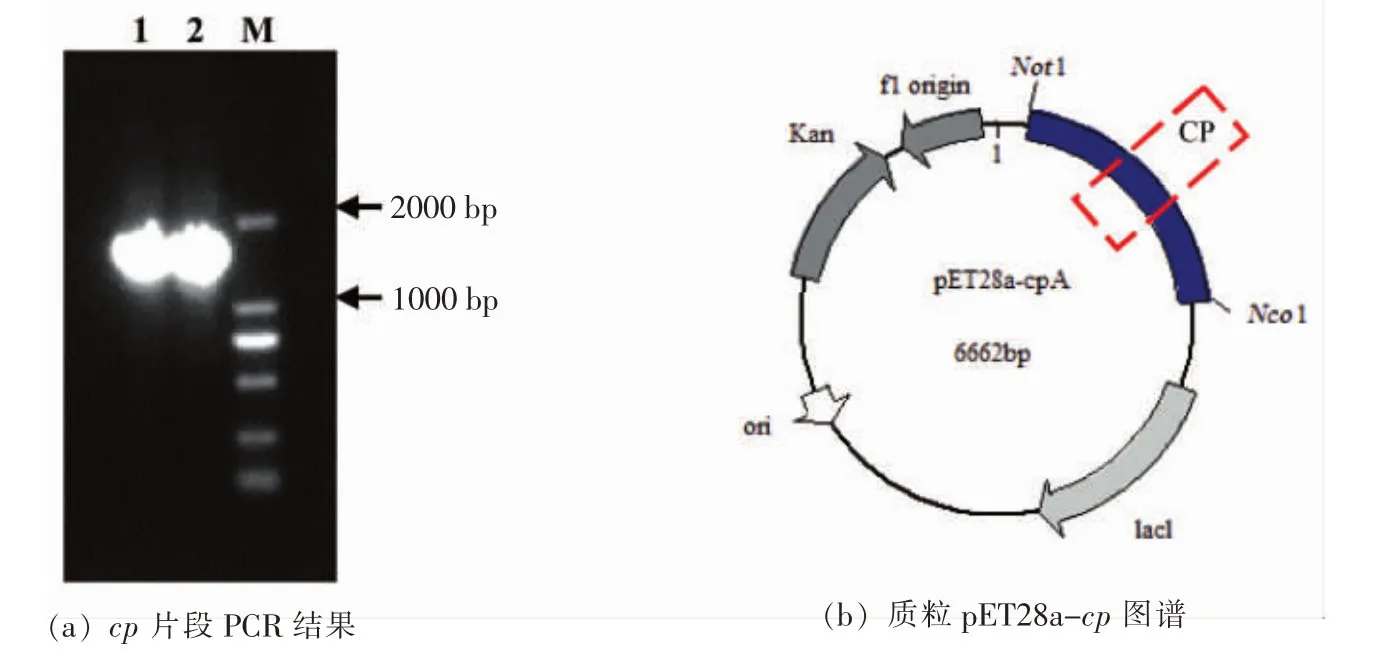
图1 质粒pET28a-cp的构建Fig.1 Construction of plasmid pET28a-cp

图2 cp氨基酸序列Fig.2 The sequence of cp amino acid
将cp的氨基酸序列在信号肽的在线分析网站 http://www.cbs.dtu.dk/services/SignalP 分析,结果如图3所示,该段基因无信号肽,可直接进行原核表达。
经PSIPRED预测氨基酸序列二级结构如图4所示,蓝色信号强弱为置信度,该序列共有14个α螺旋,14个β片层结构,α螺旋与β片层结构交替出现。
2.3 重组羧肽酶的表达及条件优化
2.3.1 重组羧肽酶的表达 将重组片段导入BL21(DE3)感受态细胞后,进行初步诱导,超声破壁获得粗酶液,脱毒反应确定OTA降解率为56%。
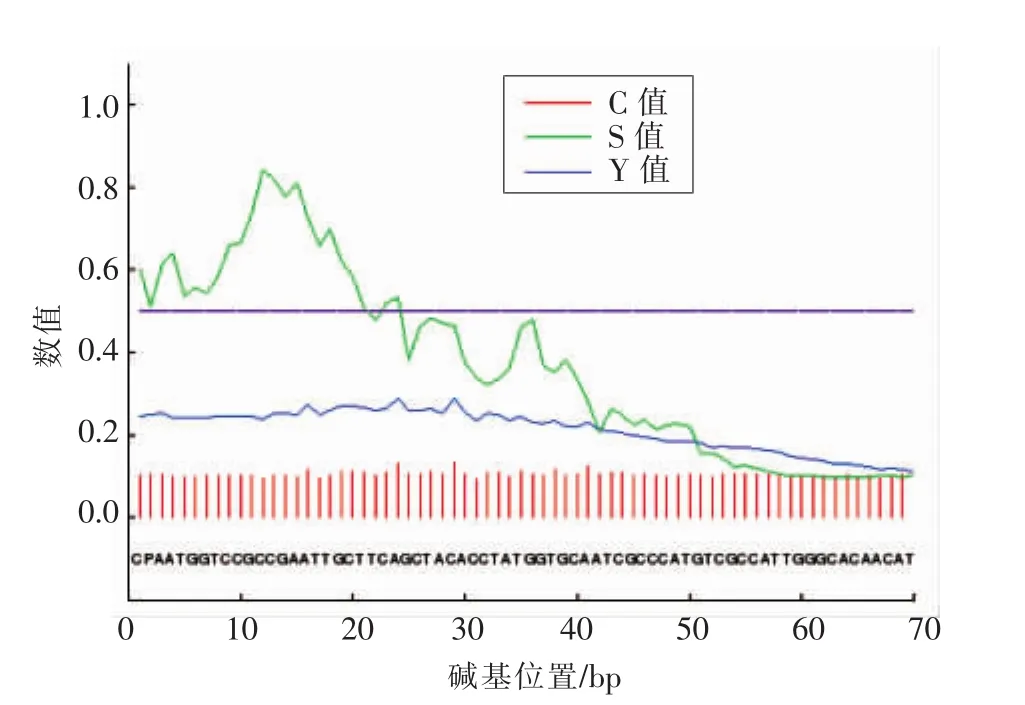
图3 cp序列信号肽分析Fig.3 The analysis of signal peptide from cp sequence

图4 cp二级结构图Fig.4 Secondary structure of cp
2.3.2 诱导条件优化 经过单因素优化,图5所示,通过对生长曲线的测定发现,重组大肠杆菌在1~5 h间处于对数生长期,0~1 h处于调整期,约5 h后进入稳定期。由《分子生物克隆指南》[19]可知,菌体处于对数中期为最佳诱导时期。研究表明:在菌体OD600值0.6~0.8时菌体处于对数中期,诱导效果最佳,因此选取培养2.5 h作为添加IPTG的诱导时机。在最佳诱导时机时加入IPTG,当IPTG浓度为1.0 mmol/L时,原核表达的羧肽酶酶活较高,达49.2%;当诱导温度28℃时,原核表达的羧肽酶的脱毒效率约50%;当诱导时间为20 h时,重组羧肽酶解毒效率最高,达97.1%。
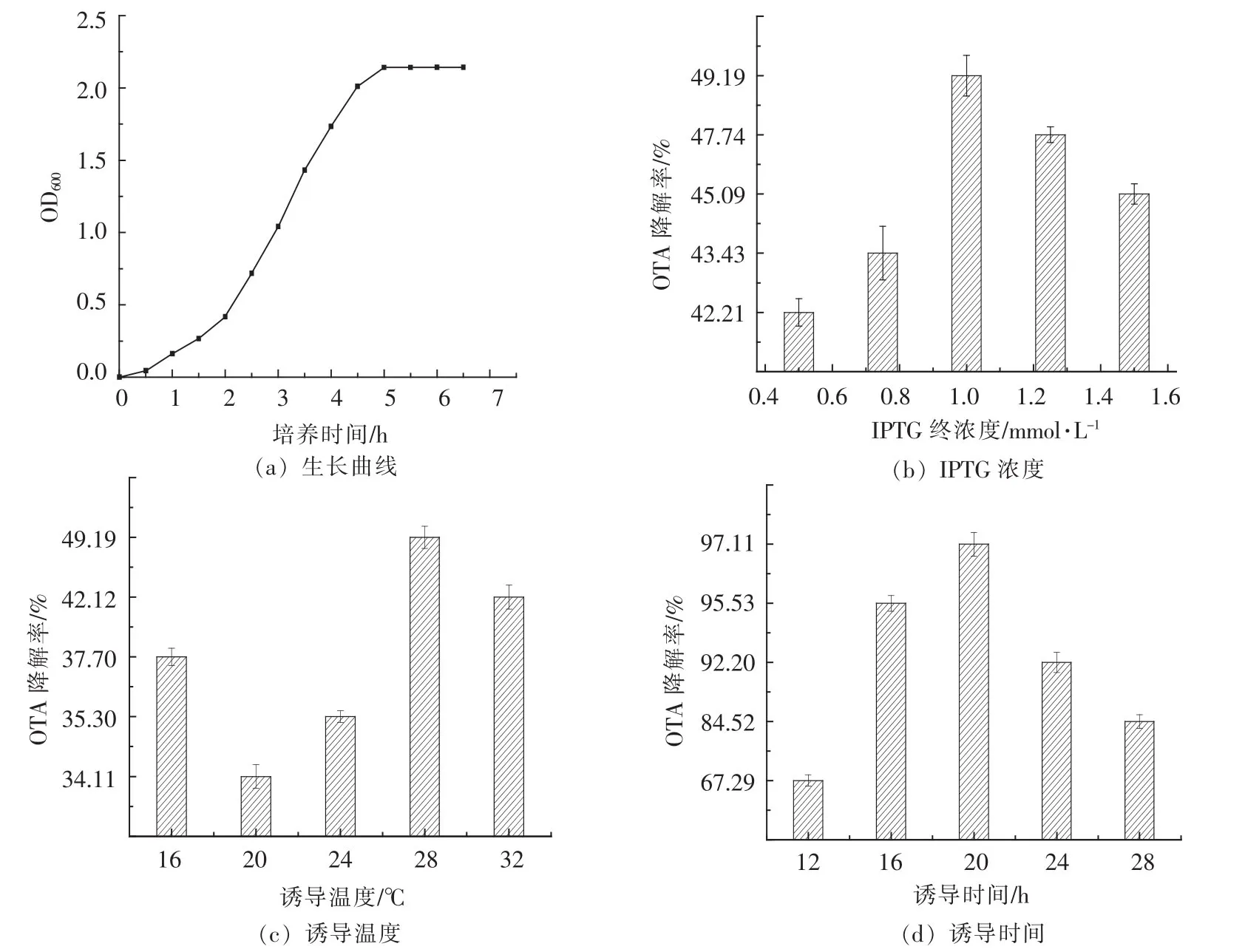
图5 原核表达条件优化结果Fig.5 Prokaryotic expression condition
综上所述,最终优化的最优表达条件为培养2.5 h开始诱导,加入IPTG终浓度1.0 mmol/L,诱导温度28℃,诱导时间20 h。条件优化后重组羧肽酶降解OTA底物色谱图如图6所示,OTA目标峰在保留时间27min左右出峰。主要的酶降解产物OTα保留时间为10.5 min,试验表明,OTα的毒性明显小于OTA的毒性作用,相对比较安全[20]。
2.4 重组羧肽酶的纯化
粗酶液经镍柱纯化,SDS-PAGE检测,得到电泳纯的重组羧肽酶(图7),酶分子约51 ku,与预测分子质量基本一致。纯化结果如表2所示。羧肽酶的解毒效果由解毒能力(μg/mg)来表示,即每μg重组酶降解OTA的能力。
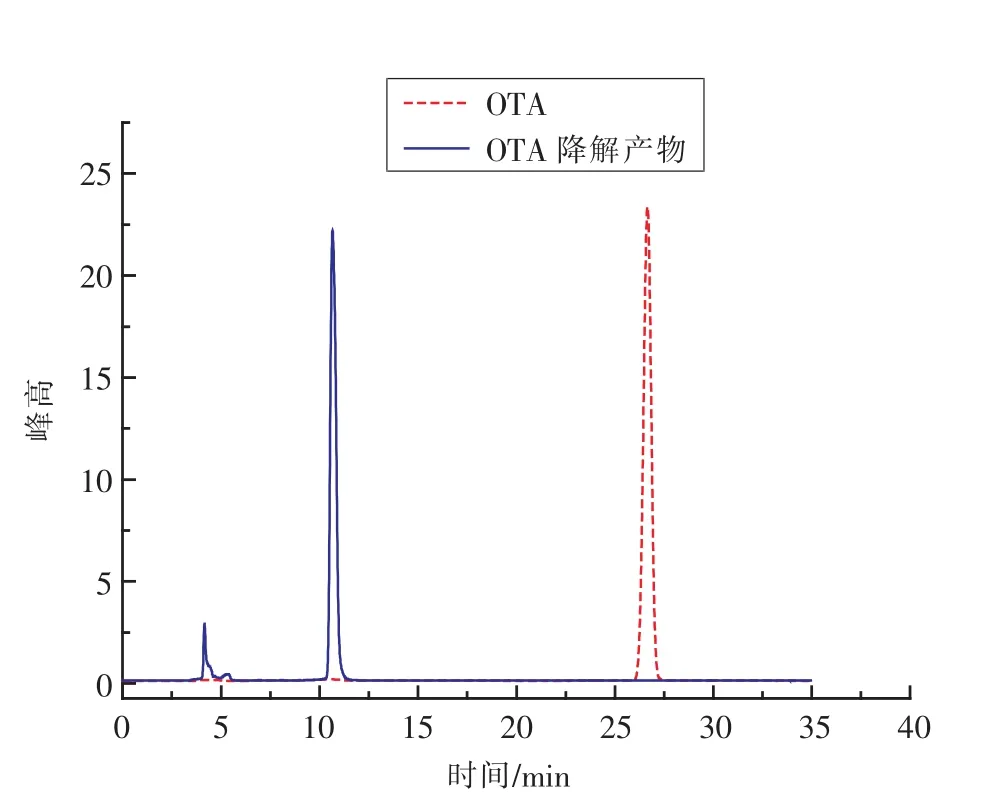
图6 高效液相色谱谱图Fig.6 High performance liquid chromatogram
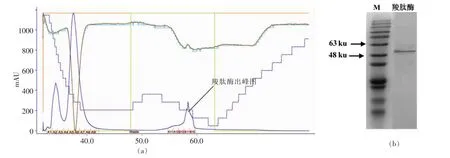
图7 重组羧肽酶纯化图(a)及SDS-PAGE电泳图(b)Fig.7 Purification system diagram (a) and SDS-PAGE electrophoresis figure (b)of recombinant carboxypeptidase AKTA

表2 原核表达重组羧肽酶的纯化结果Table2 Purification results of recombinant carboxypeptidase for prokaryotic expression
2.5 重组羧肽酶的固定化
2.5.1 固定化载体的选择及固定化条件的优化固定化酶的固定效果由酶活回收率来表示。由图8可知,5种大孔树脂中,经酒精活化的AB-8树脂吸附酶蛋白的酶活回收率较高,选择AB-8树脂作为吸附载体。其中交联时间和交联温度对固定化效果的影响较小,考虑到实际操作中的方便性和节约性,选择交联时间1 h、交联温度为室温25℃,其余条件对固定化效果影响较显著,选择吸附温度35℃、吸附时间12 h、戊二醛含量0.35%。
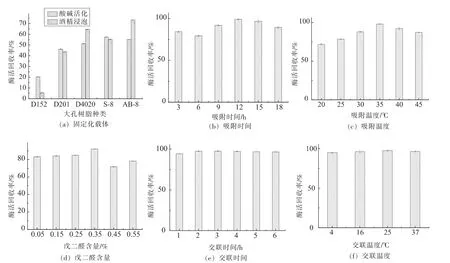
图8 羧肽酶固定化条件优化结果Fig.8 Optimization results of immobilized carboxypeptidase
2.5.2 固定化酶动力学参数变化 采用双倒数法作图,根据斜率与截距计算动力学参数,结果为:重组酶 Km值为 0.67 μg/mL,Vmax为 111.1 μg/mg,Kcat值为18.52,该酶催化效率为27.64;固定化酶Km值为 11.50 μg/mL,Vmax为 97.09 μg/mg,Kcat值为324,固定化后酶的催化效率为28.17。由上述结果可看出,重组酶经固定化后,酶对底物的亲和力有所下降,而酶促反应的Vmax并没有显著下降,固定化酶的催化效率没有降低,表明对异源表达的羧肽酶进行吸附-交联复合固定化效果良好。
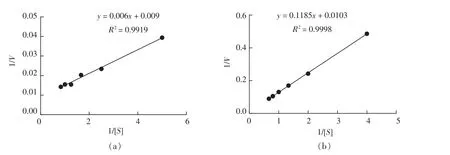
图9 重组酶(a)及固定化酶(b)双倒数测定动力学参数Fig.9 Kinetic parameters of double enzyme-linked immunosorbent assay (a) enzyme and (b) immobilized enzyme
2.5.3 固定化对重组酶结构的影响 将纯化的重组羧肽酶经红外光谱分析检测得到图11,1 600~1 700 cm-1为与蛋白质二级结构密切相关的酰胺Ⅰ区,它是由肽骨架范围内C=O伸缩振动所引起[21]。经曲线拟合后得到重组酶二级结构为α螺旋10.68%,β折叠40.68%,β转角27.76%,无规则卷曲20.88%。经固定化后,α螺旋17.51%,β折叠26.67%,β转角29.93%,无规则卷曲25.89%。羧肽酶经固定化后,α螺旋和无规则卷曲的含量有所上升,β折叠下降幅度较大,β转角的百分含量变化不明显。蛋白质常见的二级结构主要有α-螺旋和β-折叠。其二级结构是通过骨架上的羰基和酰胺基团之间形成的氢键维持的,氢键是稳定二级结构的主要作用力。与在线模拟的三维结构 (图11)对比后,推测羧肽酶二级结构中部分相邻肽键酰胺氢羰基氧间形成的链内氢键部分断裂后,转变成为无规则结构,同时部分β折叠的肽键酰胺氢与羰基氧间形成的链内氢键在固定化过程中断裂,重新与其它不同位置的羰基氧与酰胺氢形成新的链内氢键,导致酶二级结构中原来的β折叠部分转变为α螺旋结构[22]。模拟图中位于N端虚线框内的β片层结构较为集中,当氢键断裂后,片层结构发生改变,可能导致酶对底物的亲和能力较之前有所下降[23]。
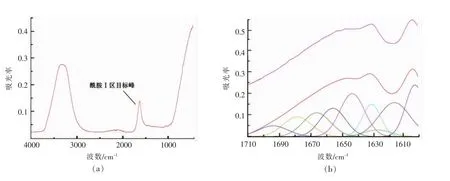
图10 傅里叶红外检测(a)重组羧肽酶出峰及(b)固定化酶拟合结果图Fig.10 Fourier transform infrared detection of (a) recombinant carboxypeptidase peak and the curve fitting results of(b) immobilized enzyme
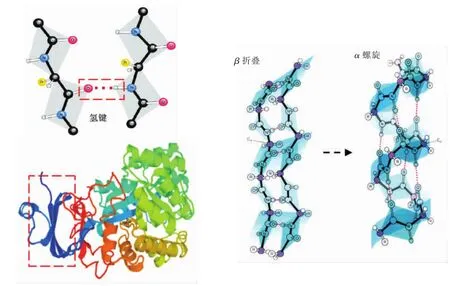
图11 固定化后羧肽酶结构变化模拟图Fig.11 Simulated diagram of structural transformation of carboxypeptidase after immobilization
3 结论
黑曲霉源羧肽酶经过原核表达,解决了天然酶酶量低且不易纯化的缺点,并且诱导条件优化后重组粗酶液的OTA降解率由50%提高至97.11%,效果显著。重组羧肽酶的固定化条件优化后,选择AB-8大孔树脂作为吸附载体,0.35%的戊二醛为交联剂,酶活回收率在85%以上。通过对酶促反应动力学参数以及蛋白质二级结构变化的研究,初步推断吸附-交联固定化对羧肽酶结构的影响:酶经固定化后,部分β折叠链内氢键断裂,转变成为无规则结构或α螺旋结构,导致固定化酶对底物的亲和力较之前有所下降,而其Vmax与游离态酶基本保持一致,因此固定化酶与游离态酶的催化效率基本一致。

