液基薄层细胞检查联合HPV-DNA分型检测在宫颈癌筛查中的价值对比
林兵英 罗晓燕 方周宾 朱 岩
1.南方医科大学附属深圳市妇幼保健院检验科,广东深圳 518028;2.深圳市第二人民医院检验科,广东深圳 518035
目前我国宫颈癌筛查尚处于较低水平,2010年全国城市宫颈癌平均筛查率仅为29.1%,东部发达地区为31.3%,宫颈癌的防治形势较为严峻[1-2]。已经证实[3],人乳头状瘤病毒(human papilloma virus,HPV)感染与宫颈癌的发病具有直接关系,其中以高危型HPV16/HPV18 型居多。HPV-DNA 检测已逐渐成为宫颈癌筛查的一项重要手段,但受到检查方式、取材纯净度、检测仪器等多种因素制约,临床上假阳性、假阴性率居高不下。近年来薄层液基细胞学(thinprep cytologic test,TCT)检查获得了临床医生的认可,也是国际上一种较为先进的宫颈癌筛查细胞学检查技术[4-5];但也有报道指出[6],TCT 检测容易出现诊断不足或过度诊断的情况。本研究通过分析我院2017 年6 ~12 月进行宫颈癌筛查的130 例患者情况,现报道如下。
1 资料与方法
1.1 一般资料
纳入2017 年6 ~12 月在我院进行宫颈癌筛查的患者130 例,年龄24 ~45 岁,平均(31.3±6.7)岁,纳入标准:均存在宫颈癌高危因素(早婚早育65 例,既往流产史37 例,存在性病或不洁性生活史18 例,宫颈癌家族史10 例);其中已婚93 例,未婚37 例;患者自愿参与本研究并签署知情同意书;排除标准:患者近3 个月服用激素或非甾体类抗炎药者;患有子宫肌瘤、卵巢囊肿者;月经不规律者。本研究上报医院伦理委员会并获得批准。
1.2 研究方法
1.2.1 TCT 检测 所有患者均于月经干净后第3 天进行TCT 检测,将细胞刷置于宫颈管内,到达宫颈外口上方1cm 左右,旋转细胞刷1 周后取出,立即刮取细胞洗脱于细胞保存液中,2 ~8℃待检;采用液基薄层细胞制片机制直径2cm 薄层细胞涂片,经95%乙醇固定,巴氏染色,风干后在OlympusCX-31 显微镜下阅片。
1.2.2 HPV-DNA 检测 用无菌棉拭子在患者宫颈口内用力旋转3 ~5 周后将脱落细胞置于保存液中,取混匀的待测样品2000r/min 后弃上层液后加入阳性质控品200μL,加入缓冲液,摇匀后置于100℃水中15min,离心后取5μL 作为PCR 扩增模板,扩增后在预热好的Lumin200 多功能流式点阵仪上检测。人乳头状瘤病毒核酸检测试剂盒由上海天景生命科技有限公司提供。
1.2.3 阴道镜活检 患者取截石位,消毒后于宫颈涂体积分数3%的冰醋酸及体积分数1%的碘溶液,采用电子阴道镜(深圳金科威电子科技设备有限公司)成像系统在醋酸白上皮区及碘试验不染色区取材;若无明显病变则在宫颈3、6、9、12 点取宫颈组织活检;取材后用体积分数10%的甲醛溶液固定后进行病理检查。
1.3 判定标准
1.3.1 TCT 判定标准 TCT 细胞学判定标准采用国际癌症协会推荐的2001TBS 分级标准作为诊断标准[7],分为正常或炎症反应、意义不明的不典型鳞状细胞(atypical squamous cells,ASCUS)、低度鳞状上皮内病变(low-grade squamous intraepithelial lesions,LSIL)、高 度 鳞 状 上 皮 内 病 变(height of squamous intraepithelial lesion,HSIL)、鳞状细胞癌(squamous cell carcinoma,SCC);将细胞学检查结果为ASCUS、LSIL、HSIL、SCC 作为阳性结果。
1.3.2 HPV-DNA 判定标准 严格按照说明书检测HPV-DNA 含 量,将HPV-DNA ≥1pg/mL 作 为阳性结果;将HPV16/18/26/31/33/35/39/45/51/52/53/56/58/59/66/68/73/82 亚型作为HPV 高危型,将HPV6/11/42/43/44/84 亚型作为低危型。
1.3.3 病理诊断分型 根据WTO 制定的《乳腺与生殖系统肿瘤病理与遗传学》2006 版标准[8],将病理检查结果分为无上皮内瘤变和恶性变(NILM)、轻度不典型增生(CIN Ⅰ级)、中度不典型增生(CIN Ⅱ级)、重度不典型增生和原位癌(CIN Ⅲ级)、宫颈鳞状细胞癌(SCC),将CIN ≥Ⅰ级定义为阳性。
1.4 统计学处理
采用SPSS19.0 软件进行数据分析,计数资料以百分数表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 TCT、HPV-DNA检测与病理检查结果比较
以病理检查为金标准,TCT 检测符合率为61.54%(80/130),HPV-DNA 检 测 符 合 率为69.23%(90/130)比较,差异无统计学意义(χ2=1.699,P=0.192),见表1 ~3。
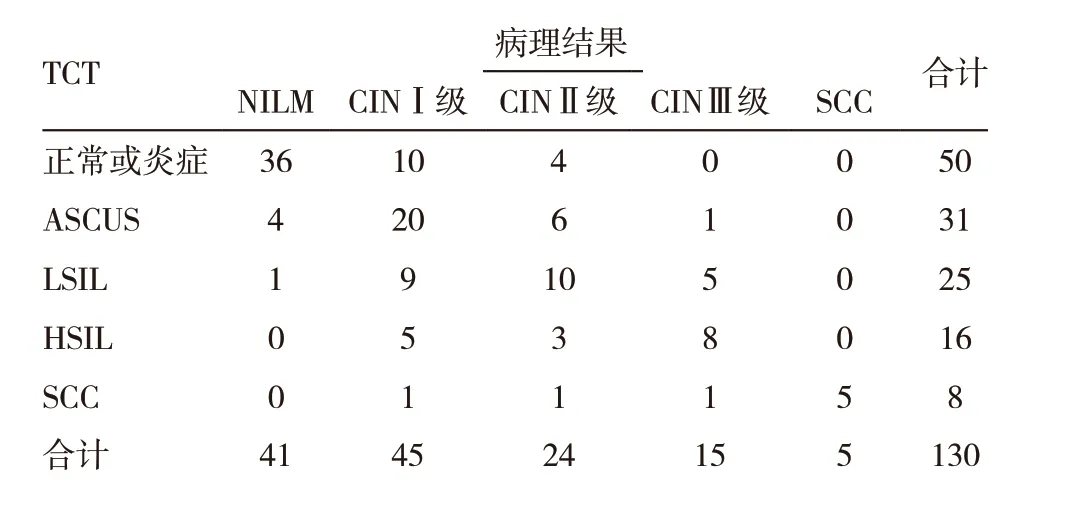
表1 TCT检测与病理结果比较

表2 HPV-DNA检测与病理结果比较

表3 HPV-DNA检测与TCT检测符合率比较[%(n/n)]
2.2 TCT分级与HPV分型比较
随着TCT 级别升高,高危型HPV 表达率逐渐升高,在SCC 中高危型HPV 表达率达100%,差异有统计学意义(P <0.05)。见表4。
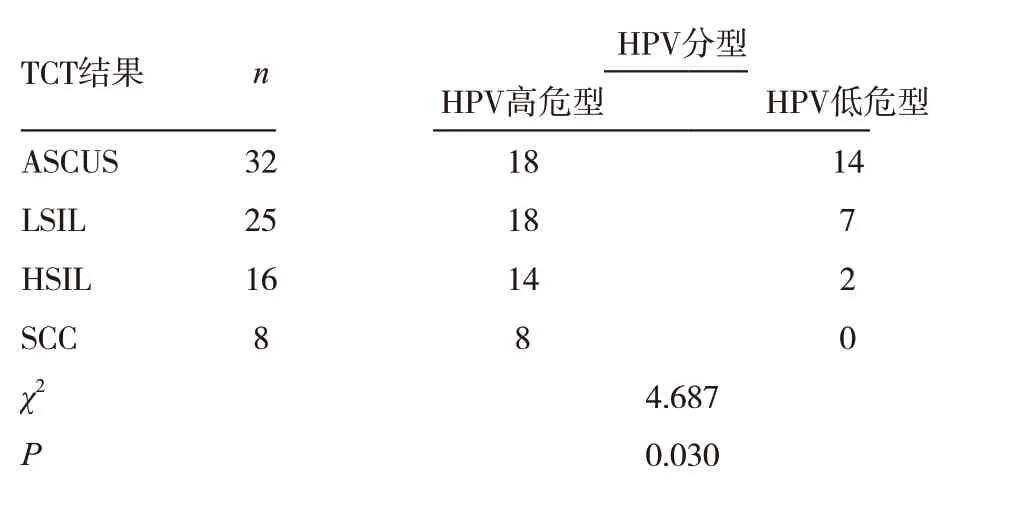
表4 TCT分级与HPV分型比较
2.3 TCT联合HPV-DNA在宫颈癌筛查中的诊断效能
TCT 联合HPV-DNA 在诊断灵敏度、特异度、准确度方面均高于单一TCT、HPV-DNA 检测,差异有统计学意义(P <0.05)。见表5。

表5 TCT联合HPV-DNA在宫颈癌筛查中的诊断效能(%)
3 讨论
宫颈癌的发病是一个漫长的过程,研究表明[9-10],从不典型增生发展到浸润癌大约需要8 ~12 年过程;在整个过程中患者多无明显症状体征,待出现阴道异常流血或接触性出血时,病变往往已经达到中晚期,失去最佳治疗时机。临床研究证实[11-12],对于CIN Ⅱ级及CIN Ⅲ级的患者约5%~30%可发展为浸润癌,但约10%~40%经早期干预后可发生逆转。因此,宫颈癌的早期筛查工作刻不容缓。目前,HPV 感染已经作为引起宫颈癌的独立危险因素写入各大指南中;另外,宫颈细胞学检查在临床上也得以广泛应用。HPV-DNA 检测和液基薄层细胞检查(TCT)是临床上常用的早期宫颈癌筛查手段,能够及时发现高危因素和癌前病变,但这两种方式受多种因素制约,假阳性和假阴性率均较高,特别是TCT 检查容易出现过度诊断的情况,因此不能作为确诊的唯一手段。病理检查作为一种有创性检查手段,容易导致患者宫颈出血、宫颈糜烂等并发症,在大样本筛查的应用中受到一定限制[13]。因此,联合检测在早期筛查中不失为一种提高确诊率的手段。
本研究中,以病理检查结果为金标准,TCT 检测的诊断符合率为61.54%,在CIN 阳性患者中,HPV-DNA 阳性率为69.23%,与国内其他学者研究相近似[14-15];国外学者研究指出[16],在连续两次HPV 检测均呈阳性的患者中,10 年内出现CIN Ⅲ级或浸润癌的发生率为21%,而HPV 阴性的患者中,10 年内出现CIN Ⅲ级或浸润癌的发生率仅为2.3%,差异巨大。本研究还显示,随着CIN 分级增加,HPV 阳性率逐渐升高,进一步证实了HPV 在宫颈癌筛查中的作用,同时这也提示笔者团队在病理检查呈高危病变的患者中多数存在HPV 阳性,治疗上也应同时行根治性HPV 治疗。TCT 分级与CIN 分级存在相似之处,一般业内医生将无意义的不典型鳞状细胞与CIN Ⅰ级相对应,低度鳞状上皮内病变与CIN Ⅱ级相对应,高度鳞状上皮内瘤变与CIN Ⅱ~Ⅲ级相对应[17],本研究中根据这种相关性得出TCT 分级与CIN 分级呈正相关,给临床医生提供了可靠的参考依据,分析认为:TCT 检查作为一种创伤较小的检查手段,能够简便的获取有效的标本,得到较为理想的薄层图片,准确率和安全性均较高,随着检测技术的不断改进,在大样本筛查中具有广阔的应用前景。
HPV 有多种分型,其中HPV16/18 是两种最常见的引起宫颈癌的类型,临床上也根据不同分型导致宫颈癌发生的危险因素高低将不同分型分为HPV 高危型和HPV 低危型[18];本研究结果显示,随着TCT 分级的增加,HPV 高危型的检测阳性率逐渐升高,特别是在SCC 的患者中,HPV 高危型阳性率达100%;在诊断效能方面,联合检测诊断灵敏度、特异度、准确度方面均高于单一TCT、HPVDNA 检测,说明TCT 检测与HPV-DNA 检测在一定程度上具有同步性,也能够相互弥补之间的不足,与其他学者报道相符合[19-20]。
综上所述,TCT 联合HPV-DNA 分型检测能够提高早期宫颈癌筛查准确率,且减少因假阳性和假阴性引起的过度治疗和误诊,值得在早期大样本筛查中推广应用。

