Solifenacin-1801的制备及药理活性研究
綦宇轩,徐 媛,符志杨,关丽萍
(浙江海洋大学食品与医药学院,浙江舟山 316022)
异喹啉类生物碱(Isoquinolines)是自然界中植物体内所分布数量多、结构类型复杂的一类生物碱。四氢异喹啉类生物碱作为天然的先导化合物,在植物中分布比较广泛,将其结构进行修饰、改造和优化是丰富四氢异喹啉生物碱结构多样性的重要途径。研究表明四氢异喹啉类生物碱及其衍生物具有多种药理活性,如中枢神经系统调节、抗肿瘤抗癌、抗炎症和抗病原微生物等[1-3]。
OSHIRO,et al[4]在筛选具抗抑郁活性的3,4-二氢-2(1H)-喹啉酮类衍生物时发现,5-甲氧基取代的衍生物具有刺激中枢神经系统的抗抑郁活性,并能选择性的结合σ受体。TSOYI,et al[5]研究发现四氢异喹啉类化合物CKD 712((S)-YS49)可经由JAK-2和STAT-1通路发挥抗炎作用,其在小鼠的炎症免疫模型(用脂多糖诱导RAW 264.7)中表达良好的抗炎作用,显示NO和诱导型一氧化氮合成酶的生成被抑制,对其异构体进行构效分析研究后发现其对i NOS的抑制活性为S型>R型。李剑[6]研究发现一种新的四环化合物四氢吡咯里嗪并喹琳并进行了结构优化,结果发现多数这样结构的衍生化合物具有较好的镇痛作用。在此类衍生物的N原子上引入不同取代的酰胺基团和不同碳链烷基后,设计合成一系列的新型四氢吡咯里嗪并喹琳衍生物具有良好的镇痛活性。
在上述研究的基础上,笔者的课题组为了寻找抗抑郁、抗炎及镇痛活性强,副作用低的化合物,设计合成了Solifenacin-1801化合物(结构见图1),对Solifenacin-1801采用经典抗抑郁模型“小鼠强迫游泳实验”和“小鼠悬尾实验”进行抗抑郁活性研究。另据研究报道[7-8]抑郁与体内炎症和疼痛有一定的相关性。为了探讨其相关性可能的作用机制,对Solifenacin-1801化合物采用经典的“小鼠二甲苯致耳肿胀的抗炎模型”和“小鼠醋酸扭体实验”进行抗炎和抗镇痛研究,以期探讨抗抑郁与炎症和疼痛之前的关系,初步探讨其作用机制,为抗抑郁药物的研究提供基础理论依据。
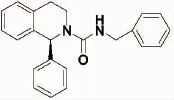
图1 化合物Solifenacin-1801结构Fig.1 The structure of compound Solifenacin-1801.
1 材料与方法
1.1 实验仪器与试剂
WRS-1B数字熔点仪(上海精密科学仪器有限公司),BS323S精密天平(赛多利斯科学仪器有限公司),FT-IR1730红外光谱仪(Bruker公司),AV-300核磁共振光谱仪(Bruker公司),HP1100LC/MS质谱仪(美国惠普公司)。氟西汀,吲哚美辛购自Sigma公司,其它化学试剂均为国产分析纯。
1.2 实验动物
小鼠(ICR)20±2 g,购于浙江省实验动物中心。实验前,在动物室饲养1周,以适应实验条件和环境,昼夜进食进水。
1.3 Solifenacin-1801的制备路线

1.3.1 (S)-1-苯基-1,2,3,4-四氢异喹啉羧酸乙酯的制备
取 12 g(0.06 mol)的(S)-1-苯基-1,2,3,4-四氢异喹啉和 8.3 g(0.06 mol)的碳酸钾,加入到甲苯(45 mL)和蒸馏水(30 mL)(3:2)的混合液中,置于圆底烧瓶中。搅拌条件下,于4℃缓慢滴加氯甲酸乙酯6.5 g(0.06 mol,5.71 mL)。滴毕,室温条件下反应50 min,反应过程中使用薄层色谱追踪反应进程(展开剂:二氯甲烷(V):甲醇(V)=30:1)。后处理:甲苯层先后经 50 mL 蒸馏水,20 mL的 1 mol·L-1盐酸,50 mL 蒸馏水,80 mL饱和氯化钠溶液洗涤。洗涤后的有机层用无水硫酸钠干燥,蒸除甲苯。得无色油状物体 (S)-1-苯基-1,2,3,4-四氢异喹啉羧酸乙酯,称重约15.4 g,计算产率为95.05%。
1.3.2 Solifenacin-1801的制备
取(S)-1-苯基-1,2,3,4-四氢异喹啉羧酸乙酯3.0 g(0.01 mol)与30 mL的甲苯于圆底烧瓶中,油浴加热至 110~120 ℃,搅拌 2 h。冷却后将氨苄 5.9 mL(0.05 mol,5.7 g)和 0.42 g(0.02 mol)NaH,加入到上述反应体系的圆底烧瓶中,并升温到130~140℃,不断蒸除生成的乙醇。乙醇蒸出后,继续反应15 min,而后冷却至室温。反应过程中采用薄层色谱追踪反应进程(二氯甲烷(V):甲醇(V)=5:1)。反应冷却至室温,加入30 mL饱和NaCl溶液,用乙酸乙酯萃取,合并有机层用蒸馏水洗涤,再用10 mL的20%HCl洗涤,用2 mol·L-1的氢氧化钠溶液调pH至10。用无水硫酸钠干燥,浓缩滤液。用95%的乙醇重结晶,得到目标化合物 Solifenacin-1801。
1.4 药理活性实验
1.4.1 小鼠强迫性游泳实验(FST)
取雄性小鼠,随机分成6组,每组8只。化合物Solifenacin-1801和阳性对照药物盐酸氟西汀溶于聚乙二醇-400中,实验当天在各组给药30 min后,将小白鼠单只放入高为20 cm,直径为14 cm,水深为10 cm,温度为23±2℃的圆柱形玻璃容器中,观察6 min。前2 min时小鼠剧烈挣扎,随后进入不动时间,此时由玻璃容器上方直接定位的摄像机记录实验后4 min内的不动时间。通过小鼠浮在水面上不动以及仅仅轻微划动肢体以确保头部浮在水面上所花费的时间认定为小鼠的不动时间[9]。
1.4.2 小鼠悬尾实验(TST)
将小鼠尾部距离尖端2 cm处用尾巴夹钳固定,悬挂于支架上,头部距离台面5 cm。实验环境要求黑暗,无明显噪音。总共悬浮6 min,前2 min不计时,在测试的后4 min的时间内,观察和测量不动的持续时间。整个测试分别由箱体正上方的摄像记录观察,摄像背景与小鼠毛色呈明显反差,白色小鼠采用黑色背景。实验结束后拿下录像带,此时小鼠的不动时间为它们被悬挂后彻底静止不动的时间[10]。
1.4.3 抗炎药理活性
Solifenacin-1801和阳性对照药物吲哚美辛溶于聚乙二醇-400,小鼠随机分组,雌雄各半,每组8只。实验时,小鼠进行腹腔注射给药100 mg·kg-1,使用的媒介溶剂和药物溶液的注射体积均为每只鼠给药0.1 mL。给药0.5 h后,小鼠左耳内外两面涂抹二甲苯,用量为0.05 mL·200-1·g-1,为实验组;右耳朵不涂抹,作为对照组,小鼠二甲苯致耳肿胀的抗炎模型[11]。炎症造模15 min后,颈脱臼处死小鼠,使用小鼠耳打孔机中直径6 mm的打孔模具分别在同一位置打下小鼠左右双耳的耳片。记录其质量,计算肿胀度和肿胀率。以左右两侧耳片质量差作为肿胀程度的指标,实验组与对照组的肿胀程度进行统计学处理。抗炎作用强度以肿胀度和肿胀率(%)表示。
肿胀度=左耳质量-右耳质量;肿胀率-[(左耳质量-右耳质量)/左耳重量]×100%
1.4.4 镇痛实验
小鼠随机分组,雌雄各半,一组8只。实验时,小鼠进行腹腔注射给药。给药30 min后进行实验,腹腔注射1.2%的冰乙酸生理盐水溶液进行疼痛造模[12],注射剂量为每只鼠0.2 mL(即0.1 mL·10-1·g-1),观察并记录造模后15 min内小鼠出现的扭体现象的次数。小鼠出现扭体反应的现象为:四肢延伸,腹部收缩内凹,臀部扭转的一系列动作,只出现了腹部内凹收缩和蜷缩成团并伴有微微震颤的状态不计为小鼠的扭体反应状态。统计药物在醋酸致痛模型中对小鼠扭体反应的抑制率和镇痛百分率。
抑制率%=(空白组鼠扭体次数均数-给药组鼠扭体次数均数)/空白组鼠扭体反应均数×100%
镇痛百分率%=(给药组无扭体反应数-空白组无扭体反应数)/空白组扭体反应数×100%
1.5 统计方法
抗抑郁活性的定量评价采用SPSS 13.0软件对数据进行统计分析,组间比较用t检验,P<0.05为具有统计学意义。
2 结果与讨论
2.1 Solifenacin-1801光谱数据
对目标化合物采用IR、1H-NMR、13C-NMR和MS确定结构,产率和光谱数据。产率71.8%,熔点116.4-118.3 °C。IR(KBr)cm-1:3288,1719,1618,1247.1H NMR(CDCl3,300 MHz):δ 2.86-2.98(2H,t,-CH2-),3.73-3.87(2H,t,-CH2-),4.48(1H,s,-CH),6.45(1H,s,-CH),6.67(1H,s,-NH),6.90-7.10(4H,m,-C6H4),6.95-7.31 (5H,m,-C6H5),7.25-7.40 (5H,m,-C6H5).13C NMR (CDCl3,75 MHz):δ 28.38,40.13,45.10,57.81,126.40,127.17,127.24,127.50,127.65,128.25,128.40,128.48,128.60,135.09,136.52,139.47,142.82,157.49.MS([M+1]+):342.
2.2 抗抑郁活性
小鼠强迫游泳实验结果如表1。化合物Solifenacin-1801在三种剂量10,20和30 mg·kg-1均显著抑制小鼠强迫游泳的不动时间,显示一定的抗抑郁活性。Solifenacin-1801在30 mg·kg-1给药剂量下与空白组比具有显著性差异(P<0.001),Solifenacin-1801在20 mg·kg-1给药剂量下,其抑制率为74.2%,其抑制率与阳性对照药氟西汀相似,而Solifenacin-1801在30 mg·kg-1给药剂量下其抑制率为84.4%,好于阳性对照药氟西汀,显示出显著抗抑郁活性。
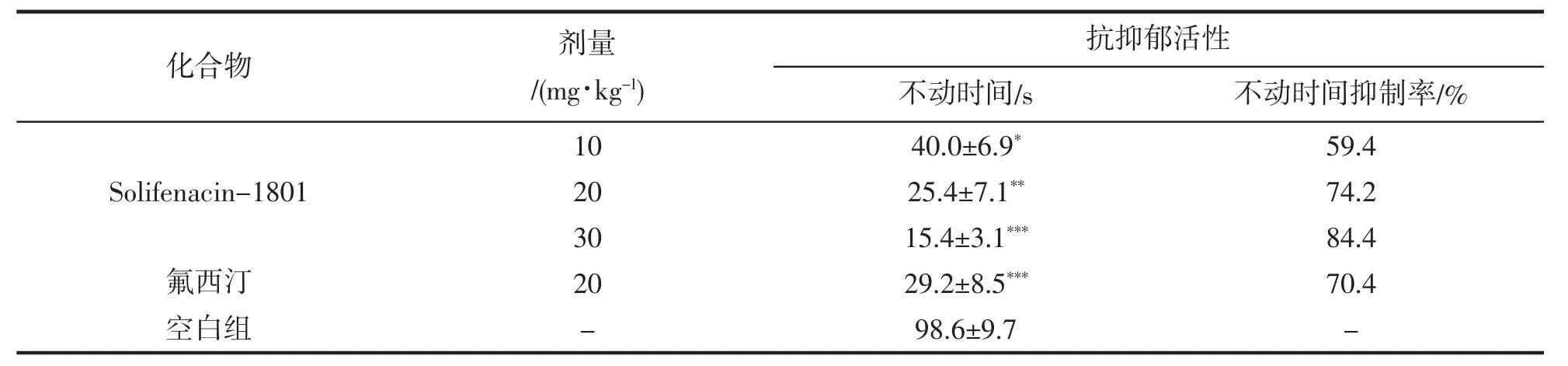
表1 Solifenacin-1801小鼠强迫游泳试验抗抑郁活性Tab.1 Antidepressant activity of Solifenacin-1801 in the FST
为了进一步确认Solifenacin-1801抗抑郁活性,对Solifenacin-1801进行小鼠悬尾实验,结果如表2。Solifenacin-1801小鼠悬尾试验抑制小鼠不动时间结果与在FST实验相似。Solifenacin-1801在20和30 mg·kg-1给药剂量下,其抑制率分别为39.0%和43.1%,其抑制率与阳性对照药氟西汀相似,显示一定的抗抑郁活性。

表2 Solifenacin-1801小鼠悬尾试验抗抑郁活性Tab.2 Antidepressant activity of Solifenacin-1801 in the TST
2.3 Solifenacin-1801抗炎和镇痛活性
据文献报道抑郁与炎症和疼痛有一定的相关,为此,Solifenacin-1801采用小鼠耳肿胀模型和醋酸致痛模型进行小鼠的抗炎活性和镇痛活性评价,实验结果见表3。Solifenacin-1801在100 mg·kg-1的给药剂量下,Solifenacin-1801的抗炎率为77.4%,镇痛率为96.3%,其抗炎抑制活性与阳性药吲哚美辛相比活性低,而镇痛活性与阳性对照药相似,与空白组相比具有显著性差异(P<0.001),显示一定的抗炎与镇痛活性。
小鼠强迫游泳实验和悬尾实验被动接受抑郁症的两个经典的应激模型,从而诱发动物绝望的状态,在小鼠中实验具有良好的可靠性和预测性[13-14]。两种模式,小鼠都是处于全力挣扎但又无法挣脱的局限压迫的环境中,一段时间后,动物即被诱导出小鼠抑郁状态的特征行为(行为绝望状态-不动状态),这反过来又可能反映了人类的抑郁症[15]。一些研究表明,这些急性试验的阳性结果对单胺转运氧化酶具有良好的、优异的预测效果,这对人身上受试抗抑郁药的治疗效果是一个重要的机制干扰[16]。

表3 Solifenacin-1801的抗炎和镇痛活性Tab.3 Anti-inflammatory and analgesic activities of Solifenacin-1801
Solifenacin-1801在3个剂量(10,20和30 mg·kg-1)条件下给药30 min后,能够显著的降低强迫游泳试验和悬尾试验中小鼠的不动时间,显示出显著的抗抑郁作用,并在10~30 mg·kg-1的剂量下具有以剂量依赖性。我们发现在100 mg·kg-1给药剂量下,Solifenacin-1801不仅抗抑郁活性显著,其同样还显示出显著的抗炎与镇痛活性,Solifenacin-1801的抗炎率为77.4%,镇痛率为96.3%。进一步说明了Solifenacin-1801的抗抑郁作用机制,可能还通过炎症免疫假说的细胞介质传导或与疼痛抑郁合并症机制有关,起到抗抑郁疗效。
Solifenacin-1801显著的抗抑郁、抗炎镇痛的生物活性,综合分析炎性反应和疼痛与抑郁症研究进展,免疫炎性反应是抑郁症的发病机制之一,炎性过程与部分抑郁症的发生发展相关联,而非全部抑郁症[17-18],抑郁症存在以高炎性状态为抑郁标志的“亚型”免疫炎性[19],抗抑郁药可能大多具有抗感染疗效。
3 结论
本研究以 (S)-1-苯基-1,2,3,4-四氢异喹啉为起始原料,经成酯和胺解交换反应得到目标化合物Solifenacin-1801,而后经IR、1H-NMR、13C-NMR和高质谱确定其结构。
抗抑郁活性实验表明,Solifenacin-1801在10,20和30 mg·kg-1剂量条件下,均能显著降低小鼠强迫游泳和小鼠悬尾不动时间,显示一定的抗抑郁活性。尤其在30 mg·kg-1给药剂量下,与空白对照组相比具有显著性差异(P<0.001),其抑制率与阳性对照药氟西汀相似,具有很好的抗抑郁活性。
另外,Solifenacin-1801在耳肿胀抗炎实验和醋酸致痛实验显示,在100 mg·kg-1的给药剂量下与空白对照组相比具有显著性差异(P<0.001),显示出显著的抗炎与镇痛活性,进一步证明抑郁与体内的炎症和疼痛有关。此研究,为寻找炎症和疼痛诱导引发的抑郁合并症类的抗抑郁药提供了实验理论依据。

