原发性甲状腺功能减退症孕妇甲状腺素替代治疗对甲状腺功能及母婴结局的影响
罗 希,赵锦秀,吴 君,谭春梅,田 恬
(1.成都医学院第一附属医院产科,四川 成都610500;2.四川省医学科学院 四川省人民医院产科,四川 成都610072)
甲状腺功能减退症(hypothyroidism)简称甲减,属于内分泌系统疾病,是由于患者甲状腺素合成、分泌障碍或长期缺碘引起的机体代谢减低的综合征[1]。临床症状多表现出嗜睡、反应迟钝,脸色发白、记忆力减退,全身皮肤干燥等。原发性甲减在临床甲减中占比约为90%,其主要由患者机体甲状腺本身病变引起,其次为继发性,生育期女性较为高发[2]。女性处于妊娠期时,对甲状腺素具有较高的需求量,此时机体甲状腺功能处于应激状态,若母体对该种变化难以适应,极可能发生甲减。有调查[3]表明,妊娠期女性甲减发病率已达4%~10%。该疾病在孕妇中发病时通常症状不明显,易导致病情延误,可引起一系列母婴不良后果[4-5],包括孕妇自发性流产、妊娠期高血压、糖代谢异常疾病,胎儿早产、低体重儿,严重者会影响到新生儿脑部功能及远期认知功能[6-7]。妊娠期甲减若不加以诊治,危害极大。因此,对孕妇甲减的早期治疗具有重要意义。临床主要通过检测监测孕妇的甲状腺素各项指标来进行甲减孕妇病情的诊断,指标包括血清促甲状腺素(TSH)、游离三碘甲状腺原氨酸(FT3)及游离甲状腺素(FT4)。为有效控制妊娠期甲减孕妇的甲状腺功能,可采用甲状腺素替代疗法治疗甲减孕妇。本研究旨在评估甲状腺素替代疗法对孕妇甲状腺功能及母婴结局的影响。现报道如下。
材料和方法
1 一般资料
本研究为前瞻性、单中心、双盲、随机对照实验。系统抽样选取2017年5月至2018年5月期间于我院治疗的原发性甲状腺功能减退症孕妇120例,随机数字表法分为观察组和对照组各60例。观察组年龄22~35(27.5±3.1)岁;孕周27~38(35.3±3.0)周;孕次1~3(2.4±0.4)次。对照组年龄23~36(28.4±3.3)岁;孕周31~38(35.2±2.8)周,孕次1~3(2.6±0.5)次。选择同期我院产科生产的60例健康孕妇纳入健康组。健康组年龄23~35(28.2±3.1)岁;孕周30~38(35.9±2.4)周,孕次1~3(2.3±0.5)次。3组孕妇一般资料差异无统计学意义(P>0.05),具有可比性。纳入标准:①22~44岁,单胎妊娠;②所有孕妇皆无严重器质性病变,身体发育符合常规分娩要求;③观察组、对照组患者临床症状符合美国甲状腺协会制定的《妊娠和产后甲状腺疾病诊治指南》[8]中妊娠合并甲减的有关诊断;④无甲状腺家族疾病史;⑤孕妇及其家属同意参与,并签署知情同意书。排除标准:①采取促排卵手段受孕;②多胎妊娠;③孕前即有慢性高血压、免疫缺陷疾病等内科慢性疾病史;④存在严重心、肝、肾等重要脏器病变;⑤有精神疾病史,无法遵循医嘱。本研究经医院伦理委员会批准,孕妇及其家属签署知情同意书。
2 方法
观察组给予甲状腺素替代疗法,口服左甲状腺素钠片(商品名:优甲乐;生产厂家:德国Merck KGaA;批准文号:H20140052;50μg/片),起始剂量25~50μg/d,每日1次,于每日晨起服用,4周为1疗程。对照组给予安慰剂,每日1次。安慰剂由深圳市中联制药有限公司制造,其主要成分为淀粉,与优甲乐药片的外观一致,为白色圆形片,一面中心有“+”字刻痕,另一面刻有“EM 50”(50μg规格),但是无左甲状腺素钠成分。两组均治疗3个月。健康组不给予任何措施。
3 观察指标
①采用放射免疫分析法监测观察组、对照组孕妇治疗前、治疗后血清TSH、FT3、FT4水平变化,健康组于同时间点、3个月后分别测定一次。放射免疫分析试剂盒购自天津九鼎医学生物工程有限公司。②比较3组孕妇妊娠结局及相关并发症发生情况(包括胎位异常、妊高症、妊娠期糖尿病、胎膜早破及产后出血)。③比较围产儿预后不良发生情况(包括新生儿窒息、胎儿窘迫、小于胎龄儿、围产儿死亡)。参考2013年人民卫生出版社《妇产科学》第8版[9],早产判定:27~37周即分娩;妊高症判定:孕期显示妊娠20周后血压持续性上升,两次以上测量收缩压≥140mmHg,舒张压≥90mmHg;妊娠期糖尿病判定:孕期>24周,采用75 g口服葡萄糖耐量试验,结果显示至少1项超标。小于胎龄儿:新生儿体质量 <2.5kg。
4 统计学处理
结 果
1 3组血清TSH、FT 3、FT 4水平比较
治疗前,观察组和对照组TSH水平均高于健康组,FT3、FT4水平均低于健康组,差异有统计学意义(P<0.05),且观察组与对照组比较差异无统计学意义(P>0.05)。治疗后,观察组TSH水平低于治疗前和对照组,FT3、FT4水平高于治疗前和对照组,差异有统计学意义(P<0.05),且观察组与健康组比较差异无统计学意义(P>0.05)。见表1。
表1 3组血清TSH、FT3、FT4水平的比较()
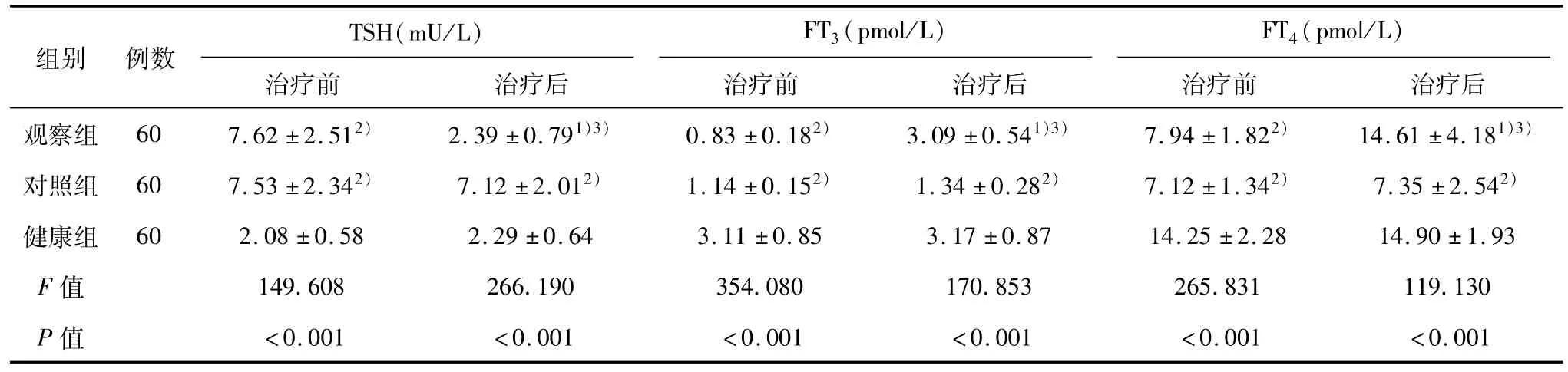
表1 3组血清TSH、FT3、FT4水平的比较()
注:与治疗前比较,1)P<0.05;与健康组比较;2)P<0.05;与对照组比较;3)P<0.05
FT4(pmol/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后观察组 60 7.62±2.512) 2.39±0.791)3) 0.83±0.182) 3.09±0.541)3) 7.94±1.822) 14.61±4.181)3)对照组 60 7.53±2.342) 7.12±2.012) 1.14±0.152) 1.34±0.282) 7.12±1.342) 7.35±2.542)健康组 60 2.08±0.58 2.29±0.64 3.11±0.85 3.17±0.87 14.25±2.28 14.90±1.93 F值 149.608 266.190 354.080 170.853 265.831 119.130 P值TSH(mU/L)组别 例数FT3(pmol/L)<0.001 <0.001 <0.001 <0.001 <0.001 <0.001
2 3组妊娠结局及并发症发生情况
对照组妊娠期高血压、妊娠糖尿病、胎膜早破的发生率均高于观察组和健康组,差异有统计学意义(P<0.05),产后出血和胎位异常发生率比较差异无统计学意义(P>0.05)。观察组与对照组比较差异无统计学意义(P>0.05)。见表2。

表2 3组妊娠结局及并发症发生率比较[n(%)]
3 3组围产儿预后结局
对照组早产、小于胎龄儿的发生率均高于观察组和健康组,差异有统计学意义(P<0.05),新生儿窒息和围产儿死亡发生率比较差异无统计学意义(P>0.05)。观察组与对照组比较差异无统计学意义(P>0.05)。见表3。
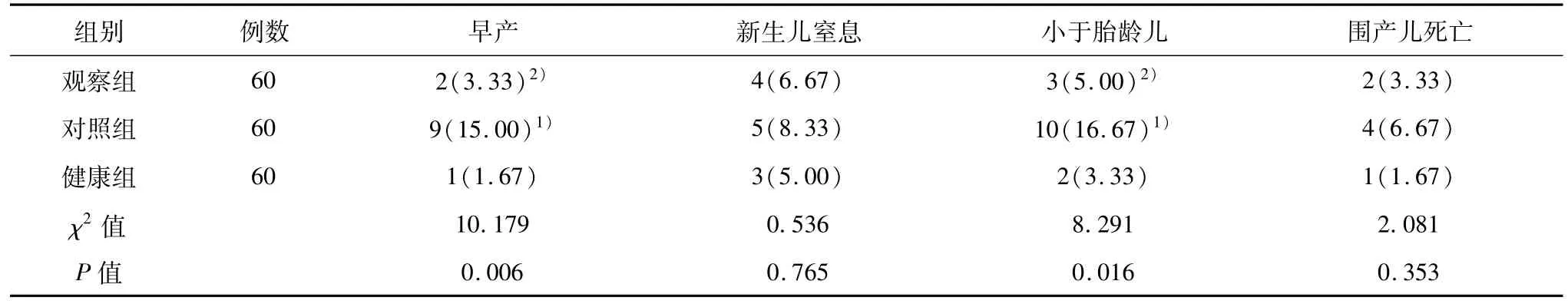
表3 围产儿预后结局比较[n(%)]
讨 论
甲减属于较常见的内分泌疾病,也是妊娠期女性多发内分泌疾病之一,发病率仅次于妊娠期糖尿病。其病因较为复杂,碘缺乏、家族史、甲状腺抗体阳性、免疫系统疾病、年龄增大等都可能是孕妇甲减的高危致病因素[10-11]。处于妊娠期女性甲状腺素需求量增加,母体对该种变化难以适应时,部分孕妇雌激素分泌异常,引起甲状腺素分泌紊乱,导致发生甲减[12];机体某些酶抗体发生阳性改变,例如机体中甲状腺过氧化物酶抗体及甲状腺球蛋白抗体呈现阳性变化,可能引起机体甲状腺素的分泌减少[13]。研究证实,甲状腺素对机体生长发育代谢具有重要作用。研究[14]表明,妊娠早期,胎儿所需甲状腺素来源于母体供给,若母体缺乏甲状腺素则会导致胎儿发育迟缓、死胎,极易导致流产或围产儿预后不良。
女性妊娠期的甲状腺功能异常会严重危害母婴健康,病情严重者会造成孕妇自身多种器质性病变,极易导致冠心病的发生[15]。其也是诱发高脂血症和恶性贫血的危险因素。目前,甲减发病例数逐年上升,孕妇通常症状不明显,易导致漏诊发生。近年来,随着孕检体系的不断完善,对孕妇甲状腺素监测逐渐予以重视,临床检出率不断得以提高,经积极治疗后的甲减孕妇,大部分可有效控制病情发展,顺利生产。目前甲状腺素替代疗法是临床治疗孕妇甲减的首要方式[16],妊娠期甲减患者规范使用激素替代法治疗对预防孕妇不良预后具有重要价值。本研究结果显示,经过治疗后,观察组孕妇甲状腺功能得到较好控制,激素水平均较接近健康孕妇各项指标水平,即说明甲状腺素替代疗法可较好控制患者甲状腺功能,维持甲状腺素水平正常,本研究结果也与顾颖等[17]的研究相似。既往研究[18]提出,孕妇甲减可能对母婴预后造成不良后果,本研究即验证了这一点,安慰剂对照组出现妊高症、妊娠糖尿病、胎膜早破的病例数均明显高于观察组和健康组,而观察组与健康组孕妇相比较,妊娠并发症发生情况无显著差异。对照组围产儿早产或出现小于胎龄儿的发生率均高于观察组与健康组,但3组新生儿窒息与死亡率无显著差别,该项结果提示了母体甲状腺素缺乏会引发胎儿发育迟缓等不良后果。经过甲状腺素替代治疗后,观察组甲减孕妇与健康组孕妇围产儿不良预后发生率无显著差异,即说明甲状腺素替代疗法明显改善新生儿不良预后,这也与刘文瑶等[16]的研究相符。因此,采用甲状腺素替代疗法,可调节甲状腺激素水平,保证母婴预后良好。
总之,对于甲状腺功能减退孕妇,尽早监测甲状腺功能指标,采用甲状腺素替代疗法治疗,可有效控制甲状腺功能,明显改善母婴结局。

