磷浓度对海水钝顶螺旋藻生长代谢的影响
陈浩 杨冰洁 李涛 吴华莲 吴后波 向文洲
(1. 中国科学院南海海洋研究所 中国科学院热带海洋生物资源与生态重点实验室,广州 510301;2. 中国科学院大学,北京 100049)
螺旋藻(Spirulina)或节旋藻(Arthrospira)为蓝藻门(Cyanophyta)、段殖藻目(Hormogonales)、颤藻科(Oscillatoriaceae)、螺旋藻属(Spirulina)或节旋藻属(Arthrospira)的藻类。螺旋藻是目前蛋白质含量最高的食品资源[1],同时,螺旋藻还富含功能独特的活性多糖、藻蓝蛋白、γ-亚麻酸等生物活性物质,在食品、医药保健、化妆品及饲料等领域得以广泛应用[2]。研究表明,螺旋藻多糖对HIV病毒、丙肝病毒等多种病毒具有抑制作用[3],而且其在抗肿瘤、抗氧化[4]、免疫调节、降血糖血脂以及修复DNA损伤等方面也表现出了良好的功效[5-6]。螺旋藻还含有丰富的藻蓝蛋白,藻蓝蛋白已被证实具有显著的抗癌、抗炎症等多种生物活性[7],同时还能作为食用色素应用于食品行业[8]。γ-亚麻酸对心血管疾病具有良好预防作用,而且是合成前列腺素E1的前体物质[9]。
螺旋藻产业在国际上兴起于20世纪80年代初,我国于90年代中期已成为国际上最大的螺旋藻产业国[10]。利用天然海水培养螺旋藻,可显著节约淡水资源,同时可利用滩涂、盐碱地等环境进行培养,有效缓解农用耕地日趋紧张的问题,而海水中含有大量营养元素,可大幅度降低螺旋藻培养的肥料成本。长期以来,海水螺旋藻的研究得到全世界的普遍关注,但目前大多仅停留在实验室藻种选育阶段。本实验室于20世纪80年代末至90年代初在国际上率先建立了全海水的螺旋藻产业化生产技术,并与企业合作成功实现了海水螺旋藻的产业化,与传统淡水螺旋藻养殖相比,其品质得以显著提高[11-12]。
磷是调节细胞生长和代谢的必需营养因子之一,在大多数细胞过程中起着不可或缺的作用,特别是涉及能量转移、信号转导、高分子生物合成、光合作用和呼吸的过程[13]。研究表明磷元素对许多藻类脂质[14-15]、蛋白质[16]和多糖[17-18]的积累具有显著影响。螺旋藻的主要成分及其含量可以通过多种培养条件来控制,如氮浓度[19]、光照强度[20]和温度[21]。有关氮源、温度和光照对螺旋藻的生长、代谢产物影响研究十分广泛,但磷源浓度对螺旋藻生长代谢影响的研究还很少,仅见2篇文献对淡水螺旋藻的主要生化组分[22]和脂类积累[23]影响的研究。对于磷浓度对海水螺旋藻生物量生产和生化组成的影响,尚未见报道。因此,研究磷对海水螺旋藻生长和生化组成的影响对海水螺旋藻主要高值化产物生产以及海水螺旋藻产业具有重要的指导意义。本研究首次开展不同磷源浓度的海水螺旋藻培养实验,系统分析磷源浓度对海水螺旋藻生长及生化组成的影响规律,为通过磷调节来提高螺旋藻主要产物的产量、提升螺旋藻品质奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 藻株及保存条件 海水钝顶螺旋藻(Spirulina Platensis)藻种,由中国科学院南海海洋研究所海藻资源与生物技术实验室提供。
藻种保存条件:培养温度为25±1℃,荧光灯提供光源,培养光强为 49-57 μmol·photons m-2·s-1,光暗周期为 12 h∶12 h。
1.1.2 实验设计 本实验以改良的Zarrouk海水培养基为基础培养基,其组成为:5 g/L NaHCO3,0.5 g/L NaNO3,0.01 g/L FeSO4·7H2O,0.08 g/L Na2EDTA,1 mL/L A5solution,以天然海水为基质配制而成。通过补加去离子水将盐度控制在28±1‰。K2HPO4·3H2O为磷源,加入不同的磷源浓度(终浓度分别为 0.005、0.01、0.02,0.03和 0.04 g/L),接种于500 mL锥形瓶,于温度为25℃,光强为49-57 μmol·photons m-2·s-1条件下,静置培养,每天定时摇瓶6次。培养结束后(培养周期10 d),离心收集藻泥,去离子水多次清洗,真空冷冻干燥获得冻干粉,用于总糖、水溶性多糖、蛋白质、藻蓝蛋白、光合色素总脂以及脂肪酸含量的测定。
1.2 方法
1.2.1 生物质浓度的测定 利用干重法进行测定。取一定量的藻液,用预先在80℃烘箱中烘干至恒重的混合纤维滤膜(0.45 μm)进行抽滤,再将有藻细胞的滤膜放置在80℃烘箱烘至恒重,用减差法得到微藻细胞干重。每个样品重复3次计算平均值。
1.2.2 总糖的提取及测定 取10 mg 藻粉,加入5 mL 0.5 mol/L H2SO4,于80℃ 水浴搅拌0.5 h,8 000 r/min 离心10 min,收集上清液。反复抽提3次,合并上清后定容到50 mL,得到总糖提取液;总糖含量的测定采用苯酚-硫酸法[24]。
1.2.3 水溶性多糖提取及测定 取50 mg 藻粉溶于水,超声破坏细胞结构后,70℃热水浸提4 h,8 000 r/min 离心10 min 收集上清。反复抽提4次,合并上清并定容至50 mL得到水溶性多糖提取液;水溶糖含量通过苯酚-硫酸法测定。
1.2.4 胞壁多糖及总多糖的测定 取上述提取水溶性多糖后所得藻渣,加入5 mL 0.5 mol/L H2SO4,于80℃ 水浴搅拌 0.5 h,8 000 r/min 离心 10 min,收集上清液。反复抽提3 次,合并上清后定容到50 mL,得到胞壁多糖提取液[25];采用苯酚-硫酸法测定其含量。
1.2.5 蛋白质含量的测定 采用半自动凯氏定氮仪测定总蛋白质含量,以蛋白质的F值为6.25 计算。
1.2.6 藻胆蛋白的测定 采用改良的Sigelman和Kycia 法提取藻胆蛋白,分光光度法测定藻蓝蛋白、异藻蓝蛋白含量[26]。
1.2.7 脂溶性光合色素测定 取10 mg 藻粉,置于10 mL玻璃离心管中,加入5 mL丙酮,避光冰浴搅拌提取1-2 d,直至藻体变白,3 000 r/min 离心10 min 收集上清得到色素提取液。采用分光光度法在662 nm、645 nm和470 nm下测定叶绿素a、总类胡萝卜素含量[27-28],由下列公式计算:
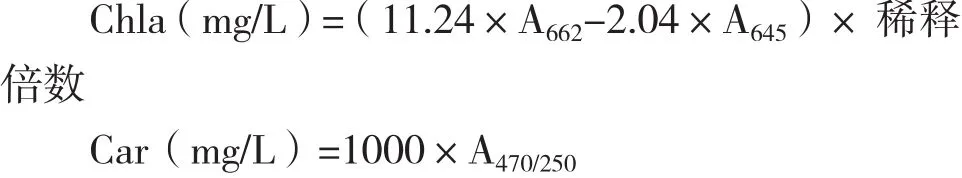
色素含量(%DW)=(色素质量浓度算×提取液体积)/藻体干重
1.2.8 总脂的测定与分级 总脂的提取与含量的测定采取改良的Khozin-Goldberg方法[29]。
1.2.9 脂肪酸组成的测定 称取25 mg冻干藻粉于10 mL玻璃离心管中,加入2 mL 2% H2SO4无水甲醇:甲苯(9∶1,V∶V),充入氮气后,用80℃水溶搅拌1 h,再依次加入1 mL去离子水和1 mL正己烷,充分震荡后3 500 r/min离心5 min,将上层有机相转移至另一离心管中,氮气吹干,再加入1 mL含有C17标准品的正己烷,并用孔径为0.22 μm的滤膜过滤至1.5 mL的小玻璃瓶中,最后利用气相色谱仪测定脂肪酸。
1.2.10 统计分析 数据以平均值,最后利用气相色谱SPSS13.0 统计软件进行方差分析,检验水平仪=0.05,P<0.05差异有统计学意义。使用Origin 8.1进行数据处理和图表制作。
2 结果
2.1 磷源浓度对海水钝顶螺旋藻生长的影响
经过0-2 d的生长延滞期,从第2天开始,海水钝顶螺旋藻在5种不同磷源浓度中均开始迅速增长,至第10天培养结束时,0.005 g/L、0.01 g/L、0.02 g/L、0.03 g/L和0.04 g/L 5种磷源浓度处理组的生物质浓度分别达到0.412±0.003 g/L、0.416±0.003 g/L、0.433±0.002 g/L、0.450±0.016 g/L 和 0.484±0.022 g/L,如图1所示。结果显示,随着磷源浓度的增加,海水螺旋藻的生物质浓度也随之提高,浓度为0.04 g/L处理组的生物质浓度高于其他磷源浓度处理组,为0.484±0.022 g/L。由方差分析可知,除0.005 g/L处理组与0.01 g/L处理组无显著差异外(P>0.05),其余处理组生物质浓度之间均存在显著差异(P<0.01)。
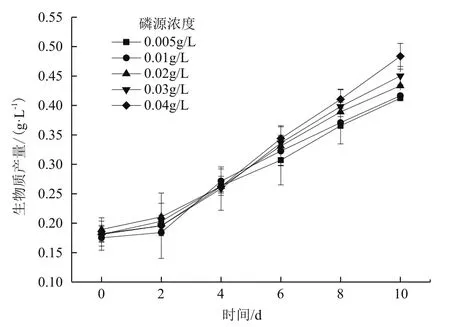
图1 磷源浓度对海水钝顶螺旋藻生长的影响
2.2 磷源浓度对海水钝顶螺旋藻蛋白质含量的影响
对第10天不同磷源浓度影响下海水钝顶螺旋藻蛋白质含量进行测定。如图2所示,经方差分析后得出在磷源浓度为0.02 g/L和0.03 g/L时,海水螺旋藻蛋白质含量无显著差异(P>0.05),其余处理组均存在显著差异(P<0.01)。由此可见,随着磷源浓度的增加,海水钝顶螺旋藻蛋白质含量显著升高,最高可达59.23±0.61%DW。海水钝顶螺旋藻蛋白质产量变化与含量变化一致,即随着磷源浓度增加而升高,并在磷源浓度为0.04 g/L时,达到最高值0.29±0.02 g/L。
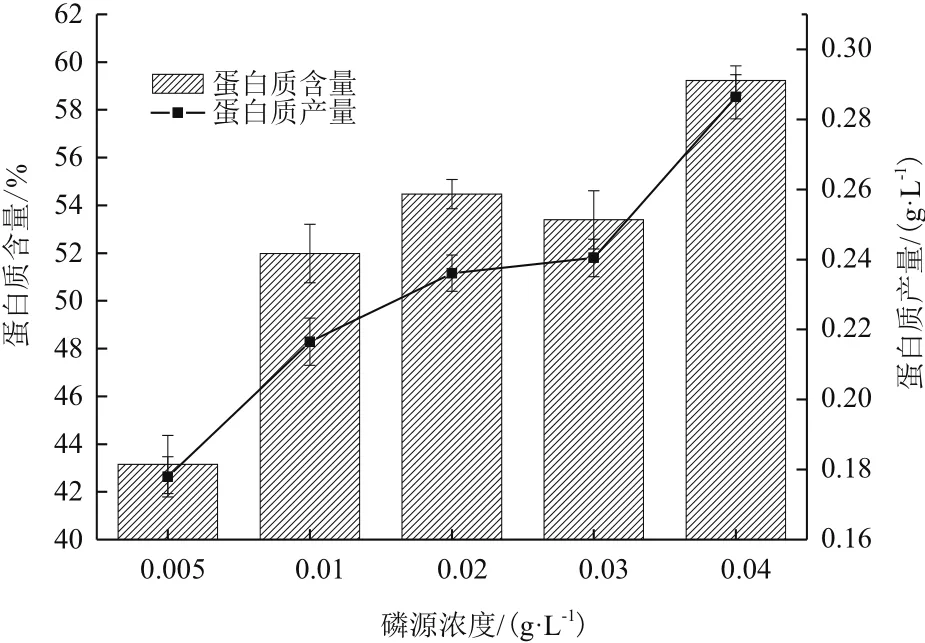
图2 磷源浓度对海水钝顶螺旋藻蛋白质产量的影响
2.3 磷源浓度对海水钝顶螺旋藻多糖含量的影响
对第10天不同磷源浓度影响下海水钝顶螺旋藻的多糖组成及含量测定。如图3所示,经方差分析可得在磷源浓度为0.02 g/L、0.03 g/L和0.04 g/L时,海水钝顶螺旋藻总糖含量均无显著差异(P>0.05),其余各处理组均有显著差异。由此可见,随着磷源浓度的增加,海水螺旋藻总糖含量显著下降后达到平稳,浓度0.005 g/L处理组总糖含量达到最高(25.96±1.61%DW)。其总多糖产量变化与含量变化相似,浓度0.005 g/L处理组含量最高(107.05±2.83 mg/L),如下图3所示。
如表1所示,海水螺旋藻多糖主要为水溶性多糖,磷源浓度0.02 g/L、0.03 g/L和0.04 g/L组,海水钝顶螺旋藻水溶糖以及胞壁糖含量均无显著差异(P>0.05),其余各处理组均有显著差异(P<0.01)。两个组分的含量随着磷源浓度的升高而降低,磷源浓度0.005 g/L处理组含量最高,分别为22.15±0.71%DW以及3.62±0.28%DW。磷源浓度0.02-0.04 g/L范围内,随着磷源浓度增加,两个多糖组分的含量趋于稳定,不再随着浓度增加而显著变化(P>0.05)。
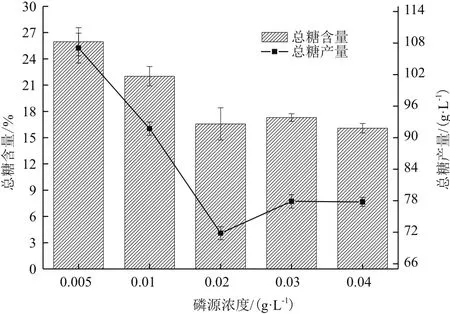
图3 磷源浓度对海水钝顶螺旋藻多糖产量的影响
2.4 磷源浓度对海水钝顶螺旋藻光合色素的影响
对第10天不同磷源浓度条件下海水螺旋藻的藻蓝蛋白含量进行测定。如图4所示,经方差分析可知,磷源浓度0.02 g/L和0.03 g/L处理组的海水螺旋藻C-藻蓝蛋白、别藻蓝蛋白、总藻胆蛋白含量无显著差异(P>0.05);磷源浓度0.01 g/L和0.04 g/L处理组,海水螺旋藻C-藻蓝蛋白、别藻蓝蛋白和总藻胆蛋白含量无显著差异(P>0.05),其余各处理组均有显著差异(P<0.01)。由此可见,随着磷源浓度的增加,C-藻蓝蛋白、别藻蓝蛋白和总藻胆蛋白含量升高,但随着磷源浓度进一步增加,3个组分含量略有下降。磷源浓度0.02 g/L处理组达到最大值,3种组成含量分别为14.56±0.99%DW、4.21±0.19%DW和18.77±0.39% DW。
如图5所示,藻胆蛋白各组分产量随着磷源浓度增加呈增长趋势,磷源浓度0.04 g/L处理组的C-藻蓝蛋白、别藻蓝蛋白及总藻胆蛋白产量最高,分别达到0.064±0.001 g/L、0.019±0.001 g/L及0.084±0.001 g/L,但与0.02 g/L和0.03 g/L处理组无显著差异(P>0.05)。
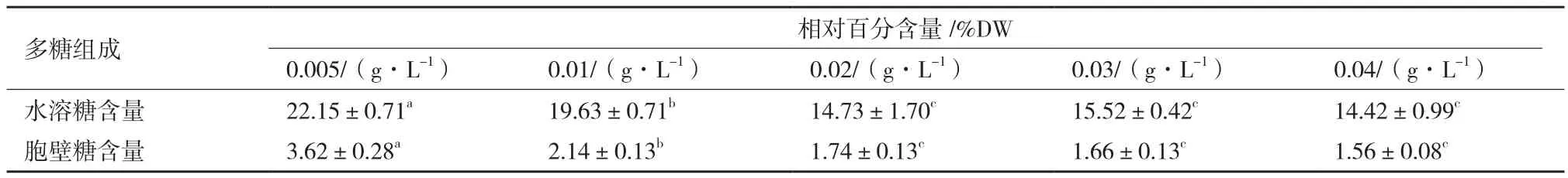
表1 磷源浓度对海水钝顶螺旋藻多糖含量及组成的影响
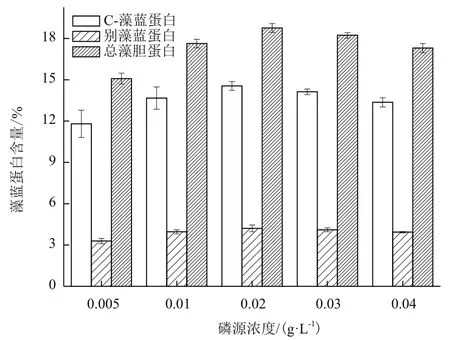
图4 磷源浓度对海水钝顶螺旋藻藻胆蛋白组成及含量的影响
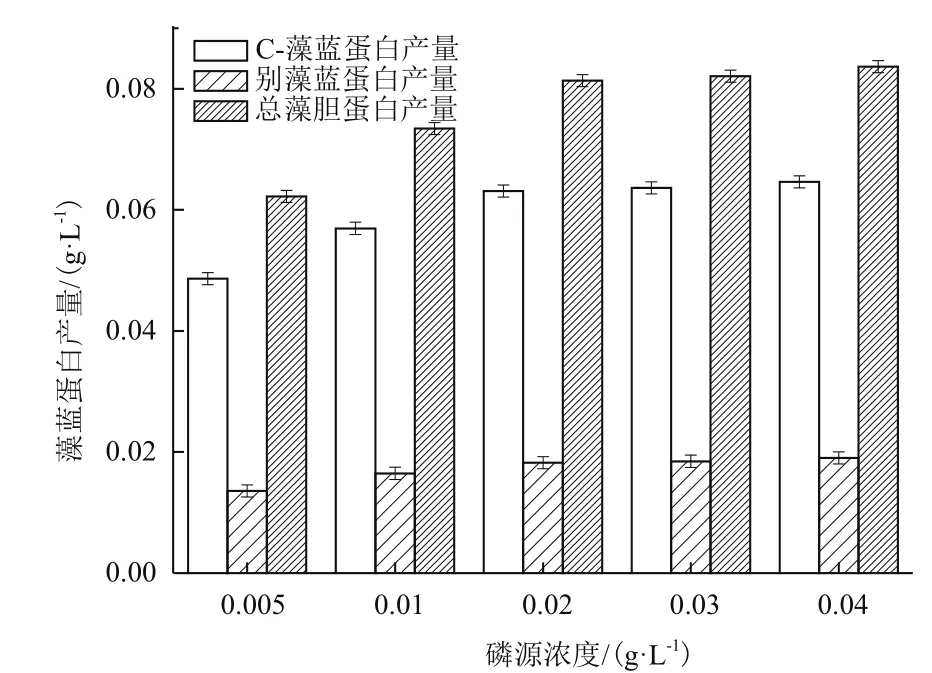
图5 磷源浓度对海水钝顶螺旋藻藻胆蛋白组成及产量的影响
如表2所示,不同处理组海水螺旋藻叶绿素a含量均存在显著差异(P<0.01);磷源浓度0.02 g/L、0.03 g/L、0.04 g/L处理组的类胡萝卜素含量没有显著差异(P>0.05),其余各处理组均存在显著差异(P<0.01)。海水螺旋藻叶绿素a含量随着磷源浓度的增加由0.46±0.005%上升至1.01±0.010%,磷源浓度0.04 g/L处理组含量最高。螺旋藻类胡萝卜素含量随磷源浓度增加有所升高,但变化幅度不大,磷源浓度达0.02 g/L时趋于平稳,类胡萝卜素含量为0.35±0.018%。总体而言,螺旋藻叶绿素a含量随磷源浓度增加而升高,磷源浓度0.04 g/L处理组含量最高,类胡萝卜素含量随磷源浓度增加先升高后平稳。
2.5 磷源浓度对海水钝顶螺旋藻总脂的影响
对第10天不同磷源浓度条件下海水螺旋藻的总脂含量进行测定。如图6所示,磷源浓度0.005 g/L、0.01、0.02、0.03及0.04 g/L处理组的总脂含量分别为7.22±0.68%DW、6.89±0.50% DW、7.94±0.88%DW、7.38±1.02% DW以及8.49±0.76% DW经方差分析可知,在磷源浓度的影响下,各处理组海水钝顶螺旋藻总脂含量差异并不显著(P>0.05)。因此,海水钝顶螺旋藻总脂含量受磷源浓度影响不大。
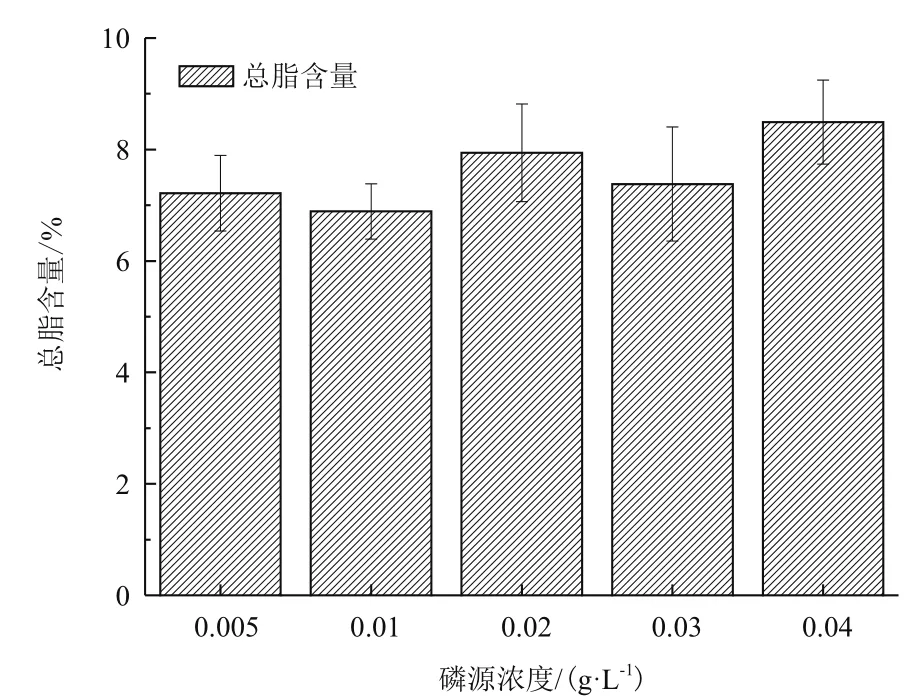
图6 磷源浓度对海水钝顶螺旋藻总脂含量的影响
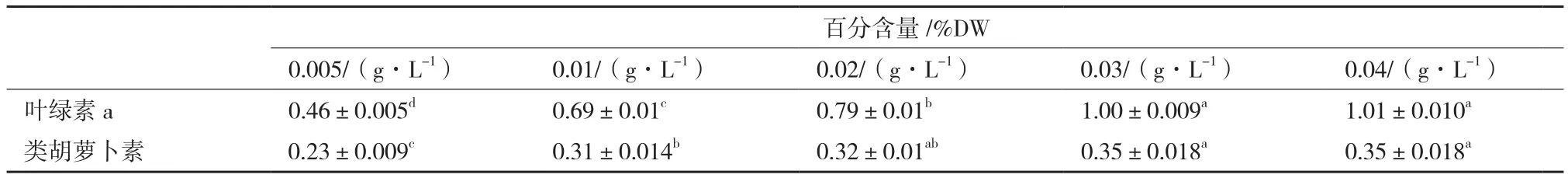
表2 磷源浓度对海水钝顶螺旋藻光合色素含量的影响
2.6 磷源浓度对海水钝顶螺旋藻脂肪酸组成的影响
对第10天不同磷源浓度条件下海水螺旋藻的脂肪酸组成进行测定。如表3所示,海水钝顶螺旋藻脂肪酸组分结构较为简单,碳链长度多为C16-C18的脂肪酸,其饱和脂肪酸主要为C16∶0,多不饱和脂肪酸主要为 γ-亚麻酸(C18∶3,ω-6),其 γ-亚麻酸相对百分含量并无明显规律,磷源浓度0.005与0.03 g/L处理组无显著差异(P>0.05),磷源浓度0.01、0.02与0.04 g/L处理组也不存在显著性差异(P>0.05),但0.005与0.03 g/L处理组 γ-亚麻酸相对百分含量显著高于其他处理组,但最大相对差异仅3.7%,升高幅度不大。
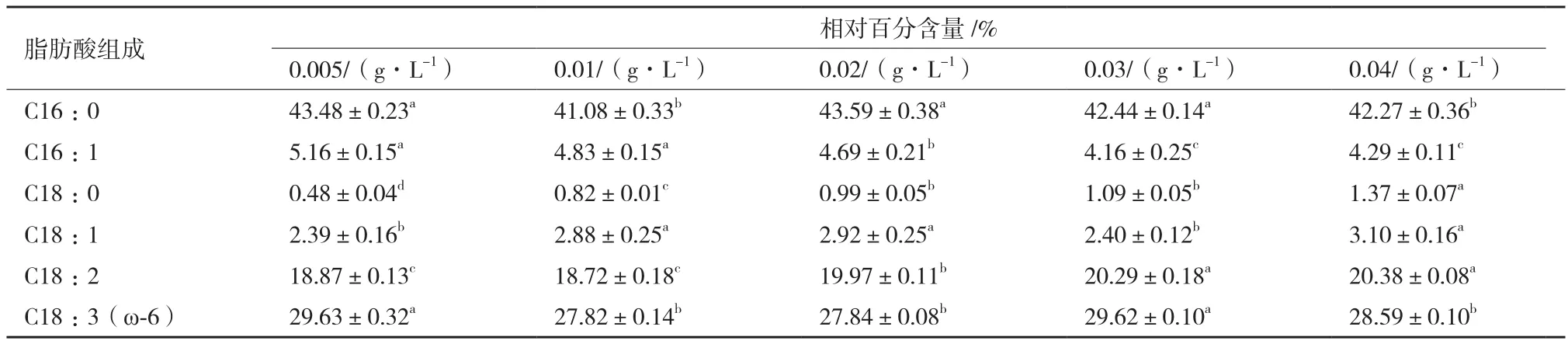
表3 磷源浓度对海水钝顶螺旋藻脂肪酸相对百分含量的影响
3 讨论
3.1 磷源浓度对海水钝顶螺旋藻生长及产物积累的影响
由于在产业应用中,螺旋藻多采取半连续培养,采收时间选择指数生长期末期而非生长减缓的平台期,可获得更高的生物量产率[30],因此,为了更切合生产应用,本研究对处于指数生长末期第10天的海水钝顶螺旋藻进行采收和生化指标测定。
本研究表明,磷源浓度对海水钝顶螺旋藻的生长及生化组分有着重要影响。海水钝顶螺旋藻的生长随着磷源浓度的增加而升高,在磷源浓度为0.04 g/L时,达到最高值。这一点海水钝顶螺旋藻与一些微藻类似,如底栖硅藻[31]等。但也有一些微藻在过高的磷源浓度下生长反而受到抑制,如栅藻在磷源浓度0.2 mg/L时藻细胞浓度达到最大,磷源浓度的进一步增加使栅藻生长受到抑制[32]。由此可以看出海水钝顶螺旋藻能够耐受较高范围的磷源浓度。
低磷条件下海水钝顶螺旋藻优先合成多糖,这一结果与Markou等[16]在淡水螺旋藻中的结果相符。随着磷源浓度的增加,蛋白质、藻蓝蛋白、叶绿素和类胡萝卜素的产量都有显著的升高。因此在生产应用中,可以通过选择较高的磷源浓度促进这些产物的合成积累。如需获得多糖含量高的螺旋藻粉则可以通过降低磷源浓度来实现。
本研究探究了磷对螺旋藻藻胆蛋白含量的影响,结果表明,随着磷源浓度的增加,海水钝顶螺旋藻的C-藻蓝蛋白和别藻蓝蛋白的含量均出现先增加后下降的趋势,目前尚未有开展螺旋藻相关研究的其他报道。同时,由于随着磷源浓度的增加而增加,藻蓝蛋白的产量增加,但磷源浓度达到0.02 g/L后,3组高浓度处理的差异不显著(P>0.05),因此,0.02 g/L的磷源可能是比较适宜藻蓝蛋白积累的合理浓度。
3.2 磷元素对螺旋藻生长代谢影响的生理机制探讨
磷源是微藻生长的必须元素之一,在细胞代谢中,磷是ATP、RNA、DNA、生物膜磷脂等重要生化组分的重要元素[33],与细胞生长、分裂、遗传变异、能量代谢、信号传递和抗逆性等关键生命过程有关。磷是多种酶的辅基,不仅参与碳水化合物的代谢以及脂肪的转化,而且也是叶绿素合成所必需的[34]。由图2和图3中我们可以看出,在海水螺旋藻中多糖含量与蛋白质含量有着类似互补的关系,在低磷条件下,多糖含量最高,蛋白质含量最低,高磷条件则相反。
控制碳水化合物合成的关键酶ADP葡萄糖焦磷酸化酶可被高浓度无机磷抑制,因而无机磷浓度增加会导致碳水化合物合成受阻[35-36]。这一机制可能是本研究中海水螺旋藻多糖含量随磷浓度增加而显著降低的原因之一。
同时,低磷条件下导致RNA,甚至包括DNA和ATP的含量急剧下降[37],蛋白质含量也随之减少,应为低磷条件下多糖含量高的另一个原因。Dean等[38]与 Lynn等[39]报道磷饥饿会导致Anabaena flos-aquae与Stephanodiscus minutulus生物量组成碳水化合物积累,抑制蛋白质合成,与本研究结果相符。同样,磷对光合色素含量的影响可能与磷对蛋白质(酶)的变化相关,因此总体上呈现类似的变化规律。此外,光合色素的变化反过来也影响蛋白质、多糖和能量代谢过程,也不排除其他生理过程的参与。
综上所述,本研究表明,磷对海水钝顶螺旋藻重要产物积累影响十分显著,通过磷源调节可有效定向诱导海水螺旋藻主要高值化产物的合成积累。同时,磷对海水钝顶螺旋藻生长代谢的影响规律也较为复杂,其生理代谢机制有待更加深入地探索,对更好地发展螺旋藻产业极为重要。
4 结论
低浓度的磷源可促进海水螺旋藻多糖合成,磷源浓度增加有利于提高海水螺旋藻蛋白质、藻蓝蛋白、光合色素含量。通过磷源可诱导海水螺旋藻不同的高值化产物的积累,对海水螺旋藻产业化培养与开发具有指导意义。

