酶解条浒苔蛋白制备抗肺癌活性多肽
段训威 肖桂清 王礼兴 吴文林 戴聪杰 董乐
(1. 泉州师范学院,泉州 362000;2. 福建省银丰干细胞工程有限公司,泉州 362000;3. 福建医科大学附属第二医院,泉州 362000;4. 福建省海洋藻类活性物质制备与功能开发重点实验室,泉州 362000)
美国NCI筛选出了几万个天然抗肿瘤化合物,约5%来源于海洋生物,其中来自海洋植物的3.5%具有抗肿瘤活性[1]。我国漫长的海岸线横跨热带、亚热带和温带,复杂的海域地理环境造就了我国海洋生物的多样性,为我国天然药物开发与研究提供极丰富的自然资源。其中浒苔生长迅速,生物量较大,是重要的海洋植物资源。在分类学上,浒苔属(Enteromorpha)属于绿藻门(Chlorophyta),石莼目(Ulvales),石莼科(Ulvaceae),主要有条浒苔、扁浒苔、浒苔、肠浒苔及缘管浒苔5种[2]。2008年绿潮藻类曾在我国黄海中、南部海域爆发成灾,其实浒苔是具有较高营养价值的藻类资源,其干物质中粗蛋白含量约10%-35%,其中条浒苔、肠浒苔(福建海域)粗蛋白含量约34%;浒苔中必需氨基酸与非必需氨基酸的比值(EAA/NEAA)为0.62,且氨基酸种类齐全,其必需氨基酸(EAA)占氨基酸总量(TAA)约40%,氨基酸评分约80,显著高于紫菜(54)和海带(47)[2],是优质的海洋植物蛋白质来源之一。目前,关于浒苔等多数海藻的研究与开发主要集中在碳水化合物,而对其蛋白质及深加工的研究鲜有报道[3-4]。
天然植物蛋白质除提供能量和氨基酸外,一些来自蛋白质原有序列中的小肽还具有多种生理功能,其不易被消化系统酶系降解,具备口服给药发挥生理功能的条件[5]。此外,其相比于小分子化学药物,对目标肿瘤具备高亲和力、高特异性、低毒性[6-7];与抗体药物相比,免疫原性低、组织渗透性强;还具备良好的溶解性与保湿性,高浓度下黏度低、热稳定等物理特性,为规模化生产提供较好的物理特性基础[8-9]。酶解蛋白制备活性小肽是当前较为普遍的技术,酶解具有专一性强、条件温和等优点[10];研究认为,目前酶法制备获得小肽的关键在于蛋白质的来源、酶的选择及酶解工艺的优化与控制[11]。目前已从天然蛋白质原有序列中释放出了如免疫调节肽[12]、降血脂肽[13]、降血压肽[14]、促钙吸收肽[15]、抗肿瘤肽[16]、抗菌肽[17]等功能性肽,其中浒苔在食用、医药和生物医学等方面也表现出具有巨大市场潜力和较高的研究价值。
基于此,本研究以条浒苔(福建海域)为原材料,采用特异性蛋白酶酶解制备功能小肽,分离获得不同分子量区间小肽混合液,以血管内皮细胞(HUVEC)和肺癌细胞(NCI-H446、NCI-H460、A549)为研究对象,体外初步评价酶法制备的条浒苔多肽抗肺癌生物活性。为后续小分子天然活性肽的商业开发、纯化与抗肿瘤机制研究奠定基础,亦为探索条浒苔资源高值化利用提供新途径。
1 材料与方法
1.1 材料
浒苔(干品)由福建福清海兴保健食品有限公司提供(福建海域,条浒苔);木瓜蛋白酶(酶活力:2.0×105U/g)购自南宁庞博生物工程;恒温振荡水浴锅(常州国华电器);冷冻干燥机(东京理化);超滤装置(海滨仪器);倒置荧光显微镜(Nikon TE2000);流式细胞仪(BD FACS Calibur);9602G酶标仪(Perlong);培养瓶、培养板、Transwell(Corning);Hoechst33342、PI染色试剂盒(碧云天生物技术研究所);顺铂、MTT、ECM、VEGF均购自Sigma;高糖DMEM、RPMI-1640、M199、胎牛血清(FBS)购自Gibco;RNase A购自上海生工;血管上皮细胞(HUVEC)、肺癌NCI-H460、NCI-H446、A549细胞均来自ATCC细胞库。
1.2 方法
1.2.1 浒苔蛋白提取、酶解及超滤分离 浒苔60℃烘干粉碎至180目[18],采用碱提酸沉法提取浒苔蛋白,并根据预实验优化的酶解条件:25∶1(W/V)比例加入蒸馏水充分溶胀3 h,调整酶解条件(pH 7.25)后室温放置稳定1 h,加入1 250 U/g木瓜蛋白酶,45.7℃低速振荡酶解120 min,90℃灭活15 min,4 000 rpm离心10 min收集上清液,经微孔滤膜(10 μm)微滤去杂质后,依次通过截留分子量为2 kD、6 kD、12 kD的超滤膜分级超滤,获得多肽各组分冻干备用,根据量效关系预实验,本研究以实验终浓度为0.5 mg/mL的各分子量浒苔多肽处理48 h进行分析研究。
1.2.2 细胞增殖实验 将细胞接种于96孔板(1×105cells/200 μL·孔),待贴壁后,以0.5 mg/mL终浓度的多肽组分II(2 kD<M<6 kD)处理细胞(下面细胞处理方法与此相同),设置PBS处理的空白组,设置1 μg/mL顺铂(DDP)处理的阳性组[19];48 h后MTT法检测并计算细胞的相对增殖率(Relative grow rate,RGR),每组3个复孔,实验重复5次。
1.2.3 细胞氧化应激实验 将HUVEC细胞接种于96孔板(1×105cells /200 μL·孔),待贴壁后,处理同1.2.2,同时设置PBS处理的对照组;37℃、5% CO2培养箱培养48 h后弃培养基,加入DMEM培养基(含10% FBS)稀释的H2O2至终浓度500 μmol/L,以加入同样体积的无菌去离子水作为阴性对照计算相对存活率(Relative survival rate,RSR)。每组3个复孔,实验重复5次。
1.2.4 体外小管形成实验 在4℃条件下过夜融化ECM,用无血清DMEM按2:1稀释后,加入96孔板(60 μL/孔),置于37℃培养箱待ECM凝固,每孔加入100 μL 的 HUVEC 细胞悬液(2.5×105cells/mL),细胞处理同1.2.2,同时设置PBS处理的对照组;置于37℃、5% CO2培养箱培养12 h。倒置显微镜下随机取5个视野观察小管形成情况。每组3个复孔,实验重复5次。
1.2.5 细胞凋亡实验 将肺癌细胞接种于96孔板(1×105cells/200 μL·孔),待贴壁后,细胞处理同1.2.2,同时设置PBS处理的对照组,培养48 h后采用Hoechst33342染色法分析肿瘤细胞凋亡情况,在荧光显微镜下观察蓝色荧光,每组3个复孔,实验重复5次。
1.2.6 细胞迁移实验 在Transwell下室加入500 μL的 M199培 养基( 含 10 ng/mL VEGF、10% FBS),上室加入100 μL的M199(不含FBS),37℃培养箱内平衡1 h;弃上室培养基,每孔加入100 μL肺癌细胞悬液(2.5×105cells/mL),细胞处理同“细胞增殖实验”,同时设置PBS处理的对照组;置于培养箱培养18 h,棉签擦去上室细胞,0.1%结晶紫染色,显微镜观察穿过膜附着在下室的细胞,随机取5个视野拍照,并用Image J软件统计细胞个数,计算迁移率。每组3个复孔,实验重复5次。
1.2.7 细胞周期测定实验 将肺癌细胞接种于6孔板(1×105cells/2 mL·孔),待贴壁后,处理同1.2.5,同时设置PBS处理的对照组;培养48 h后收集各组细胞,1 200 r/min离心5 min,弃上清液,用PBS重复清洗3次后,加入含100 U/mL RNase A的终浓度为5 μg/mL的PI,4℃避光孵育30 min后用流式细胞仪检测细胞周期过程中各期的细胞相对含量。实验重复5次。
1.2.8 统计学分析 所有数据采用SPSS19.0软件分析与处理,计量数据以x-±s表示,组间比较单因素方差分析,P<0.01表现为显著差异,P<0.05表现为差异,均有统计学意义。
2 结果
2.1 浒苔多肽的超滤分离
木瓜蛋白酶在最优条件下酶解条浒苔蛋白质,经超滤得到分子量范围为:I(M<2 kD)、II(2 kD<M<6 kD)、III(6 kD<M<12 kD),各分子量的产物作用浓度0.5 mg/mL,MTT分析抗肿瘤活性。结果(图1)显示,与I、III、PBS组相比较,浒苔多肽组分II对上述三种肺癌细胞的RGR最低(P<0.01),组分II对A549和H446处理组与DDP处理组相比,RGR略低(P<0.05),组分II对H460处理组与DDP处理组相比,RGR差异不大(P>0.05)。因此,选取活性组分II(2 kD<M<6 kD)进行后续的实验研究。

图1 超滤分离不同分子量酶解液对肺癌细胞抑制能力
2.2 浒苔多肽对HUVEC增殖的影响
MTT 检测结果(图2)显示,组分II(0.5 mg/mL)对HUVEC的相对增殖率为83.6%,与PBS组(98.1%)对比差异不大(P<0.05)。2-6 kD的浒苔多肽对正常细胞HUVEC的抑制作用有限。
2.3 浒苔多肽对小管形成的影响
结果(图3)显示,PBS处理组的HUVEC细胞可自行排列,并伸出细丝连接周围其他细胞形成较多节点,长度较长的管腔结构;组分II(0.5 mg/mL)处理的HUVEC细胞呈散点状分布,基本不能连接成环,亦不能形成小管。结果表明,2-6kD的浒苔多肽具有抑制小管的形成。
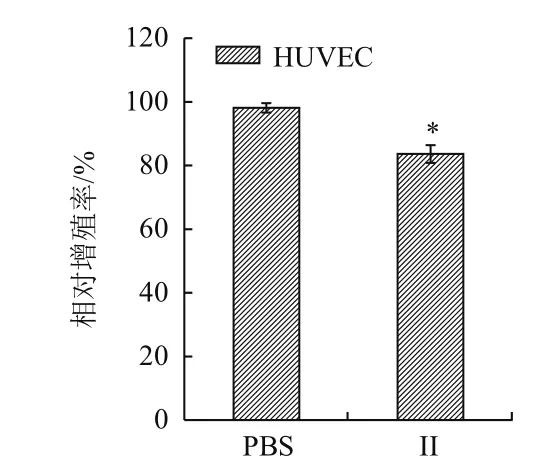
图2 酶解II组分对HUVECs增殖的影响
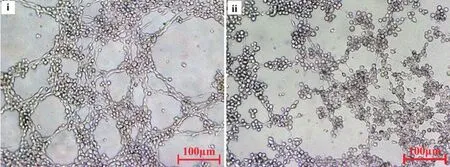
n= 5,x-±s. i:PBS;ii:II group
2.4 浒苔多肽抗氧化作用
结果(图4)所示,组分II(0.5 mg/mL)处理的HUVEC细胞相对存活率为82.1%,与PBS组(41.8%)相比均有极显著差异(P<0.01)。结果表明,2-6 kD的浒苔多肽具有抗氧化作用。

图4 酶解II组分的抗氧化作用
2.5 浒苔多肽对肺癌细胞增殖的影响
结果(图5)显示,组分II(0.5 mg/mL)处理的A549、H446、H460肺癌细胞相对增殖率分别为82.8%、61.9%和58.8%,与PBS组比较有显著差异(P<0.01)。II处理组中,H446和H460相对增值率显著低于A549(P<0.01)。结果表明2-6 kD的浒苔多肽能有效抑制上述3种肺癌细胞的增殖,且对H446、H460的抑制效果好于A549。
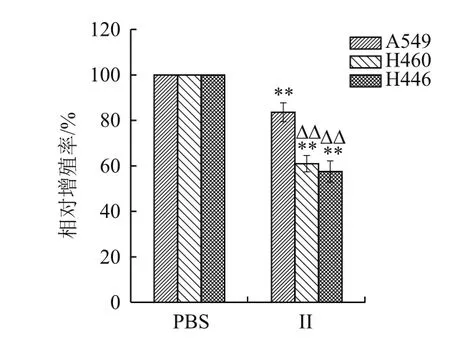
图5 酶解II组分对肺癌增殖的影响
2.6 浒苔多肽对肺癌细胞迁移的影响
结晶紫染色观察结果显示(图6-A),组分II(0.5 mg/mL)处理的三种肺癌细胞迁移数量显著少于PBS组。统计分析表明(图6-B),组分II处理的3种肺癌细胞迁移率与PBS组比较显著差异(P<0.01);II处理组中,H446和H460的迁移率显著低于A549迁移率(P<0.01)。结果表明,2-6 kD的浒苔多肽能够有效抑制上述3种肺癌细胞的迁移,且对H446、H460的迁移抑制强于A549。
2.7 浒苔多肽对肺癌细胞凋亡的影响
荧光显微镜观察Hoechst33342染色的结果(图7)所示,PBS处理组的肿瘤细胞呈现弱蓝色荧光;组分II处理的A549、H446、H460肺癌细胞组出现大量凋亡,细胞核呈现强蓝色荧光;组分II处理组中,H446和H460比A549凋亡更多。结果表明2-6 kD的浒苔多肽能有效诱导上述3种肺癌细胞的凋亡。
2.8 浒苔酶解多肽对肺癌细胞周期的影响
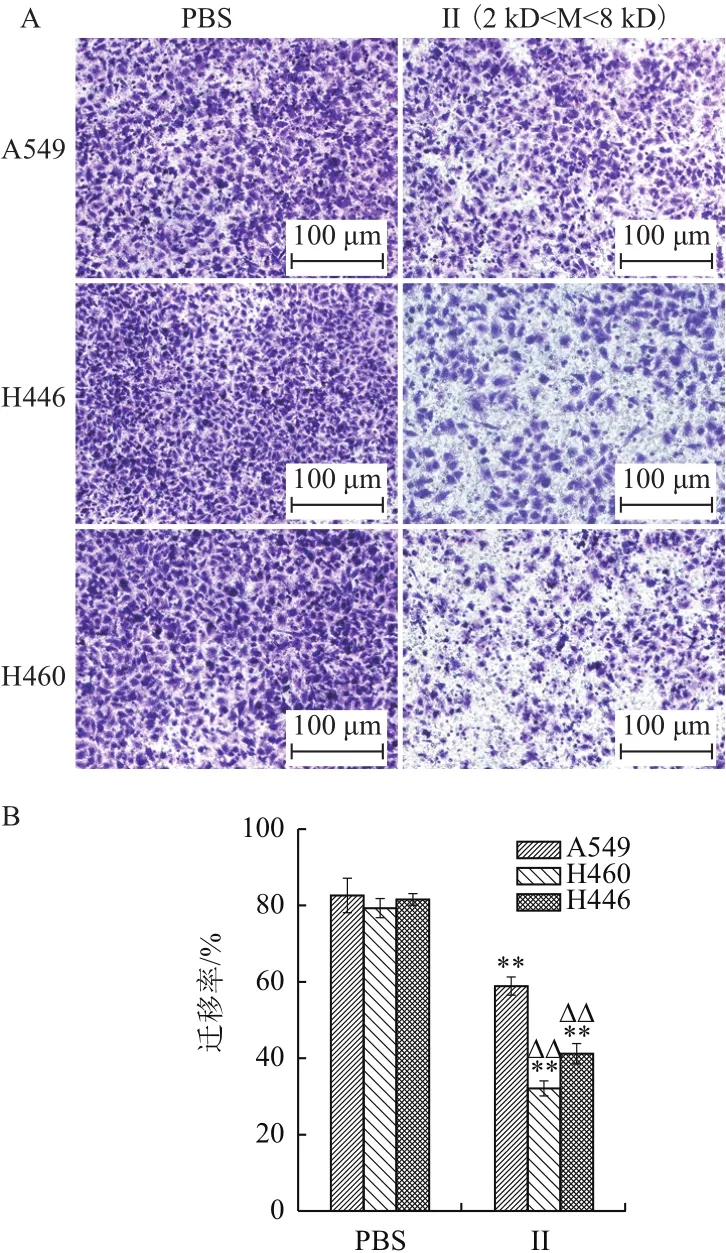
图6 酶解II组分对肺癌细胞迁移的影响
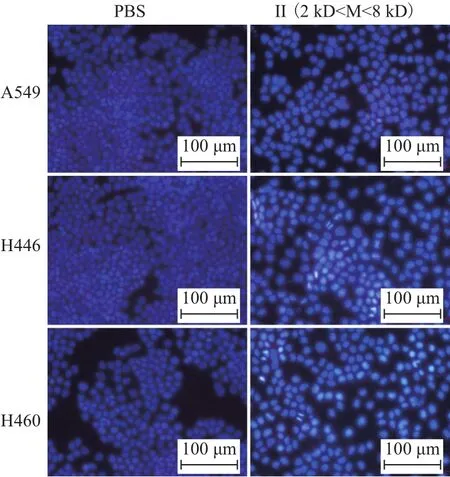
图7 酶解II组分对肺癌细胞凋亡的影响
流式细胞仪对浒苔多肽处理的A549、H446、H460细胞周期时相的时间动力学分析结果(图8-A)显示,所有图中均存在一个较大的碎片峰(图中蓝色部分),可能由于浒苔多肽的作用,导致肺癌细胞膜与胞内物质出现分离,在反复吹打回收细胞时导致部分细胞破裂。G2/M期细胞数统计结果(图8-B)所示,组分II处理的A549、H446、H460肺癌细胞,G2/M期肺癌细胞所占比例分别为13.3%、20.3%和20.8%,显著高于PBS组(P<0.01),且 II处理组H446、H460的G2/M期所占比例与A549也有显著差异(P<0.01)。结果表明2-6 kD的浒苔多肽能阻滞肺癌细胞周期于G2/M期。

图8 酶解II组分对肺癌细胞周期的影响
3 讨论
目前,随着制药技术的更新换代,人们对天然活性小肽的认识不断加深,相对于其他的给药途径,天然小肽类药物的经鼻、肺部或口服等给药途径表现出更具可行性及商业价值[19-20]。天然植物蛋白质释放的小肽是近几年抗肿瘤新型药物的研究热点,其中浒苔属的小分子肽药用研发价值已逐渐被人发掘[21],本研究为条浒苔蛋白质资源高值化利用(功能食品、保健饮料、肽类药物等商业开发)探索提供新的途径。本文充分利用浒苔藻类资源丰富的优势,在前人的研究基础上,通过大量酶解条浒苔蛋白以筛选更多的抗肿瘤活性多肽。研究结果表现为:(1)经木瓜蛋白酶解的小于2 kD和6-12 kD条浒苔多肽对三种肺癌细胞未有明显的抑制作用;其2-6 kD条浒苔多肽对小管形成有一定抑制作用,说明其有抗血管生成能力,间接抑制肿瘤细胞的转移,但其对HUVEC的增殖抑制作用不强,说明其对正常细胞的损害不大;(2)2-6 kD条浒苔多肽可抑制H2O2引起的氧化应激,说明其具有一定的抗氧化能力,该结果与氧化应激是肿瘤一个重要的诱发因素和病理特征的研究结论是一致的[22-23];(3)2-6 kD条浒苔多肽对三种肺癌抑制增殖、促进凋亡、细胞周期阻滞等具有一定的作用效果,表明其有一定的抗肺癌能力;细胞周期的实验结果与目前发现的一些多肽抗肿瘤研究结果一致[24-25],其作用机制还有待进一步研究;(4)2-6 kD条浒苔多肽抑制H446、H460增殖与迁移、促进凋亡、细胞周期阻滞等作用均表现强于对A549细胞的作用,推测可能对小细胞肺癌模型(H446、H460)和非小细胞肺癌模型(A549)的作用机制不同,仍有待进一步研究。
4 结论
经初步筛选及评价,本研究以木瓜蛋白酶最佳酶解条件:料液比1∶25、加酶量1250 U/g pro、温度45.7℃、pH 7.2、震荡酶解时间120 min,酶解条浒苔蛋白获得的2-6 kD的多肽混合液,通过对三种肺癌细胞(A549、H446、H460)和HUVEC处理作用,表明该分子量范围内的多肽混合液中,存在能一定程度抑制小管形成及抗氧化作用,和抑制肺癌细胞增殖、促进凋亡、阻滞细胞周期等作用的小分子多肽,且其抑制H446、H460增殖与迁移、促进凋亡、细胞周期阻滞等作用均表现强于对A549细胞的作用。本课题组下一步将进一步缩小范围,分离纯化解析活性多肽组成,并开展机制和动物实验研究。

