猪伪狂犬病病毒与副猪嗜血杆菌混合感染的综合诊断及感染毒株gE 基因遗传进化分析
焦秋林,王宏宇,马梓承,刘照虎,孟凡亮,李 焱,曹龙龙,刘思当
(山东农业大学动物科技学院,山东泰安 271018)
伪狂犬病(porcine pseudorabies,PR)是由狂犬病病毒(pseudorabies virus,PRV)引起的一种急性传染病。3~4 周龄仔猪病初主要表现为发热、呕吐、下痢、厌食、精神不振,有的可见眼球上翻、视力减退、呼吸困难(呈腹式呼吸),继而出现发抖、共济失调、间歇性痉挛、后躯麻痹、作前进或后退转动、倒地四肢滑动等神经症状,常伴有癫痫样发作或昏睡,肌肉抽搐,最后衰竭而死亡,病死亡率可达40%~60%,部分耐过猪会留有后遗症,如偏瘫和发育受阻等。
副猪嗜血杆菌病是副猪嗜血杆菌(Haemophilus parasuis,Hps)引起的猪多发性浆膜炎和关节炎,主要临床症状为发热、咳嗽、呼吸困难、消瘦、跛行、共济失调和被毛粗乱等。剖检病理变化变现为胸膜肺炎、心包炎、腹膜炎、关节炎和脑膜炎等。此外,Hps 还可引起败血症,并且可能留下后遗症,即母猪流产、公猪慢性跛行等。
PRV 与Hps 混合感染可严重侵害猪的机体免疫功能,更容易使猪群发生继发性感染,导致较高的病死率,所以饲养中的正常预防与免疫显得尤为重要。
1 材料与方法
1.1 试剂与仪器
Simply P 病毒DNA/RNA 提取试剂盒:购自杭州博日科技有限公司;琼脂糖凝胶DNA 回收试剂盒:购自北京天根生化科技有限公司;DMEM/HIGH GLUCOSE:购自赛默飞世尔科技(中国)有限公司;T1 载体及 T1 感受态细胞:购自北京全式金生物技术有限公司;胰蛋白酶-EDTA 消化液等:购自北京索莱宝科技有限公司;BHK 细胞:本实验室冻存;ELISA 试剂盒:购自北京金诺联合科技有限公司。
1.2 样品采集及处理
通过向宿主问诊及对病死猪进行剖检观察,初步怀疑为PRV和Hps混合感染。采集病猪的肾脏、肝脏、肺脏、脾脏、大脑、扁桃体等组织器官病料及其心包积液,其中:一份研磨后放入-80 ℃超低温冰箱保存,用于病原学检查;另一份用10%福尔马林溶液固定,用于组织病理学检测。将心包积液、肺脏和肝脏等组织样品,用于细菌分离与鉴定。
1.3 病毒分离
将所取病料各取0.5 g,加入1 mL PBS 混合研磨至匀浆状态,反复冻融2 次,9 000 r/min 离心3 min,取上清液,经0.22 μm 细菌过滤器过滤后备用;用DMEM 培养液加10%的胎牛血清,用于BHK 细胞培养;使用6 孔培养细胞,待细胞生长至单层时,加入2 mL 通过DMEM 10 倍稀释的病毒上清液,37 ℃感作1~2 h;PBS 清洗一遍后,加入2 mL 2%的胎牛血清维持液,37 ℃培养并连续传代培养3代,收集病毒液。
1.4 病毒鉴定
用Simply P 病毒DNA/RNA 提取试剂盒,提取病毒液核酸。设计猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)、PRV、猪圆环病毒2 型(PCV2)的特异性引物(表1),运用PCR/RT-PCR 技术进行扩增,将扩增产物于1.5%琼脂糖凝胶进行电泳,电泳结束后于紫外凝胶成像系统观察目的条带位置,并判断病原感染情况。

表1 PCR/RT-PCR 引物序列
1.5 组织病理学检测
取出固定于10%福尔马林溶液的组织,常规制作石蜡切片,HE 染色。
1.6 细菌分离
利用血琼脂培养基,用接种环从心包积液、肺脏、肝脏中蘸取病料划板,放于37 ℃培养箱中培养24 h 后观察菌落生长情况。
1.7 细菌鉴定
在1.5 mL 离心管中,装入200 μL 灭菌生理盐水,在血琼脂培养基上,用白枪头随机挑取6 处针尖状、透明单一的完整菌落,与生理盐水混合;以此为模板进行PCR 扩增,将扩增产物于1.5%琼脂糖凝胶进行电泳,电泳结束后于紫外凝胶成像仪观察目的条带位置,判断病猪细菌感染情况。
1.8 药敏试验
将混合菌液用涂布器均匀涂布于培养基上,取药敏片放于培养基,放于37 ℃培养箱,24 h 后观察抑菌圈大小。
1.9 gE 基因序列测定
将上述目的条带所在凝胶部分分离,使用胶回收试剂盒纯化PCR 产物,将胶回收的目的片段连接在T1 载体,转入T1 感受态细胞,培养细菌,鉴定为阳性菌后送往上海生工生物工程技术服务有限公司进行测序鉴定,对测序结果进行分子特征和遗传进化特点分析。
2 结果与分析
2.1 临床剖检
剖检病猪可见,心包积液并见“绒毛”状纤维素性心包炎(图1-A),肺表面有纤维素性渗出物,肺呈暗红色、硬实并见灰白色坏死点(图1-B),肝表面有纤维素性渗出物并见灰白色坏死点(图1-C),脑膜充血(图1-D),扁桃体充血、肿胀并见灰白色坏死点(图1-E),脾表面有纤维素性渗出物并见灰白色坏死点(图1-F)。
2.2 病原检测
琼脂糖凝胶电泳图(图2)显示,检测样品为PRV 阳性。
2.3 病理组织学检测
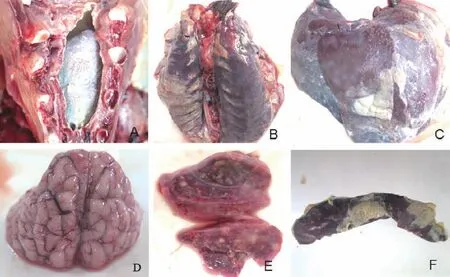
图1 病猪剖检病变

图2 琼脂糖凝胶电泳图
对病理切片镜下观察发现:心外膜表面有纤维素渗出物、炎性细胞浸润(图3-A);肺泡壁毛细血管严重充血,肺泡腔内见少量纤维素渗出(图3-B);肝细胞灶状坏死,坏死肝细胞核浓缩、深染、破碎、消失,坏死灶周围的变性肝细胞核内见红染的包涵体(图3-C);脑组织呈病毒性脑炎病变,血管周围淋巴细胞围管状浸润,呈“袖套现象”,神经元变性坏死并见噬神经元现象并见红染的核内包涵体(图3-D);扁桃体隐窝黏膜上皮细胞变性坏死并见红染的核内包涵体,淋巴组织灶状坏死(图3-E),脾脏淋巴细胞灶状坏死(图3-F)。
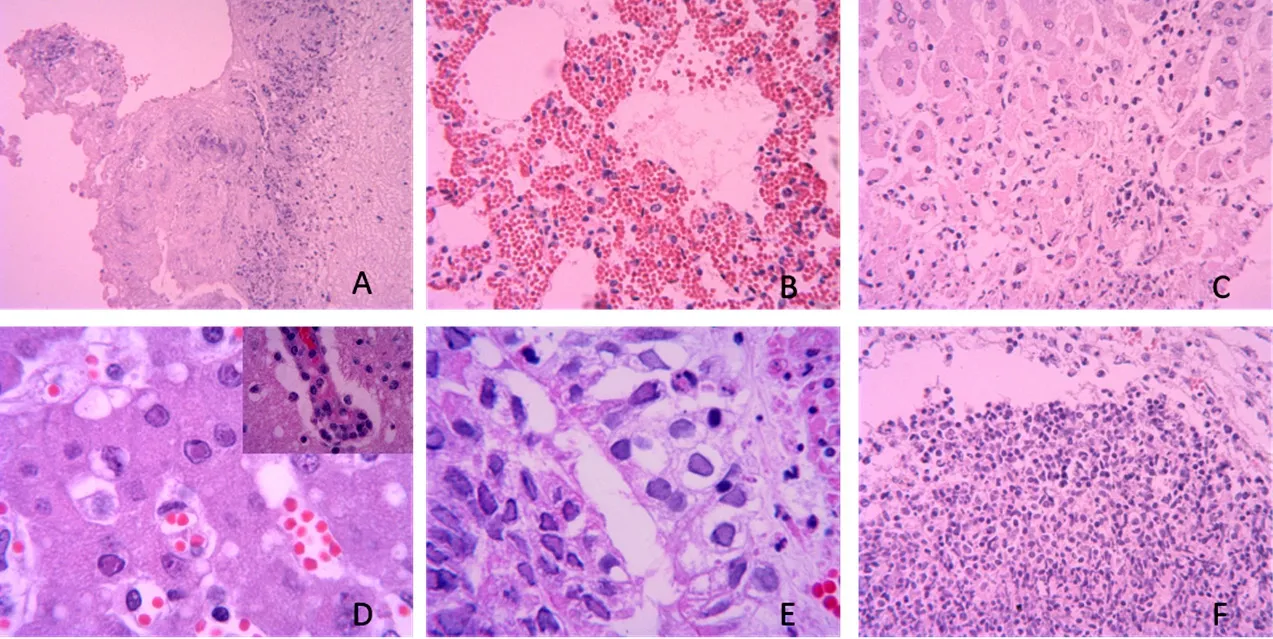
图3 镜检病变结果
2.4 细菌分离鉴定
琼脂糖凝胶图(图4)显示,分离的细菌为Hps 阳性。
2.5 药敏试验
药敏试验结果(图5)显示,根据抑菌圈直径和MIC 解释标准,判定该菌对氧氟沙星、恩诺沙星、丁胺卡那霉素高敏,对阿莫西林、氟苯尼考、多西环素、四环素耐药。
2.6 gE 基因遗传进化分析
2.6.1 病毒分离鉴定 对BHK 细胞培养分离得到的细胞毒,通过PCR 扩增,确定为PRV gE 基因为阳性。通过对病料研磨液的PCR/RT-PCR 鉴定,发现CSFV、PRRSV、PCV2 均为阴性(图2)。
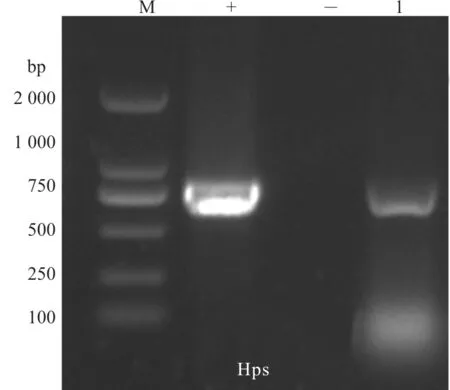
图4 琼脂糖凝胶电泳图
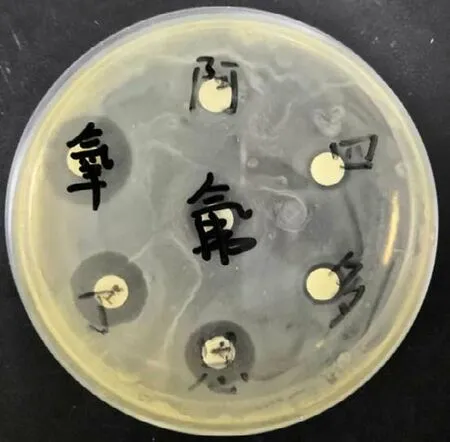
图5 药敏试验结果
2.6.2 核苷酸和氨基酸序列分析 采用DNAstar中的MegAlign 软件,将新分离株(XinTai SD 2019)与参考株的核苷酸和推导氨基酸进行同源性比较。结果(表2)显示:新分离毒株(XinTai SD 2019)与参考株KP257591.1 JS-2012、KF130887.1 HeN 2013、KF017275.1 BJ 2013、KC415028.1 HeB 2013、GQ926932.1 HLJ 2010 的核苷酸同源性最高,为99.9%;与参考株FJ605135.1 Belgium 2010 的核苷酸同源性最低,为97.7%。新分离毒株(XinTai SD 2019)与参考株KP257591.1 JS-2012、KF130887.1 HeN 2013、KF017275.1 BJ 2013、KC415028.1 HeB 2013 的推导氨基酸同源性最高,为99.7%,与参考株FJ605135.1 Belgium 2010 的推导氨基酸同源性最低,为95.3%。
2.6.3 gE 基因遗传演化分析 选取17 株gE 基因参考序列与分离株gE 基因序列,利用 MEGA6 的Maximum-Likelihood 方法构建进化树(图6),发现新分离株(XinTai SD 2019)与KC415028.1 HeB 2013、KF017275.1 BJ 2013 在同一独立分支上,说明该分离株仍是近几年的流行株。
3 讨论

图6 分离株与参考株gE 基因遗传进化树分析
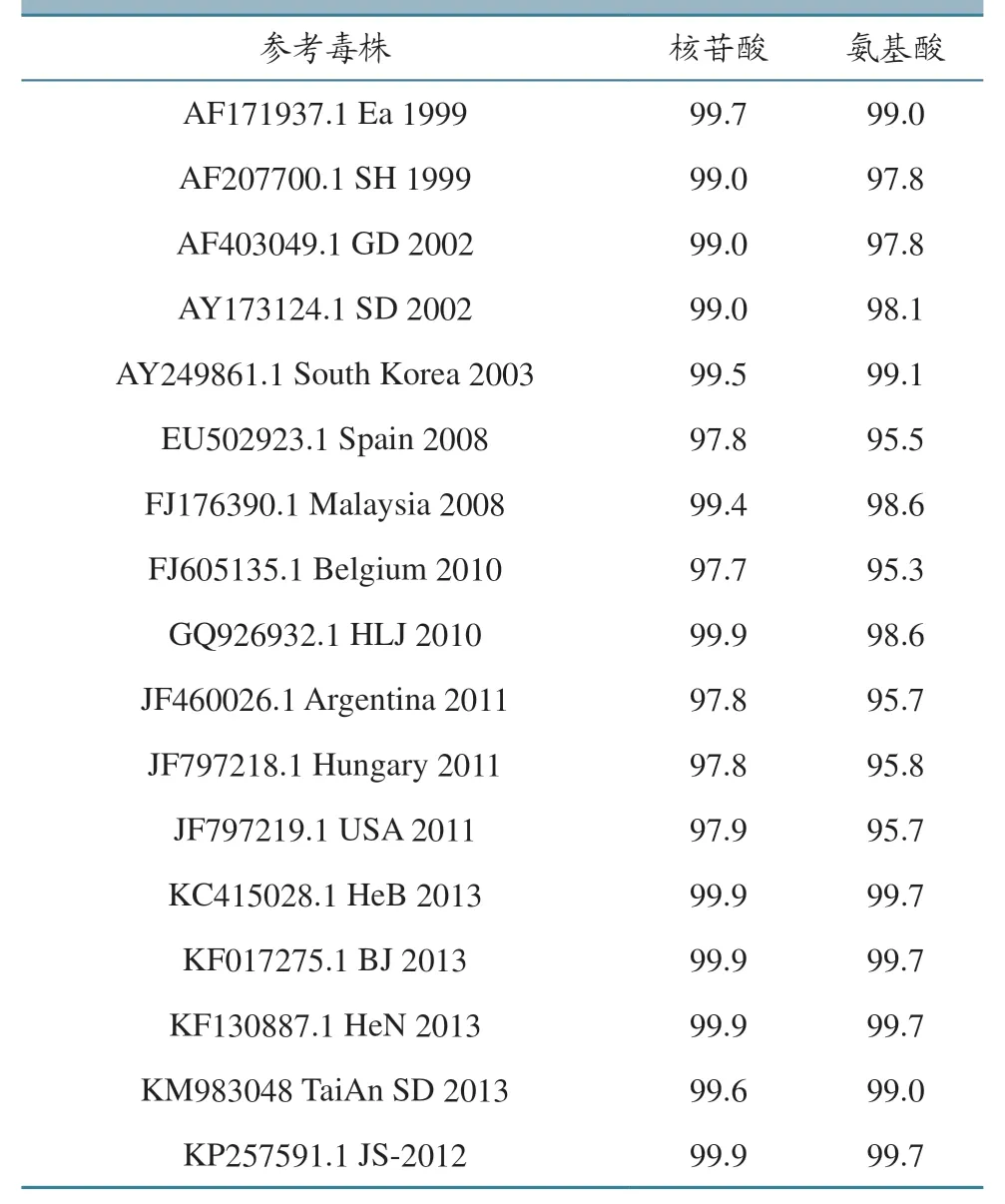
表2 新分离株gE 基因与参考株序列同源性比对结果单位:%
猪感染PRV 后的临诊特征为体温升高,新生仔猪表现神经症状并呈高死亡率,可侵害神经系统、生殖系统、免疫系统、呼吸系统、消化系统等多个系统。PR广泛流行于世界各地,在我国也广泛存在,是最重要的猪传染病之一。Hps 对猪危害较大,其易感动物只有猪。猪感染Hps 后会引起多发性浆膜炎和关节炎,主要表现为发热、咳嗽、呼吸困难、消瘦、共济失调,造成母猪流产,公猪慢性跛行,猪生长发育迟缓,严重影响养猪业健康发展。
通过对新分离株(XinTai SD 2019)的核苷酸和推导氨基酸的对比分析,发现新分离株与欧美参考毒株同源性较低,与我国近期分离毒株同源性较高,仍为我国近几年流行毒株,这为疫苗的选择使用提供了理论依据。
基于混合感染猪难以治愈,建议将症状较重的病猪及时隔离淘汰,症状较轻的病猪肌内注射头孢噻呋钠(5 mg/kg),每日1 次,连用4~5 d;对猪群进行PRV 活苗紧急免疫,同时投喂恩诺沙星和黄芪多糖。经过上述措施后,猪群疫情逐步得到控制。
该猪场在防疫方面未能及时了解购进仔猪的免疫情况,也未能及时进行免疫和药物预防,缺乏生物安全意识,猪场防疫体制不完善,是导致猪群发病的重要因素。
本次病例检测分析表明,仔猪的PRV 与Hps防控压力较大,育肥猪场或自繁自养猪场均应高度重视,做到及时确诊,平时做好免疫预防。

