4 例禽戊型肝炎病例的实验室诊断及ORF2 基因遗传进化分析
张 翔,刘丰波,马 冬,宋姗姗,刘 东,刘红祥,李 彬,王群义,栾栋祖,刘 平,邵三敏
(青岛易邦生物工程有限公司,山东青岛 266000)
禽戊型肝炎病毒(avian hepatitis E virus,aHEV)属于肝炎病毒科、正戊肝病毒属B 种,是一种无囊膜的单股正链RNA 病毒,病毒颗粒呈圆球状,为二十面体对称结构,直径为27~32 nm[1]。世界范围内分离到的aHEV 主要流行4 个基因型:澳大利亚和韩国的基因1 型、美国的基因2 型、中国和欧洲的基因3 型、匈牙利和中国台湾的基因4 型[2]。aHEV 基因组包含3 个开放阅读框(open reading frame,ORF),分 别 为ORF1、ORF2 和ORF3。有研究指出,使用针对ORF2 设计的引物,扩增序列构建的进化树与全基因组序列构建的进化树一致[3]。
2018 年山东、辽宁、吉林、陕西的4 个产蛋期鸡群发病,临床表现为:大群精神良好,采食饮水正常,但持续出现打蔫,每天出现零星死淘,日死淘率为0.1%~0.2%,病程可持续1~2 个月,累计死亡率为5.0%~15.0%。采集病鸡肝脏和脾脏提取RNA,利用RT-PCR 对aHEV-ORF2 基因进行扩增并测序,以期为aHEV 的诊断和深入研究提供分子生物学依据,为我国禽戊型肝炎防控措施的制定提供参考。
1 材料与方法
1.1 材料
1.1.1 病料 采集自山东、辽宁、吉林、陕西4个地区鸡场中疑似aHEV 感染的肝脏和脾脏样品,无菌处理后,置于-20 ℃保存备用。
1.1.2 试剂 RNAout 提取试剂盒:购自天恩泽生物公司;HiScript®II One Step RT-PCR Kit:购自诺唯赞生物公司;DL 2 000 bp DNA Marker:购于宝生物工程(大连)有限公司。
1.2 方法
1.2.1 引物设计 参照GenBank 已公布的aHEV-ORF2 基因核苷酸序列,利用Oligo 6.0 引 物 设 计 软 件,设 计 扩 增aHEV-ORF2 基因的特异性引物。上游引物:aHEV-ORF2-F:5'-F CCCAGCCGGAAGCAGGCGCGG-3;'下游引物:aHEVORF2-R:5'-GGGTGGTGAGGGGAATGTCCTAC-3'。引物由北京华大基因科技有限公司合成,预期扩增目的片段为1 700 bp。
1.2.2 核酸提取 按核酸提取试剂盒和核酸提取仪说明书提取组织RNA。
1.2.3 核酸扩增 用 RT-PCR 一步法试剂盒扩增cDNA:45 ℃反转录30 min;94 ℃预变性3 min;94 ℃变性40 s;53 ℃退火30 s;72 ℃延伸1 min,共30 个循环,72 ℃再延伸10 min;4 ℃保存10 min。PCR 产物用1.0% 琼脂糖凝胶进行电泳,置于凝胶成像系统中观察结果。
1.2.4 序列分析 挑取阳性样品产物送上海生工生物工程技术服务有限公司进行测序。用MegAlign 和Mega 6.0 软件对测定的aHEV-ORF2基因序列与GenBank 中部分代表性毒株序列进行同源性比较和遗传进化分析。
1.2.5 数据统计 统计不同地区发病鸡群的品种、日龄、日死淘率以及检测样品的PCR 阳性率。
2 结果
2.1 病鸡剖检变化
剖检病鸡可见:肝脏肿大、出血、轻微黄染,有小的或斑状的坏死点或坏死斑;肝脏易碎如泥,被膜下有凝血块(图1-A)。脾脏肿大,为正常的2~3 倍,破裂出血(图1-B)。腹部出现卵黄性腹膜炎(图1-C),卵泡萎缩、变形,有的呈“钟摆状”(图1-D)。
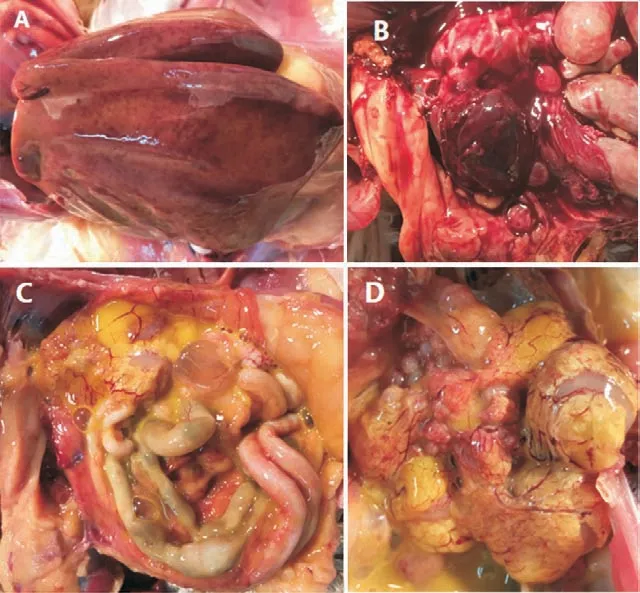
图1 临床发病鸡剖检变化
2.2 RT-PCR 检测
对送检样品处理后进行RT-PCR 检测,发现送检的4 份样品检测到的目的条带大小均约1 700 bp,与目的片段大小一致(图2)。将测序结果与GenBank 比对,结果均为aHEV 阳性。

图2 分离株的RT-PCR 鉴定结果
2.3 统计分析
4 个地区的鸡群均在产蛋期(196~480 d)发病,品种为蛋鸡和肉种鸡,日死淘数量为10~30只(表1)。
2.4 ORF2 核苷酸序列同源性分析
对4 个分离毒株的ORF2 核苷酸序列,利用MegAlign 进行同源性比较。结果(图2)显示,分离株间的ORF2 基因同源性为84.5%~94.5%,分离株与基因1 型的澳大利亚株和韩国株同源性为81.6%~82.8%,与基因2 型的美国原型株和无毒株同源性为80.9%~82.8%,与基因3 型的欧洲株和中国株同源性为80.8%~82.5%,与基因4 型的匈牙利株和中国台湾株同源性为81.4%~82.6%。4 株分离毒株ORF2 核苷酸与已报道的4 个基因型同源性均较低(<84%)。

表1 4 个地区发病鸡群RT-PCR 检测情况统计
2.5 ORF2 基因遗传进化分析
利用Mega 6.0 对4 株分离株的ORF2 基因进行序列比较,绘制遗传进化树。结果(图3)显示:4 株aHEV 均属于戊型肝炎B 种,形成独立的基因分支,但不属于已报道的4 个基因型。
3 讨论
上世纪八九十年代开始,澳大利亚、美国、加拿大等陆续报道了鸡的大肝大脾病(big liver and spleen disease,BLS)或肝炎脾大综合征(hepatitis-splenomegaly,HS)[4-5],2001 年 分 离到病毒并将其命名为aHEV[6]。早在1994 年我国就有该病抗体阳性的报告,2010 年从肉种鸡群中分离到aHEV[7],2014 年从海兰褐鸡群中分离到基因3 型aHEV[8]。血清学调查发现,我国南方鸡群aHEV 血清阳性率约为33.0%[9],广东、山东、黑龙江等地的鸡群血清阳性率约为28.3%。这些血清学调查结果均显示,我国已有aHEV 的广泛流行[10]。但血清学调查结果只能反映鸡群的抗体水平,无法确定鸡群的带毒情况。因病毒分离难度较大,而分子生物学方法操作简单、结果直观、敏感性高、特异性强、重复性好,已被广泛应用于临床检测。ORF2 基因编码蛋白是aHEV 的结构蛋白,其扩增序列构建的进化树与全基因组序列构建的进化树一致,是目前国内外主要的分型依据。
通过RT-PCR 方法,对山东、辽宁、吉林、陕西4 个地区发病鸡群采集的肝脏和脾脏进行检测,均检测到aHEV 阳性,此疾病在蛋鸡和肉种鸡的产蛋期均易流行,持续时间较长,累计死淘率较高,应引起养鸡企业的高度重视。
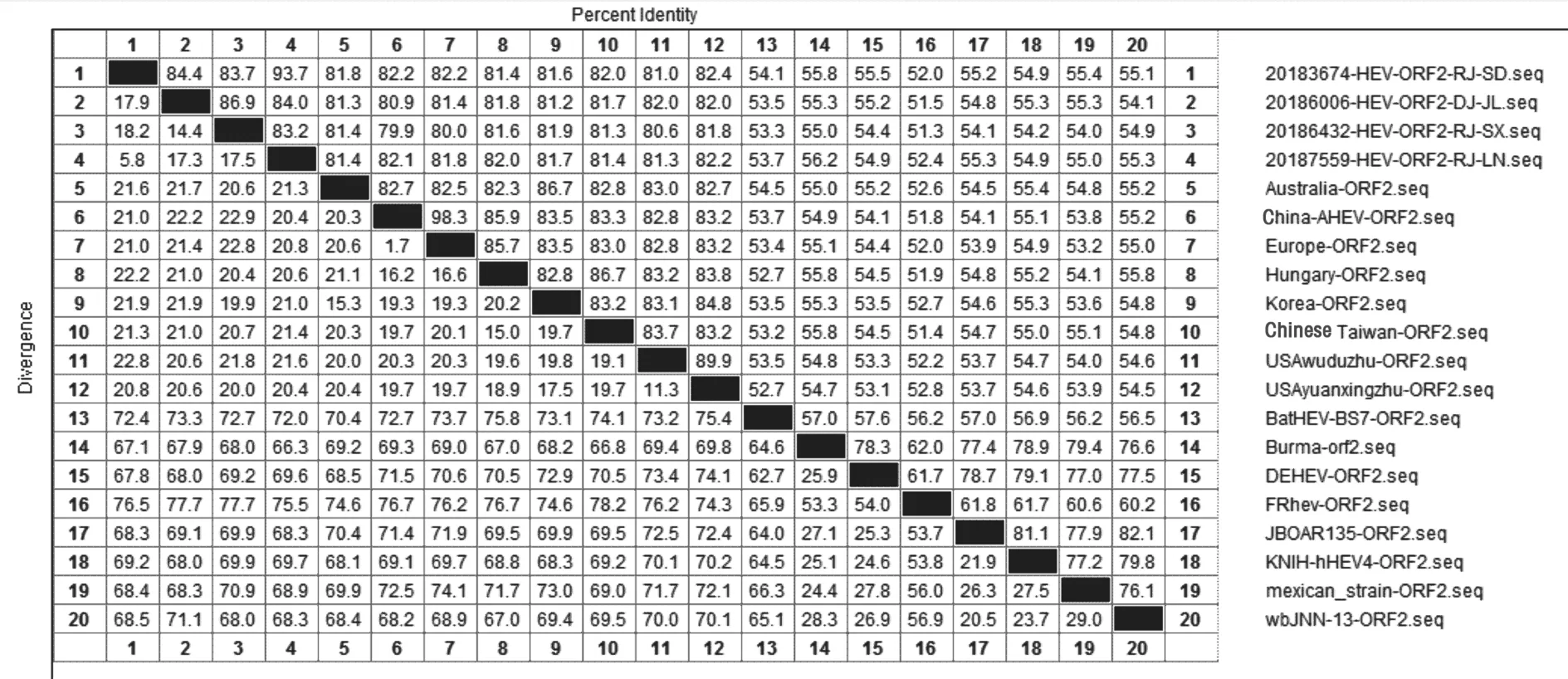
图2 aHEV-ORF2 基因部分序列同源性分析结果

图3 aHEV-ORF2 基因遗传进化树
测序分析发现,检出的4 株aHEV 均属于戊型肝炎B 种,不属于现已报道的4 个基因型,为新亚型。核苷酸同源性比对分析发现,4 株aHEV与已报道的4 个基因型代表株同源性均较低(<84%),4 株分离株之间同源性为84.55~94.5%。目前尚无关于aHEV 新亚型的相关报道,本研究为我国进一步的aHEV 研究提供了基础和依据。
虽有报道称,可采用免疫亚单位疫苗防控aHEV[11],但目前尚无商品化疫苗可用,因此养鸡场只能通过加强生物安全防止本病传入。
4 结论
本研究确诊了山东、辽宁、吉林、陕西4 个地区引起鸡群异常死淘的病因为aHEV 感染;通过ORF2 基因序列比较,发现分离株均属于戊型肝炎B 种,形成独立的基因分支,为新亚型。本试验为我国的aHEV 深入研究提供了基础和依据。

