肝泡状棘球蚴组织中HIF-1α、VEGFA的表达及对血管生成的作用
郭黎姣,姜慧娇,韩欢欢,杨雄峰,周 青,王小义,李林林2,廖振宇2,陈雪玲2,吴向未
包虫病(hydatiddisease,HD)是由棘球绦虫的幼虫阶段引起的一种严重威胁生命的人兽共患病[1],包括泡状棘球蚴病(Echinoccusmultilocularis)和细粒棘球蚴病(Echinococcusgranulosus)。泡状棘球蚴病好发于肝脏,肝泡状棘球蚴病又称为肝泡型包虫病(hepatic alveolar echinococcosis,HAE),其具有肿瘤样浸润性生长和转移的生物特性,损伤肝组织,严重者最终引起肝衰竭[2]。张示杰[3]研究发现,包虫病与血管生成息息相关,肉眼观察泡状棘球蚴组织内外部均有血管生成,可能是泡状棘球蚴病浸润、转移等生物行为的重要环节之一。李佳琦[4]通过双源能量成像碘定量技术对感染泡状棘球蚴的肝脏进行扫描,其结果显示HAE组织内缺乏血供或无血供,边缘区血供明显高于HAE组织及正常肝组织。血管内皮生子因子(Vascular Endothelial Cell Growth Factor, VEGF)家族包括5个因子,特异性作用于损伤的血管内皮细胞,促进骨髓来源的内皮祖细胞迁移和归巢,已被证明病理状态下为恶性肿瘤的血管生成中起至关重要的作用[6],其中VEGFA是血管生成的主要调控因子[5]。缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)是细胞对缺氧反应的主要转录调节因子[7],是介导肿瘤细胞VEGF表达的主要驱动因子,有助于在肿瘤细胞中建立自分泌信号通路,增加肿瘤侵袭性。
本研究在沙鼠肝泡状棘球蚴病模型基础上,通过检测病灶组织中HIF-1α、VEGFA表达水平变化及病灶部位的MVD-CD34的表达,探讨HIF-1α与VEGFA在病变中对病灶局部血管新生的影响。
1 材料与方法
1.1实验动物 实验动物选择健康未育的成年雌性沙鼠126只,8~9周,体重(42±5)g,均购于新疆维吾尔族自治区疾病预防控制中心。泡状棘球蚴头节接种鼠为人工腹腔感染泡球蚴24周灰仓鼠1只。
1.2实验试剂与仪器 VEGFA、CD34单克隆抗体购于美国Abcam公司(ab52917、ab81289);Trizol购自美国Invitrogen公司;逆转录试剂盒购自美国Thermo Fisher Scientific公司;基因引物使用Primer5.0软件合成,由上海生工生物工程公司合成,β-actin(基因号:NM_007393.5):上游引物ACTGCTCTGGCTAGCAC,下游引物ACATCTGCTGGAAGGTGGAC;HIF-1α:上游引物CTGCCACTGCCACCACAACTG,下游引物TGCCACTGTATGCTGATGCCTTAG;VEGFA:上游引物GTACCTCCACCATGCCAAGT,下游引物CTACCAGGGTCTCGATTGGA;荧光染料(SYBR Green Ⅰ)购于德国QIAGEN公司。
1.3沙鼠肝泡状棘球蚴动物模型建立及分组 将126只雌性沙鼠随机分成空白组(6只)、假手术组(60只)、模型组(60只)。将沙鼠麻醉后,碘伏消毒腹部,作剑突下正中切口0.5 cm,逐层开腹暴露肝脏,于肝左叶注射原头节悬混液0.1 mL(原头节提取方法参考文献[8],活原头节约500个),假手术组则注射同体积PBS。沙鼠关腹后置于保温箱恢复体温,常规饲养,模型组、假手术组分别于术后第3 d、7 d、14 d、28 d、42 d、56 d、70 d、84 d、98 d、112 d随机取6只沙鼠,安乐死处死沙鼠。各组标本均取新鲜病灶非切缘区组织,每块标本均包括包虫组织、病灶边缘区及正常肝组织待检。
1.4实时定量PCR(qRT-PCR)检测组织中HIF-1α、VEGFA mRNA表达水平 各组采用Trizol提取组织总RNA,使用反转录试剂盒将RNA逆转录为cDNA后,使用SYBR Green,Bio-Rad CFX Manager 3.1系统进行实时PCR分析。PCR循环由95 ℃ 3 min初始变性,95 ℃ 15 s、60 ℃ 30 s的40个循环组成。以β-actin作为内部标准化参照。采用2-△△Ct法计算mRNA的相对表达水平[9-10]。
1.5病理标本制备及免疫组织化学检测方法 标本采用4%多聚甲醛固定,常规石蜡包埋,以4 μm层厚连续切片及HE染色。免疫组化SP法检测组织中VEGFA、MVD-CD34,步骤根据试剂盒操作说明,DAB显色,苏木素核染,树胶封片。
1.6原位杂交检测HIF-1α mRNA表达 标本用含有1%DEPC的4%多聚甲醛固定,常规石蜡包埋切片,常规脱蜡至水。原位杂交探针为地高辛标记的寡核苷酸,杂交信号检测为DAB显色,具体步骤参考试剂盒说明书进行。阳性表达为细胞核内出现淡黄色至棕褐色染色,判定结果同免疫组化检测判定标准。
1.7免疫组织化学结果判定 参考文献[11],采用作色强度和阳性百分比评分乘积作为最终评分。着色强度:不显色或显色不清为0分,浅棕色为1分,黄色为2分,棕黄色为3分;阳性细胞百分比:高倍镜下随机取3个阳性视野,每个视野计数200个细胞,计算平均阳性细胞百分比,≤5%记0分,6%~25%记1分,26%~50%记2分,51%~75%记3分,>75%记4分。MVD-CD34判断标准:参考文献[12],被抗体染色的单个内皮细胞或细胞团,无论是否呈管腔,均记为1个微血管,管径>8个红细胞直径及汇管区血管排除在外。
2 结 果
2.1组织病理学特点及MVD-CD34结果 模型组沙鼠在感染泡状棘球蚴原头节后早期(感染后14 d内),镜下可见穿刺部位结节状肉芽肿形成,结节内有多个小囊泡,囊泡周围为坏死组织,炎性细胞浸润,结节内MVD-CD34染色阳性,周围正常肝组织紊乱,肝窦扩张,大量红细胞浸润;病灶中期(感染后14~56 d)HAE病灶可见囊壁生发层和角质层形成,角质层外肝细胞间MVD-CD34呈高表达,偶可见炎性细胞、内皮样细胞浸润的增殖区;病灶晚期(感染后56 d到终末期)HAE组织呈大小不等囊泡,囊泡周围有明显的纤维化带,MVD-CD34低表达,正常肝组织血管扩张明显(见图1、2)。假手术组肝细胞可见不同程度的气球样变;空白组呈正常的肝组织结构。
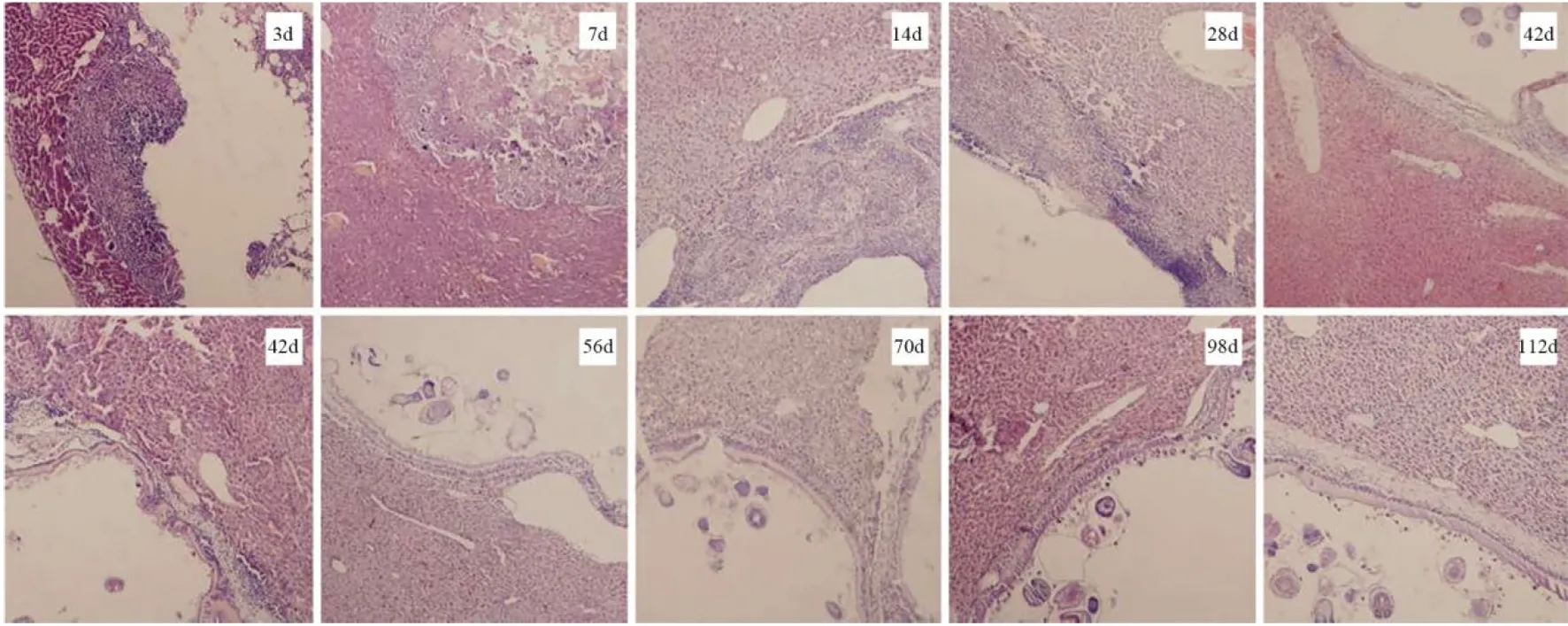
注:分别为造模后3 d、7 d、14 d、28 d、42 d、56 d、70 d、84 d、98 d、112 d图1 沙鼠感染原头节后不同时期的沙鼠肝脏组织HE染色(40×)Fig.1 HE staining of gerbil liver tissue at different stages after gerbil infection in the primordial section (40×)

注:空白组;假手术组;造模后3 d、7 d、14 d、28 d、42 d、56 d、70 d、84 d、98 d、112 d图2 不同时间沙鼠肝泡状棘球蚴组织边缘区MVD-CD34染色(200×)Fig.2 MVD-CD34 staining of the marginal zone of the genital alveolar echinococcosis at different times (200×)
2.2HIF-1α、VEGFA mRNA表达水平 模型组沙鼠肝泡状棘球蚴组织边缘区HIF-1αmRNA在术后随着感染时间延长,其表达量呈先升高后下降再升高趋势;术后14 d其表达量(4.653±1.397),高于空白组(1.000±0.001),低于假手术组(10.567±1.715),差异具有统计学意义(F=82.732,P<0.001);术后42 d时,HIF-1α mRNA表达量最高(26.712±3.747),显著高于空白组(1.000±0.002)、假手术组(1.230±0.233),差异具有统计学意义(χ2=11.536,P<0.003);模型组HIF-1α mRNA术后42 d后开始下降,术后84 d 再次升高,术后112 d HIF-1α相对表达量为(11.343±2.439),均高于空白组(1.000±0.002)、假手术组(0.472±0.051),差异具有统计学意义(χ2=15.189,P<0.001)。模型组沙鼠肝泡状棘球蚴组织边缘区VEGFA mRNA表达趋势与HIF-1α mRNA表达趋势相似,在术后14 d其表达量(0.305±0.034)低于空白组(1.00±0.001)、假手术组(1.648±0.141),差异具有统计学意义(χ2=15.174,P<0.01);随着感染时间延长,术后42 d时表达量最高(2.912±0.123),与空白组(1.000±0.002)、假手术组(0.478±0.099)比较,差异具有统计学意义(χ2=15.158,P<0.01);术后112 d时其表达量(1.823±0.113),均高于空白组(1.000±0.001)、假手术组(0.352±0.172),差异具有统计学意义(χ2=15.158,P<0.01),见图3。
2.3HIF-1α、VEGFA、MVD-CD34蛋白染色结果 HIF-1α原位杂交结果显示,空白组、假手术组HIF-1α mRNA表达均为阴性,模型组术后第14 d HIF-1α mRNA主要表达在病灶炎性细胞、内皮细胞核中,边缘区肝细胞及间质细胞呈阴性表达;术后第42、112 d HIF-1α mRNA主要在病灶边缘区肝细胞、内皮细胞细胞核内表达。随着沙鼠感染泡状棘球蚴原头节时间不同,HIF-1α表达程度不同,呈先升高后下降趋势,术后第42 d表达最高,与空白组、假手术组及其他时间点比较,差异具有统计学意义(P<0.05),见图4,表1。
VEGFA免疫组化阳性表达部位以泡状棘球蚴组织边缘区内皮细胞、肝细胞胞浆及胞外。随着沙鼠感染泡状棘球蚴原头节时间点不同,VEGFA在边缘区表达程度不同,呈先升高后下降趋势,术后第42 d边缘区VEGFA表达最高,与空白组、假手术组及及其他时间点比较,差异具有统计学意义(P<0.05),见图5,表1。
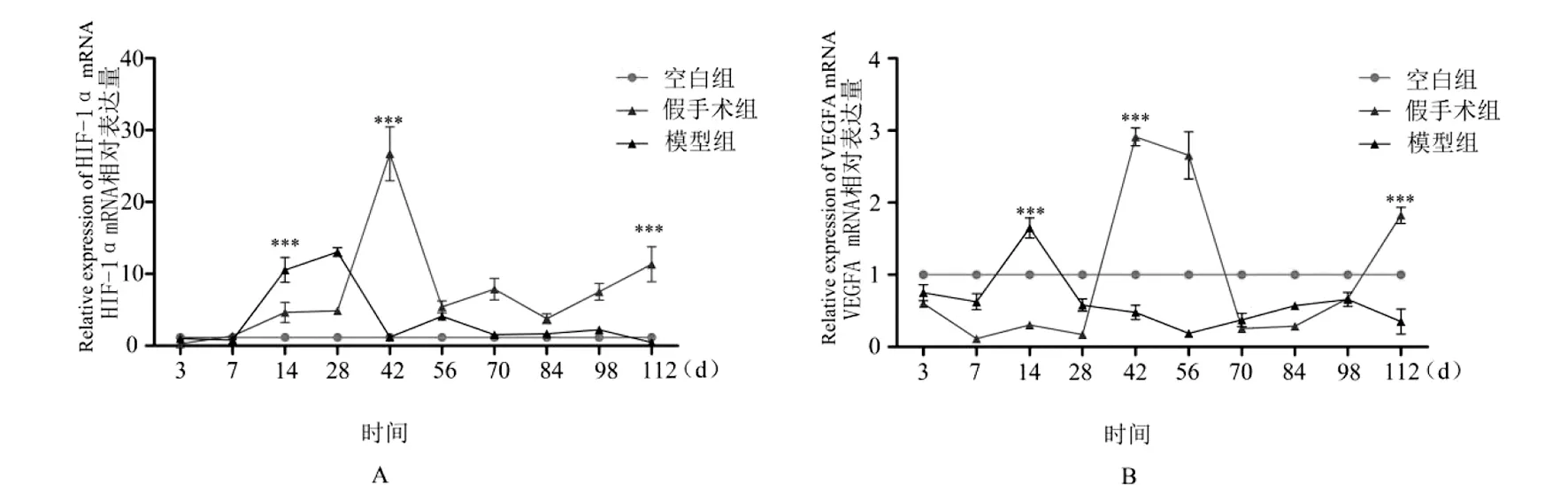
注:**P<0.01; ***P=0.001;A不同时间点各组HIF-1αmRNA表达水平;B不同时间点各组VEGFA mRNA表达水平。 图3 不同时间点各组HIF-1α、VEGFA mRNA表达水平Fig.3 HIF-1α and VEGFA mRNA expression levels in each group at different time points


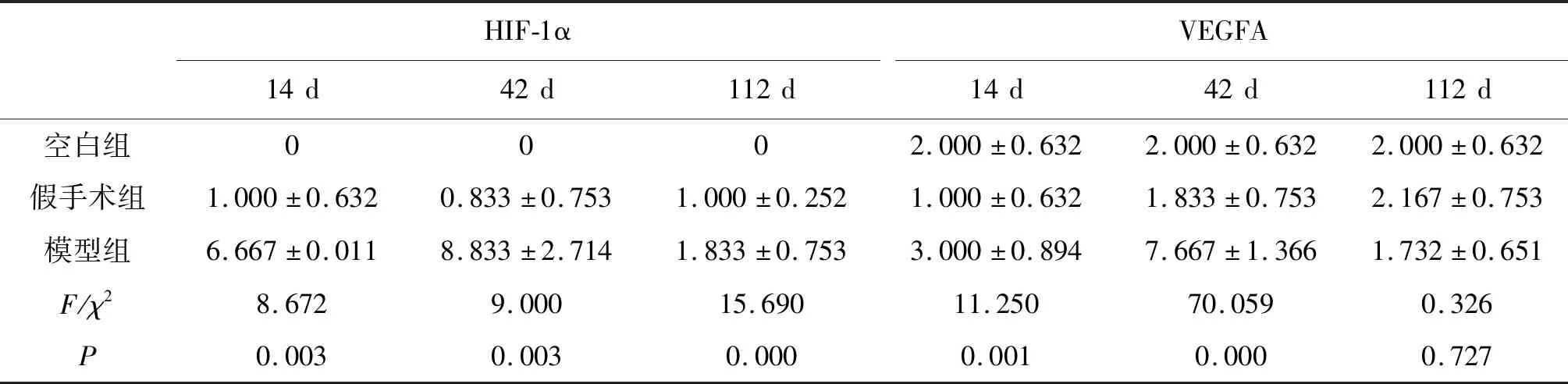
HIF-1αVEGFA14d42d112d14d42d112d空白组0002.000±0.6322.000±0.6322.000±0.632假手术组1.000±0.6320.833±0.7531.000±0.2521.000±0.6321.833±0.7532.167±0.753模型组6.667±0.0118.833±2.7141.833±0.7533.000±0.8947.667±1.3661.732±0.651F/χ28.6729.00015.69011.25070.0590.326P0.0030.0030.0000.0010.0000.727

图4 沙鼠感染泡状棘球蚴后不同时期HIF-1α mRNA表达(200×)Fig.4 HIF-1α mRNA expression in gerbils infected with Echinococcus granulosus (200×)
CD34免疫组织化学结果显示,空白组、假手术组除汇管区、中央静脉外无CD34阳性表达;模型组沙鼠在感染泡状棘球蚴原头节后第14 d CD34主要表达在纤维囊壁形成部位;第42 d外囊壁形成晚期囊壁形成后,外囊壁外侧边缘区肝细胞间CD34呈高表达,与空白组、假手术组及及其他时间点比较,差异具有统计学意义(P<0.05),见图6,表2。
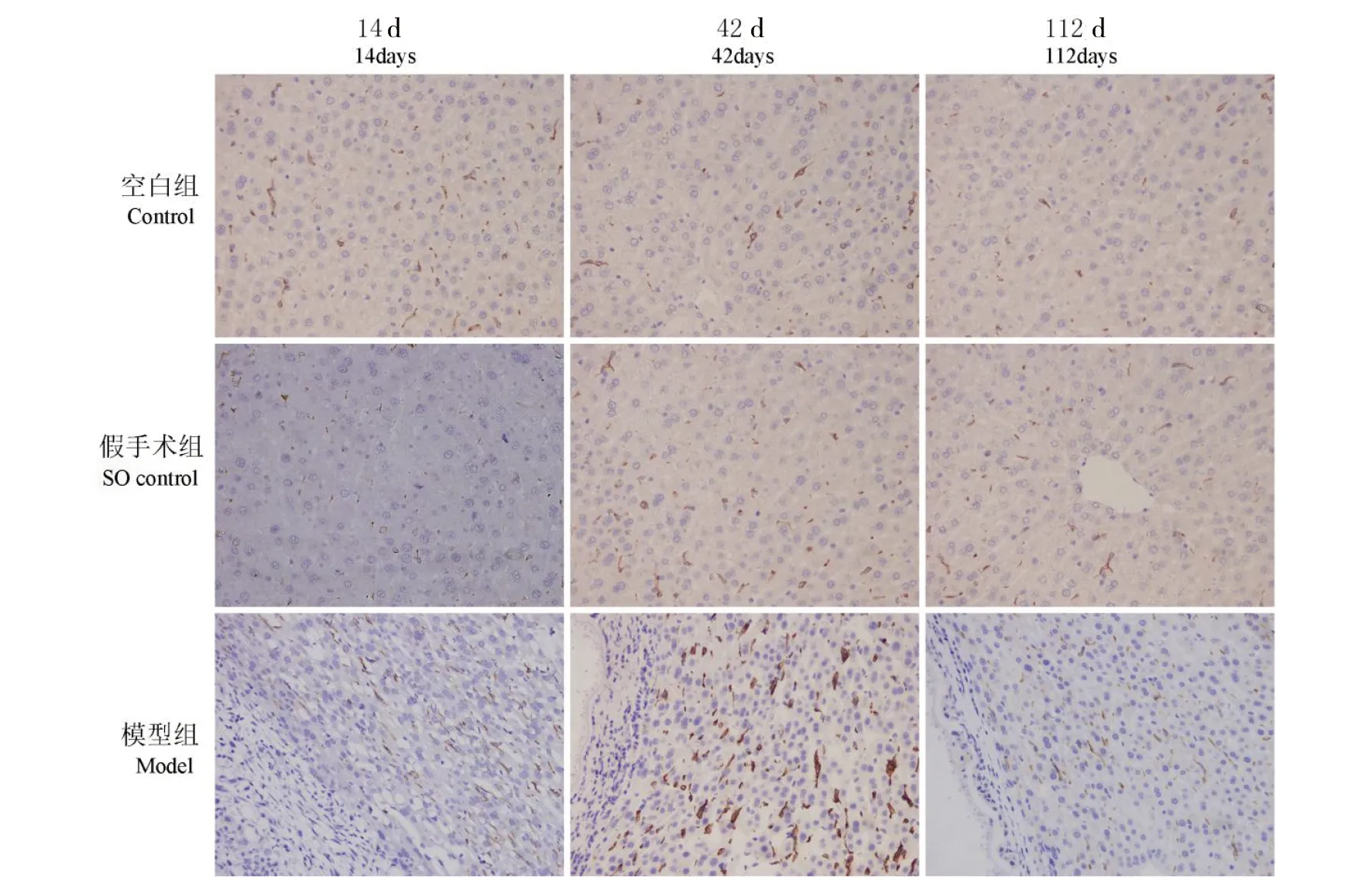
图5 沙鼠感染泡状棘球蚴后不同时期VEGFA表达(200×)Fig.5 VEGFA expression in different periods after gerbils infected with Echinococcus granulosus (200×)

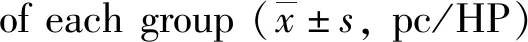
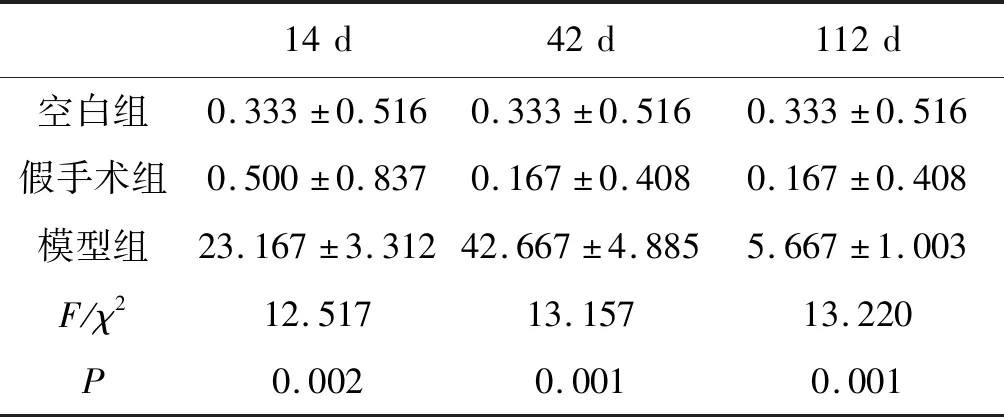
14d42d112d空白组0.333±0.5160.333±0.5160.333±0.516假手术组0.500±0.8370.167±0.4080.167±0.408模型组23.167±3.31242.667±4.8855.667±1.003F/χ212.51713.15713.220P0.0020.0010.001
3 讨 论
本次研究在沙鼠泡状棘球蚴动物模型的基础上,根据沙鼠肝脏感染泡状棘球蚴原头节时间不同,其病理变化呈动态改变,通过病灶形态及特点大致分为3期:感染原头节早期14 d内,病灶呈结节状“肉芽肿”,血管新生伴大量巨噬细胞、淋巴细胞等炎性细胞浸润,随着感染时间延长,病灶中心出现坏死区;感染中期(14 d~56 d)泡状棘球蚴组织典型生发层和角质层开始形成,且角质层外可见炎性细胞、内皮细胞浸润的增殖区;感染晚期(56 d后)泡状棘球蚴组织可见大小不等的囊泡,囊泡周围有明显的纤维化带,与周围正常肝细胞界限明显,周围正常肝组织内血管扩张明显,病灶三期病理特征变化,与相关研究[13]相符,病程进展与接种原头节数量、宿主种类及宿主与原头节之间的耐受性密切相关[14]。
早期对肝泡状棘球蚴病研究过程中,血管生成常被忽视,随着对泡型包虫病的研究深入,血管生成在其病程进展中的作用越来越受到关注。Liu等[15]通过采用CT灌注检测HAE病变的微循环,其结果显示HAE病变边缘区有不同程度的血液灌注,且血流量、血容量及微血管密度具有很好的相关性。泡状棘球蚴原头节感染肝脏后,细胞生成因子及趋化因子是炎性细胞及髓样细胞向病变局部归巢的主要作用因子,同时也是病灶向周围正常肝组织细胞浸润的重要因子[16]。泡状棘球蚴组织边缘区的血管生成不仅与炎症细胞进出病灶部位参与免疫逃逸有关,而且与病灶向周围正常组织浸润和远端转移相关[14]。本次研究通过对沙鼠感染泡状棘球蚴原头节后不同时间点的CD34表达观察,其结果显示病灶边缘区CD34呈阳性表达,且随着感染原头节时间延长,病灶边缘区CD34表达不同。病灶早期以结节状肉芽肿形成为主,血管生成伴大量炎性细胞浸润,周围正常肝组织无血管生成;中期随着病灶中心坏死区扩大,外囊壁的逐渐形成,微血管向周围正常肝组织中生长,包虫外囊壁周围正常肝组织内可见MVD-CD34阳性表达,偶可见炎性细胞、内皮细胞浸润的增殖区;晚期至终末期,MVD-CD34阳性表达较早、中期显著减少。沙鼠肝泡状棘球蚴组织边缘区血管生成在病程的早、中期最为显著,其中病灶中期微血管向周围正常肝组织内浸润生长,可能是泡状棘球蚴组织呈肿瘤样浸润生长的重要因素。
缺氧是肝脏局部炎症和血管生成的主要诱导因子,可以作为刺激血管生成的单独因素[17-18]。缺氧诱导因子-1α(HIF-1α)是真核细胞缺氧反应的关键转录因子和O2稳态的主要调节因子。缺氧条件下,由于缺乏羟化酶所需的激活物,导致HIF-1调胞质内蓄积[19],发生核转位并与HIF-1β二聚化。HIF二聚体与靶基因启动子中的缺氧原件(HRE)结合,上调许多血管生成基因的表达诱导血管生成中的细胞增殖和分裂[20],包括VEGF、PLGF、PDGFB、AngPT1、AngPT2等,其中VEGF/VEGFR被认为是肿瘤血管生成的主要调控系统。VEGFA是VEGF家族中主要成分,参与肿瘤生长、侵袭、血管生成等过程,是促血管生成的最重要因子[21]。沙鼠感染泡状棘球蚴原头节后不同时间点泡状棘球蚴组织边缘区HIF-1α与VEGFA的mRNA表达特征(图3),提示在肝脏感染泡状棘球蚴原头节后,局部病灶中HIF-1α可能对VEGFA的表达具有调控作用。结果表明(图4,5,6),HIF-1α mRNA在沙鼠肝泡状棘球蚴组织边缘区有不同程度的表达,其中术后42 d病灶外囊壁外侧肝细胞、内皮细胞细胞核内表达最显著,局部VEGFA、MVD-CD34同样高表达;随感染时间延长,感染56 d后HIF-1α mRNA表达降低,VEGFA、MVD-CD34表达量随之降低,这一时相在病变边缘区可能存在HIF-1α上调VEGFA的表达促进血管生成的级联反应,以满足泡状棘球蚴原头节生长所需的氧及其他营养物质,具体级联通路有待更深入研究。在病灶早期,结节状肉芽组织局部炎症反应明显,炎性病灶与周围肝组织无明显界限,HIF-1α在内皮样浸润细胞核中高表达,肉芽组织中大量微血管生成,而VEGFA在炎症局部表达不明显,在周围肝组织内呈高表达,考虑在病灶早期,肉芽肿内血管生成主要与缺氧引起的炎症反应、纤维化有关。
肝泡状棘球蚴组织向周围正常肝组织呈浸润生长,加大了手术治疗的难度。血管生长是泡状棘球蚴组织浸润性生长的关键因素之一。了解泡状棘球蚴组织在发生发展中血管生成情况及其血管生成机制可能是治疗该疾病的关键所在,有望为该疾病靶向治疗提供新思路。
利益冲突:无
引用本文格式:郭黎姣,姜慧娇,韩欢欢,等.肝泡状棘球蚴组织中HIF-1α、VEGFA的表达及对血管生成的作用[J].中国人兽共患病学报,2019,35(7):639-646. DOI:10.3969/j.issn.1002-2694.2019.00.083

