基于线粒体ND6基因检测犬感染细粒棘球绦虫的粪便PCR方法
2
细粒棘球绦虫(Echinococcusgranulosus,Eg)的生活史较为复杂,要通过中间宿主—某些家畜(如牛、羊等食草动物)和终末宿主犬科动物来共同完成,其中细粒棘球绦虫的中绦期幼虫-细粒棘球蚴主要寄生在中间宿主的肝脏和肺脏内,从而引起细粒棘球蚴病(囊型包虫病)(Echinococcosis)[1-2]。该病为一种人兽共患寄生虫病,呈世界性分布,其中我国属高发地区之一,目前至少有368个流行县[3],主要流行于青海、新疆、西藏、四川西北部牧区以及宁夏。现该病已被列为我国《国家中长期动物疫病防治规划》(2012-2020)年优先防治和重点防范的动物疫病[4]。
犬是细粒棘球绦虫最重要的终末宿主和传染源。犬吞食棘球蚴后,原头蚴在其小肠内经40~50 d便可发育为成虫,成虫在犬体内的寿命为5~6个月。成虫孕节及虫卵随犬粪排出并污染食料、水源及环境,中间宿主经口食入虫卵而受到感染,从而引起囊型包虫病[5]。如能及时准确地掌握犬感染细粒棘球绦虫的情况,对人和动物包虫病的防控均具有重要意义。
随着分子生物学技术的发展,线粒体DNA(mtDNA)基因已被广泛应用为生物分子诊断标记及分子遗传标记[6-9]。线粒体ND6基因(ND6)全序列长度相对较短,结构简单无内含子,进化速率适中,序列变异丰富,突变率显著高于核DNA,目前已被广泛应用于牦牛、鱼类及昆虫的种群遗传结构分析[10-13]。本研究选择细粒棘球绦虫的ND6基因作为分子标记,进行了犬粪中细粒棘球绦虫DNA的分子检测及基因分型研究。
1 材料与方法
1.1样品收集 细粒棘球绦虫(18日龄童虫虫体)、孟氏迭宫绦虫(Spirometramansoni)、豆状带绦虫(Taeniapisiformis)、犬复孔绦虫(Dipylidiumcaninum)、多头带绦虫(Taeniamulticeps)、泡状带绦虫(Taeniahydatigena)及犬弓首蛔虫(Toxocaracanis)样品DNA由四川农业大学动物寄生虫病研究中心提供;多房棘球绦虫(Echinococcusmultilocularis)样品DNA由中国CDC上海寄生虫病研究所党志胜博士惠赠。
1.2粪样收集 对2只家犬(1号犬 、2号犬)进行药物驱虫后,每只饲喂约50 000条的原头蚴。感染第3 d到18 d,每天分别收集2只犬的粪便;40份待检临床犬粪随机采自四川省甘孜州包虫病流行区,由甘孜州动物疫病预防控制中心采集并提供;豆状带绦虫(5份)、多头带绦虫(5份)及泡状带绦虫(2份)的犬粪由四川农业大学动物寄生虫病研究中心提供。将以上所有粪样均置于-80 ℃ 2周以上进行无害化处理。
1.3 方 法
1.3.1提取粪便DNA 按照Qiagen DNeasy Powersoil试剂盒(Qiagen, Carlsbad, CA)说明书提取犬粪便DNA。
1)将60 μL Solution C1加入到PowerBead Tubes中混匀;2)再次加入约0.25 mg的犬粪样品到PowerBead Tubes后轻轻涡旋混匀;3)把PowerBead Tubes固定在涡旋仪适配器上,3 200 r/min涡旋连续振荡10~20 min;4)室温下10 000 g离心PowerBead Tubes 30 s,转移上清至一个干净的2 mL Collection Tube中;5)加入250 μL Solution C2到上清中,涡旋混匀5 s,4 ℃孵育5 min;6)室温10 000 g离心Collection Tube1min,转移上清≤600 μL到一个新的收集管中;7)加入200 μL Solution C3到上清中,涡旋混匀,4 ℃孵育5 min;8)室温10 000 g离心Collection Tube 1min,转移上清≤750 μL到一个新的收集管中;9)加入1 200 mL摇匀的Solution C4到上清中,涡旋混匀5 s;10)加载约675 μL上清到 Spin Filter中,室温10 000 g离心1 min,弃去滤液;11)重复9)直至过滤完所有上清;12)加入500 μL Solution C5到MB Spin Filter中,室温10 000 g离心30 s,弃去上清;13)室温10 000 g离心MB Spin Filter 1 min,并小心转移MB Spin filter到2 mL Collection Tube中,尽量避免Solution C5污染;14)加入100 μL Solution C6到白色滤膜中心,室温10 000 g离心30 s;15)弃去Spin Filter。此时收集管中的DNA可立即进行PCR的使用或者储存于-20 ℃备用。
1.3.2引物设计 对GenBank(https://www.ncbi.nlm.nih.gov/)中细粒棘球绦虫G1-G10型线粒体全基因组序列进行比对,筛选出可扩增ND6全基因的保守区域以设计合适的引物。上游引物A1:5′-TTTCGTGCTGTAGATGGT-3′,下游引物A2:5′-CACAGATTTCAAAGGGTT-3′,扩增片段为558 bp。COX1基因片段序列(366 bp)扩增引物,参考相关文献[14]进行设计。上游引物JB3:5′-TTTTTTGGGCATCCTGAGGTTTAT-3′,下游引物JB4.5:5′-TAAAGAAAGAACATAATGAAAATG-3′。2对引物序列均由生物生工工程(上海)股份有限公司合成。
1.3.3ND6基因的PCR扩增 扩增体系为25 μL:2×Taq PCR MasterMix 12.5 μL,引物A1、A2各1.0 μL,模板DNA 1.0 μL,ddH2O 8.7 μL,0.4% BSA 0.8 μL(BSA为稳定剂),轻轻混匀后瞬时离心15 s,同时,以ddH2O代替模板DNA作空白对照。扩增条件:94℃预变性5 min;94 ℃变性 45 s,58.5 ℃ 退火45 s,72 ℃ 延伸30 s,共30个循环;最后72 ℃延伸6 min。反应结束后取10 μL扩增产物用1%琼脂糖凝胶电泳鉴定。平行试验重复3次。
1.3.4测序鉴定 使用胶回收试剂盒收集PCR阳性产物纯化,产物直接送生物生工工程(上海)股份有限公司测序,应用DNAMAN软件对测序序列和参照序列进行多重比较和相似性分析。
1.3.5ND6基因的特异性测定 在相同条件下对多房棘球绦虫、孟氏迭宫绦虫、豆状带绦虫、犬复孔绦虫、多头带绦虫、泡状带绦虫及犬弓首蛔虫的ND6基因进行PCR扩增,1%琼脂糖电泳检测结果。
1.3.6ND6基因的灵敏度测定 利用Thermo Scientific NanoDrop 分光光度计(Thermo, New York, USA)测定细粒棘球绦虫模板DNA的初始浓度,之后将提取出的模板DNA按1∶10、1∶100、1∶1 000、1∶2 000、1∶4 000、1∶8 000、1∶16 000、1∶32 000、1∶64 000、1∶128 000倍比稀释,并在相同条件下进行PCR扩增,1 %琼脂糖电泳检测结果。
1.3.7人工感染细粒棘球绦虫犬粪样的ND6基因检测 对2只犬(1号犬、2号犬)人工感染原头蚴第3 d至第18 d后的粪便依次进行DNA提取,并利用PCR扩增ND6基因,1%琼脂糖电泳检测结果。
1.3.8ND6基因与COX1基因作为分子标记的犬粪样临床检测比较 对40份随机采自包虫病流行区的待检犬粪进行DNA提取,并对ND6完整基因序列进行PCR扩增,同时扩增COX1部分基因序列,1 %琼脂糖电泳检测结果。对PCR结果呈阳性的样品使用柱式DNA胶回收试剂盒进行DNA的回收纯化, 回收产物进行双向测序,以保证所测序列的准确性。将ND6和COX1测序后的基因序列与GenBank检索的10个基因型的线粒体DNA序列相应区域做同源性比较,鉴定样品基因型。另外,对5份自然感染豆状带绦虫的犬粪、5份自然感染的多头带绦虫犬粪及2份自然感染的泡状带绦虫犬粪样品扩增ND6基因,1 %琼脂糖电泳检测结果。
2 结 果
2.1细粒棘球绦虫18 d龄童虫ND6基因的PCR扩增 用合成的引物A1、A2,对从实验室人工感染犬的肠道获得的细粒棘球绦虫虫体(18日龄童虫)提取DNA并扩增出了完整的ND6基因,条带大小与预期结果相符合,且条带清晰。阴性对照无任何条带(图1)。
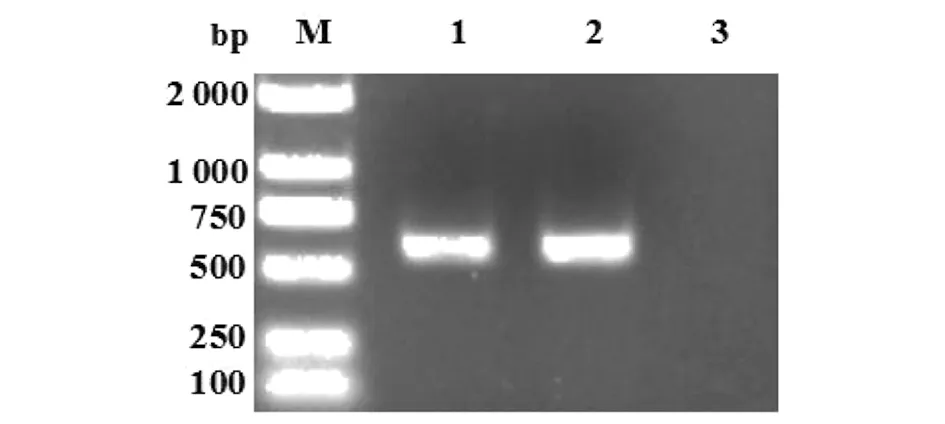
M: DL2000 DNA分子量标准;1: 虫体DNA;2: 阳性对照;3: 阴性对照图1 细粒棘球绦虫虫体ND6基因的PCR扩增Fig.1 ND6 PCR amplification from DNA samples obtained from the E.granulosus
2.2ND6基因的特异性测定 细粒棘球绦虫DNA样品PCR扩增反应产生单一目的条带,而多房棘球绦虫、孟氏迭宫绦虫、豆状带绦虫、犬复孔绦虫、多头带绦虫、泡状带绦虫及犬弓首蛔虫的DNA样本和阴性对照均无此扩增条带(图2)。

M: DL2000 DNA分子量标准;1: 细粒棘球绦虫DNA;2:多房棘球绦虫DNA;3: 多头带绦虫DNA;4: 孟氏迭宫绦虫DNA;5: 豆状带绦虫DNA;6: 泡状带绦虫DNA;7: 犬复孔绦虫DNA;8:犬弓首蛔虫DNA;9:阴性对照图2 ND6基因的特异性测定Fig.2 Specificity test of the ND6 gene
2.3ND6基因的灵敏度测定 经测定,细粒棘球绦虫模板初始DNA含量为273 ng,随着稀释度的增加,模板中DNA的含量越来越低,且电泳条带亮度在逐渐减弱,在稀释度为1/64 000即(4 pg)时能扩增到一条很淡的条带,但在稀释度为1/128 000(即2 pg)时无条带扩增出(图3)。
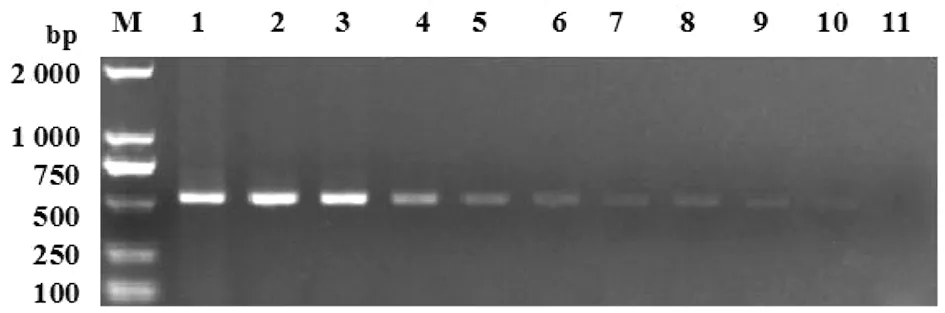
M: DL2000 DNA分子量标准; 1: 1; 2: 1/10; 3: 1/100; 4: 1/1 000; 5: 1/2 000; 6: 1/4 000; 7:1/8 000; 8:1/16 000;9: 1/32 000;10: 1/64 000;11:1/128 000图3 ND6基因的灵敏度测定Fig.3 Sensitivity test of the ND6 gene
2.4人工感染细粒棘球绦虫犬粪样的ND6基因检测 经测定,在感染细粒棘球绦虫第3 d至11 d时,2只犬粪便的ND6基因PCR扩增结果均为阴性。在第12 d时,只有2号犬的ND6基因PCR结果为阳性,而感染第13 d至18 d时,两只犬ND6基因PCR结果均出现阳性目的条带(图4)。
2.5ND6基因与COX1基因作为分子标记的犬粪样临床检测比较 对40份临床犬粪进行PCR检测后,有6份犬粪样品为PCR阳性,且ND6基因及COX1基因的检测及分型结果均相同,即6份样品均属G1基因型。而对5份自然感染豆状带绦虫的犬粪、5份自然感染的多头带绦虫犬粪及2份自然感染的泡状带绦虫犬粪进行PCR检测扩增ND6基因时,无样品呈现扩增性条带(图5a-5c)。
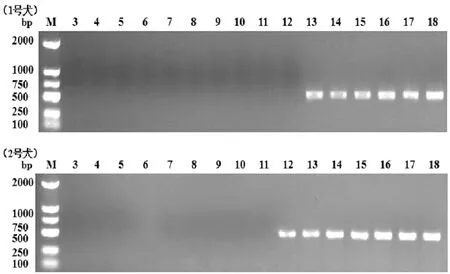
M: DL2000 DNA分子量标准; 3-18: 人工感染第3 d至第18 d的犬粪DNA图4 1号犬与2号犬粪便样品的ND6基因检测Fig.4 PCR amplification of ND6 gene in faeces samples of No. 1 dog and No. 2 dog

M: DL2000 DNA分子量标准; 1-6:阳性犬粪DNA图5a 6份阳性犬粪DNA的ND6基因检测Fig.5a ND6 PCR amplification of 6 positive canine faeces DNAM: DL2000 DNA分子量标准; 1-6:阳性犬粪DNA图5b 6份阳性犬粪DNA的COX1基因检测Fig.5b COX1 PCR amplification of 6 positive canine faeces DNAM: DL2000 DNA分子量标准; 1:阳性对照;2-6: 豆状带绦虫犬粪DNA;7-11: 多头带绦虫犬粪DNA;12-13: 泡状带绦虫犬粪DNA图5c 对照组临床犬粪的ND6基因检测Fig.5c ND6 gene’s amplifying results of the control group of clinical canine faeces by PCR
3 讨 论
检测犬感染细粒棘球绦虫的传统经典方法主要有:剖检法、槟榔碱泻下法和虫卵漂浮检查法。但是这些方法费时费力、易漏检、且生物危害性较大[15]。粪抗原ELISA检测法简单易行,特异性可高达97%[16-17]。但其敏感性易受感染程度的影响,当感染虫体数在100条以下时,其敏感性只有29%[18-20]。此外,该法在带科绦虫种属相近的虫体之间可能会出现严重的交叉反应[21],因此,粪抗原ELISA法检测结果可能出现较高的假阳性。LAMP技术所需设备简单,反应快速,产物检测便捷,特异性强[22-25],且Bst DNA聚合酶的活性几乎不受粪便抑制物的影响[24-26]。但因其灵敏度过高,少量的基因污染就会导致该法实验结果呈假阳性[27];且由于LAMP法的电泳图为多条带,故不易辨认非特异性扩增的产生[28],也无法通过基因测序而进行基因分型分析。另外,该法要求靶序列长度控制在300 bp以下,对引物要求较高,要筛选出合适的引物需要耗费大量的工作[29]。
动物粪便易于收集保存且粪便中感染源的数量庞大,其病原体遗传物质可以来源于寄生虫的虫卵,或寄生虫虫体的细胞及组织碎片等,仅用少量的粪便即可提取到目的基因[30],因此粪便PCR检测法也逐渐成为了检测动物疾病的重要途径。相比于病原学检测和免疫学检测方法,PCR检测方法具有快速、准确、敏感、特异等优点,也可实现对形态难以区分的带科绦虫的鉴定[31-32]。自Bretagne等[33]报道用PCR技术从狐狸粪DNA中检测多房棘球绦虫感染之后,该技术在犬粪棘球绦虫卵检测中也得到广泛的应用。Dinkel等[16]应用巢式PCR检测法对多房棘球绦虫12S rRNA片段(373 bp)进行了扩增,结果最低检测到1个虫卵,而细粒棘球绦虫等11种其他绦虫均无非特异性扩增,特异性为100%。Abbasi等[34]对目标重复序列(EgG1 Hae III)(133 bp)进行了PCR扩增,其敏感度很高,最低也可检测出一个虫卵。但其特异性较差,同时扩增的水泡带绦虫、多头带绦虫、羊带绦虫也具有相同的133 bp DNA重复序列[35]。Stefania等[36]对细粒棘球绦虫G1株的12S rDNA片段(255 bp)进行PCR扩增,敏感性达到对一个虫卵的检测,同时对细粒棘球绦虫另外5种基因型和其它14种绦虫基因进行扩增,结果仅特异性的扩增出细粒棘球绦虫G1型,检测结果无假阳性。此外,Dinkel 等[37]还根据细粒棘球绦虫G1株线粒体12S rRNA基因序列(254 bp)设计引物,鉴别了绦虫不同属和细粒棘球绦虫不同基因型(共16种),其特异性达100%,同时其敏感度也达到0.25 pg的DNA含量。但是,以上PCR检测的研究中,所选用的靶基因均为较短片段,所包含的遗传信息有限,不宜作为分子遗传标记。
本研究中,我们首次建立了一种粪便PCR方法,可同时对细粒棘球绦虫进行检测及基因分型研究。在我国,犬小肠内寄生的绦虫除细粒棘球绦虫外,最常见的还有多房棘球绦虫、多头带绦虫、泡状带绦虫、豆状带绦虫、犬复孔绦虫、孟氏迭宫绦虫。另外,犬弓首蛔虫也是很常见的犬肠道寄生虫。本实验分别对以上8种寄生虫进行了PCR检测,结果表明除细粒棘球绦虫外均未扩增出目的条带,说明本方法设计的引物具有高度的种特异性,不会发生交叉反应。而在测定本方法的灵敏度时,将目的基因按比例稀释(273 ng~2 pg),结果表明随着DNA浓度的逐渐降低,目的条带亮度也在逐渐减弱直到稀释至4 pg后阳性条带才完全消失,这就表明该方法具有较高的灵敏度。Alsabi等[38]曾采用虫卵漂浮法、粪抗原ELISA法、粪便PCR法及虫卵PCR法对感染多房棘球绦虫的不同时期进行检测,最终认为在潜伏期(感染2 d~29 d)时,粪抗原ELISA检测法最敏感,远高于粪便PCR法的敏感性。但是在本研究中,当犬人工感染约50 000只原头蚴时,建立的粪便PCR法在感染后第13 d便可从犬粪中扩增出目的基因,表明该法能够在早期诊断出犬细粒棘球绦虫的感染情况,适用于在细粒棘球绦虫感染潜伏期进行诊断。
目前,根据mtDNA基因的不同[14, 39-44],可将细粒棘球绦虫分为10个不同的地理株 (G1~G10), 其中线粒体基因COX1(366 bp)基因片段是经典常用的基因分型方法之一。本研究中,我们利用ND6基因对自然感染细粒棘球绦虫的阳性犬粪进行了基因分型,其分型结果与COX1基因的结果完全一致,均为G1型。结果表明我们所扩增的ND6全基因序列,不仅可以作为分子诊断标记进行PCR检测,而且其还可作为分子遗传标记,对细粒棘球绦虫进行进一步的基因分型及种群遗传结构分析。
粪便PCR检测法虽有大量的优点,但粪便中较多干扰因素的存在使目的基因的提取难度相对增大[45],同时也使PCR检测结果受到很大影响。据报道用0.4%~0.6%(wt/vol)的BSA可提高Taq聚合酶的活性,降低粪便抑制剂的作用,增强PCR扩增的敏感性,因此我们在PCR体系中加入0.4% BSA,明显地提高了PCR反应结果质量[46]。
4 结 论
本试验成功建立了一种基于线粒体ND6基因检测犬感染细粒棘球绦虫的粪便PCR方法,具有很高的特异性和灵敏度,并能够在感染早期及时检测出犬粪便中的细粒棘球绦虫,可用于犬感染细粒棘球绦虫的流行病学调查。同时,对于PCR检测阳性者,其胶回收产物经测序分析后也可用于细粒棘球绦虫基因分型及种群遗传结构的分析研究。
利益冲突:无
引用本文格式:詹佳飞,宋宏宇,王凝,等.基于线粒体ND6基因检测犬感染细粒棘球绦虫的粪便PCR方法[J].中国人兽共患病学报,2019,35(7):626-632. DOI:10.3969/j.issn.1002-2694.2019.00.67

