甘肃地区2型糖尿病患者骨密度变化及影响因素
唐淑尧 傅松波* 汤旭磊 刘靖芳 马丽华 孙蔚明 牛滢 井高静 赵楠 牛强龙 沈自雄陶慧欣 张嵴明 滕卫平 单忠艳
1. 兰州大学第一医院内分泌科,甘肃 兰州 730000 2. 中国医科大学附属第一医院内分泌科,辽宁 沈阳 101100
随着糖尿病患病率升高,糖尿病合并骨质疏松症逐渐引起临床上的重视。1型糖尿病引起骨密度(bone mineral density, BMD)下降并导致骨质疏松的结论已经较为确定[1]。2型糖尿病(type 2 diabetes, T2DM)与骨密度之间的关系目前仍然没有统一的认识,在研究结果中有升高、减低,也有变化不明显。Abdulameer等[2]的研究中对47篇有关T2DM和BMD相关性的文献进行了分析,其中26篇认为BMD是增加的,13篇是降低的,另外有8篇显示正常或与对照组无明显变化。本研究采用双能X 线骨密度仪对206例T2DM患者和2433例无糖尿病调查对象的骨密度进行测定,并对T2DM患者年龄、体质量指数、血压、胆固醇、三酰甘油、高密度脂蛋白、低密度脂蛋白、血尿酸、糖化血红蛋白、维生素D、血钙、血磷与骨密度关系进行相关性分析, 探讨T2DM患者骨密度的影响因素。
1 材料和方法
1.1研究对象及筛选标准
运用多阶段分层整群随机抽样的方法在甘肃地区随机选择和建立城市和农村流调现场。调查队列为2016年1至6月甘肃地区城市和农村调查现场2639人。其中男性1349例,女性1290例(闭经389例,未闭经901例)年龄18~87岁,平均(42.5±15.1)岁。调查对象为在流调现场居住5年以上的年满18周岁的汉族居民。调查现场内现患或曾患各类疾病者均可以入选,需要详细记载目前的服药及治疗情况,但要排除已明确能引起骨质疏松的疾病,要排除已怀孕妇女。根据血糖水平以及有无糖尿病史,将调查对象分为糖尿病组和对照组:糖尿病组206例,年龄20~86岁,平均年龄(59. 9±12.8) 岁,其中男性114例,女性92例;对照组2433例,年龄18~87岁,平均年龄(41.1±14.23)岁,其中男性1235例,女性1198例。
1.2 方法
1.2.1临床资料收集:详细记录年龄、病程、身高、体重、体质量指数、绝经年限等一般情况。
1.2.2生化指标检测
空腹血糖(fasting blood glucose, FBG)、葡萄糖耐量试验服糖后2 h 血糖(OGTT-2 h):血糖通过迈瑞公司的试剂盒和生化检测仪(BS-180)运用葡萄糖氧化酶法测定。已经诊断糖尿病患者仅测空腹血糖,不做OGTT。
糖化血红蛋白(HbA1c):HbA1c 采用BioRad试剂进行检测,所有标本测定HbA1c,包括已经诊断糖尿病者。
血脂(三酰甘油total triglyceride,TG、总胆固醇total cholesterol,TC、高密度脂蛋白胆固醇high-density lipoprotein cholesterol,HDL-C、低密度脂蛋白胆固醇 low density lipoprotein cholesterol,LDL-C)、血尿酸:血脂、血尿酸通过迈瑞公司的试剂盒和生化检测仪(BS-180)进行测定。
血钙、血磷:血钙、血磷通过迈瑞公司的试剂盒和生化检测仪(BS-180)进行测定。钙:采用CPC 法;磷:采用无机紫外线法。
血清维生素D(Vit D)测定:罗氏Co-bas6000全自动电化学发光免疫分析仪和检测试剂,采用电化学发光法测定。
1.2.3血压测量
受试者取坐位,统一测量右上肢血压。每人测量两次,每次间隔3~5 min。受试者测血压前需安静休息10 min,避免用力,精神放松。受检前要排空膀胱,前15 min应停止吸烟,测血压前避免饮用茶及咖啡类饮料。
1.2.4骨密度测定
采用双能X 线骨密度仪(DMS LEXXOS) 及骨密度测定软件对被检者进行右足部和左腕部进行骨密度测量。正常BMD 由骨密度仪储存数据库提供的亚洲人数据确定。
1.2.5诊断标准
骨质疏松评判标准:根据国际临床骨密度学会共识文件(2005年版),以同性别同部位峰值BMD为基准,正常值为骨峰值的± 1个标准差(即T-scored≥-1SD),骨量减少为低于骨峰值的1 ~2. 5 个标准差(即-1SD 2型糖尿病诊断:1999 年世界卫生组织(WHO)制定的糖尿病诊断及分型标准确诊为T2DM标准[3]:空腹血糖(FBG) ≥7. 0 mmol /L和(或)OGTT-2 h≥11. 1 mmol /L 者即可确诊。 糖尿病组在年龄(范围20~86周岁)、收缩压、舒张压、三酰甘油、胆固醇、高密度脂蛋白、糖化血红蛋白明显高于对照组,差异有统计学意义(P<0.05);在身高、低密度脂蛋白明显低于对照组,差异有统计学意义(P<0.05);在体重、体质量指数、血尿酸、维生素D、血钙、血磷差异没有统计学意义(P>0.05)。见表1。 表1 两组受试者一般情况及生化指标Table 1 General status and biochemical indexes in the two groups 糖尿病组左前臂与右足跟的骨密度测量值均显著低于对照组,差异均有统计学意义(均P<0. 05)。其中男性与女性的左前臂的骨密度测量值糖尿病组显著低于对照组,差异有统计学意义(P<0. 05);男性右足跟的骨密度测量值糖尿病组低于对照组,但差异没有统计学意义(P> 0. 05);女性的右足跟的骨密度测量值糖尿病组显著低于对照组,差异有统计学意义(均P<0. 05)。见表2。 表2 两组骨密度值的比较Table 2 Comparison of bone mineral density values between the two groups(g/cm2, 糖尿病组左前臂骨质疏松发生率为40.29%,骨量减少的发生率为38.35%;右足跟骨质疏松发生率为35.92%,骨量减少的发生率为29.61%。对照组左前臂骨质疏松发生率为18.66%,骨量减少的发生率为45.38%;右足跟骨质疏松发生率为21.74%,骨量减少的发生率为37.07%。糖尿病组与对照组左前臂和右足跟骨质疏松发生率的比较差异均有统计学意义(P<0. 05)。而骨量减少的发生率没有统计学意义(P>0.05)。见表3。 表3 两组骨质疏松、骨量减少发生率比较Table 3 Comparison of the incidence of osteoporosis and osteopenia between the two groups 男性糖尿病组左前臂骨质疏松发生率为41.23%,骨量减少的发生率为31.58%;右足跟骨质疏松发生率为27.19%,骨量减少的发生率为26.32%。男性对照组中骨质疏松发生率为22.02%,骨量减少的发生率为49.64%;右足跟骨质疏松发生率为23.72%,骨量减少的发生率为34.74%。男性糖尿病组与男性对照组左前臂骨质疏松发生率的比较差异有统计学意义(P<0. 05),而左前臂骨量减少、右足跟骨质疏松及骨量减少发生率的比较均没有统计学意义(P>0.05)。见表3。 女性糖尿病组左前臂的骨质疏松发生率51.09%,骨量减少的发生率为34.78%,右足跟骨质疏松发生率为33.70%,骨量减少的发生率为46.74%。女性对照组左前臂骨质疏松发生率15.19%,骨量减少的发生率为40.98%;右足跟骨质疏松发生率为19.70%,骨量减少的发生率为39.48%。女性糖尿病组左前臂和右足跟骨质疏松及右足跟骨量减少发生率明显高于女性对照组,差异具有统计学意义(P<0.05),而左前臂骨量减少的发生率明显低于对照组,差异具有统计学意义(P<0.05),骨质疏松和骨量减少总的发生率高于对照组(χ2=30.984,P<0.001)。见表3。 分别以年龄、体质量指数(BMI)、血压(收缩压systolic blood pressure, sp、舒张压diastolic blood pressure, dp)、血脂(TG、TC、LDL-C、HDL-C)、血尿酸、糖化血红蛋白、维生素D(Vit D)、血钙、血磷为自变量,以BMD为因变量,做Pearson相关分析,从中得到左前臂骨密度与BMI、dp、血尿酸、血磷呈正相关,与sp、HDL-C、血钙、年龄呈负相关;右足跟骨密度与BMI、dp、TG、血尿酸、血磷呈正相关,与TC、LDL-C、HDL-C、血钙、年龄呈负相关。见表4。 表4糖尿病患者骨密度影响因素的Pearson相关分析 Table4Pearson correlation analysis of factors affecting bone mineral density in diabetic patients 项目左前臂右足跟r值P值r值P值体质量指数/(kg/m2)0.1620.0200.275<0.001收缩压/(mmHg)-0.170 0.014-0.0510.468舒张压/(mmHg)0.294<0.0010.289<0.001三酰甘油/(mmol/L)0.1100.1170.1810.009胆固醇/(mmol/L)-0.1220.081-0.276<0.001低密度脂蛋白/(mmol/L)-0.0850.224-0.1990.004高密度脂蛋白/(mmol/L)-0.304<0.001-0.381<0.001血尿酸/(mmol/L)0.259<0.0010.267<0.001糖化血红蛋白/(%)0.0530.4490.0980.159维生素D/(ng/mL)-0.0760.275-0.040 0.564血钙/(mmol/L)-0.471<0.001-0.345<0.001血磷/(mmol/L)0.1790.0100.1650.018年龄/(岁)-0.379<0.001-0.291<0.001 在左前臂以BMI、dp、血尿酸、血磷、sp、HDL-C、血钙、年龄为自变量,以左前臂BMD为因变量, 采用多元逐步回归分析发现影响BMD的主要因素见表4;在右足跟以BMI、dp、TG、血尿酸、血磷、TC、LDL-C、HDL-C、血钙、年龄为自变量, 以右足跟BMD为因变量, 采用多元逐步回归分析发现影响BMD的主要因素见表5。 随着物质生活水平的逐步提高,患糖尿病的人也愈来愈多,据世界卫生组织(WHO)最新统计数据表明,全球糖尿病患者已达3.47亿。据2017年的一项数据表明,中国成人DM患病率为10.90%[4]。其中2 型糖尿病患者占多数,在临床上较为常见。骨质疏松症(osteoporosis, OP)是以骨量减少,骨质量受损及骨强度降低,导致骨脆性的增加、易发生骨折为主要特征的全身性骨病,可以造成糖尿病合并骨质疏松患者的受损部位肿胀、疼痛加剧以及关节功能障碍、脆性骨折和呼吸系统受影响等,造成患者的生活质量下降[5]。骨质疏松病在中国大陆地区40岁以上的人群中发病率为19.74%[6],其严重后果是骨折。在DM患者中,约1 /2 ~2 /3伴有骨密度降低,其中有近1 /3 的患者可以诊断为OP。因此,对于预防糖尿病患者骨质疏松的发生就显得更为重要。 表5糖尿病患者骨密度影响因素的多元逐步回归分析 Table5Multiple stepwise regression analysis of factors affecting bone mineral density in diabetic patients 项目左前臂右足跟t值P值t值P值血钙/(mmol/L)-0.274<0.001-0.321<0.001年龄/(岁)-0.1760.008-0.338<0.001血尿酸/(mmol/L)0.1850.0010.251<0.001收缩压/(mmHg)-0.313<0.001——舒张压/(mmHg)0.303<0.001——高密度脂蛋白/(mmol/L)-0.1070.069-0.1270.038血磷/(mmol/L)0.0970.079—— 本文将来自流调队列的206 例T2DM患者作为研究对象,另设流调队列的2433例非糖尿病人群为对照组,通过对T2DM的患者和非糖尿病被调查者骨密度骨质疏松发生率以及一些可能因素进行分析。结果发现,T2DM组左前臂的和右足跟的骨密度测量值均显著低于对照组。表明T2DM患者的骨密度值较对照组有所减低,易导致骨质疏松的发生。其中,T2DM组男性只有左前臂的骨密度测量值与对照组显著降低;T2DM组女性左前臂的和右足跟的骨密度测量值均显著低于对照组(P<0.05)。同时,T2DM患者左前臂和右足跟骨质疏松的发生率明显高于非糖尿病人群,提示在治疗T2DM患者的同时预防骨质疏松的发生十分重要。其中,男性T2DM患者只有左前臂骨质疏松发生率明显高于非糖尿病人群;女性T2DM患者左前臂和右足跟骨质疏松和右足跟骨量减少的发生率明显高于非糖尿病人群,而左前臂骨量减少的发生率明显低于对照组,但由于骨质疏松的发生率高,骨质疏松和骨量减少总的发生率高于对照组。左前臂骨密度降低明显,骨质疏松发生率高可能与其松质骨比例较高,其骨代谢率也较高,对糖尿病环境的影响较为敏感有关[7]。女性T2DM患者骨密度降低明显,骨质疏松的发生率高是由于绝经后女性卵巢内分泌功能失调衰退,体内雌激素水平下降,导致骨偶联过程失衡、骨吸收大于骨形成所导致骨质疏松[8]。Majumdar等[9]的研究发现绝经后的糖尿病患者的骨质疏松的比例以及严重程度均高于绝经后的非糖尿病患者,并且即使在年轻的T2DM患者人群中,骨质疏松性骨折的发生也并不少见。Li等[10]的研究表明老年女性糖尿病患者的骨折发生风险相比于老年男性更有代表性。 T2DM引起的骨代谢变化机制较为复杂,现认为糖尿病对骨代谢的影响主要表现为骨吸收增加,骨形成缓慢甚至减少,骨吸收的过程大于骨形成的过程,使骨矿物质含量减少导致骨质疏松。其发病机制可能以下几个因素有关[7]:①当血糖高时会有大量的葡萄糖从尿液中排出,渗透性利尿的作用会将大量钙、磷、镁离子排出体外,使其在血中的浓度会降低,低钙会刺激甲状旁腺,导致其功能亢进,分泌更多的甲状旁腺素(parathyroid hormone, PTH),使溶骨作用增强。②在成骨细胞(osteoblast, OB)膜的表面有胰岛素受体,胰岛素具有促进骨细胞内氨基酸的蓄积、刺激骨胶原合成以及核苷酸的形成以及来增加骨骼中钙的沉积的作用。而胰岛素的缺乏会使OB 数目减少,活性降低,通过影响骨细胞的多种代谢作用进而影响骨的形成与转换。③胰岛素的缺乏时,OB对PTH及1,25-二羟维生素D3的敏感性降低,导致OB活性降低,使骨形成减少。④胰岛素的缺乏可使血浆中骨钙素的水平降低,最终会导致骨密度的降低,引起骨质疏松,使骨折的风险增加。⑤一些降糖药物,如噻唑烷二酮类(thiazolidinediones, TZDs)主要抑制骨髓间充质干细胞(BMSC)向成骨细胞的分化,从而减少骨的形成;中、高浓度的磺脲类药物可诱导OB发生自噬和凋亡,降低OB的分化功能进而也会影响骨的形成[11]。 左前臂骨密度与BMI、dp、血尿酸、血磷呈正相关,与sp、HDL-C、血钙、年龄呈负相关,其中与血钙、年龄、血尿酸、dp、sp显著相关;右足跟骨密度与BMI、dp、TG、血尿酸、血磷呈正相关,与TC、LDL-C、HDL-C、血钙、年龄呈负相关,其中血钙、年龄、血尿酸、HDL-C显著相关。反映糖代谢控制状况的指标HbA1c与BMD无相关性,陈超等[12]认为也糖代谢控制状况与骨代谢无必然联系。 目前比较确定的,血钙为骨质疏松的保护因素,而年龄为骨质疏松的危险因素,本研究与季发权等[13]的研究结果一致。血尿酸与BMD成显著正相关,血尿酸为骨质疏松的保护因素。Chen等[14]的单中心回顾性研究表明血尿酸与腰椎BMD正相关,高尿酸水平可能是骨质疏松的保护因素;并且吴静等[15]的研究也发现T2DM患者的骨密度与尿酸正相关。左前臂的BMD与sp呈负相关,与dp呈正相关。马剑侠等[16]同样发现年龄及sp是绝经后女性T2DM患者OP发生的相关危险因素,管丽萍等[17]的研究也得出了相同的结论。对于HDL-C与BMD呈负相关,是骨质疏松的危险因素,而LDL-C、TG、TC与BMD无相关性,这与征海华等[18]对绝经后女性T2DM患者的研究中得出的结论是一致的。因此,在年龄不可以控制的基础上,提示可以在正常范围内适当提高dp水平以及血尿酸浓度,适当降低sp以及血脂水平(尤其是HDL-C),并适当进行高钙饮食,减少骨破坏维持来血钙,以减少T2DM患者骨质疏松的发生。 通过研究发现,影响T2DM骨密度变化的危险因素较多,在临床的治疗中应有针对性地对上述影响因素实施积极的干预,来降低2型糖尿病患者骨质疏松的发生率,减低患者的心理负担及其家庭的经济负担,本次研究在临床上具有一定的指导意义和应用价值。1.3 统计学处理
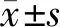
2 结果
2.1 两组受试者一般情况及生化检测指标比较

2.2 两组受试者骨密度值对比

2.3 两组骨质疏松患病率对比

2.4 糖尿病患者骨密度与各项相关因素相关性分析

3 讨论