麻痹性贝类毒素体外生物毒性检测方法的建立
于志强,孙 运,陈小青,刘汉伟,马中春*
(宁波中盛产品检测有限公司/宁波海关技术中心,浙江 宁波 315000)
贝类毒素是由海洋中的有毒藻类通过食物链传递给藻食性的贝类,并在其体内蓄积、放大、转化形成的有毒高分子化合物[1]。进食含有贝类毒素的贝类海洋食品可能造成食物中毒。在所有的贝类产品食物中毒事件中,麻痹性贝类毒素(paralyticshellfish poisoning,PSP)中毒占87%,被公认为是对健康危害最严重的之一[2]。我国海洋赤潮毒素中最常见的主要也是麻痹性贝类毒素[3]。因此,对海洋性贝类食品的检测中麻痹性贝类毒素基本上为必检项目。目前对于麻痹性贝类毒素的检测方法主要为小鼠生物法、高效液相色谱法和酶联免疫测定法[4]。其中小鼠生物法为大多数检测机构的常用方法。而小鼠生物法不满足“3R”原则(replacement,reductionandrefinement)的要求,因此寻找一种更加简便、灵敏、高效、准确的麻痹性贝类毒素检测方法已经成为我国各个检测机构的研究重点。
石房蛤毒素(saxitoxin,STX)是麻痹性贝类毒素主要成员之一[5],具有麻痹性贝类毒素的典型结构与特征,是《GB5009.213-2016食品安全国家标准:贝类中麻痹性贝类毒素的测定》中明确规定的阳性标准品,现阶段对麻痹性贝类毒素的检测方法均是应用石房蛤毒素作为阳性标准品建立的,因此,本研究也采用STX为阳性标准品建立新的体外细胞检测方法。
神经干细胞(neuralstemcell,NSC)是一类具有自我更新和多向分化潜能的特殊细胞,利用它不仅可以探讨神经系统发育的分子机制,也可作为一种替代手段用于中枢神经损伤、退行性疾病和神经性肿瘤等的治疗和研究[6]。本研究应用小鼠神经干细胞建立麻痹性贝类毒素体外生物毒性检测方法,利用其自我更新和分化潜能的特性,其更加接近生物体内神经细胞对麻痹性贝类毒素的反应,检测结果更准确、灵敏、高效,并且符合“3R”原则,为贝类毒素的检测提供了研究的新思路、新方向。
1 材料与方法
1.1 实验材料
1.1.1 毒素和细胞 石房蛤毒素(CRM-STX-f),购于加拿大自然研究委员会;小鼠神经干细胞,购于上海素尔生物科技有限公司。
1.1.2 主要试剂和仪器 DMEM/F12培养基、胎牛血清均购于Gibco公司;B27、L-谷氨酰胺、丙酮酸钠均购于ThermoFisherScientific公司;碱性成纤维细胞生长因子(basicfibroblastgrowthfactor,b-FGF)和表皮生长因子(epidermalgrowthfactor,EGF)均购于PeproTech公司;胰蛋白酶购于HyClone公司;Cell CountingKit-8(CCK-8)细胞增殖-毒性检测试剂盒购于上海同仁化学研究所;乌本苷、藜芦碱均购自Sigma公司;96孔板购自Costar公司。
CO2培养箱购于德国Binder公司;倒置显微镜购于日本Olympus公司;超净工作台购于Biox公司;超速离心机购于德国Hermle公司;多功能酶标仪购于美国MolecularDevices(MD)公司。
1.2 实验方法
1.2.1 NSC细胞培养 将冻存的NSC于37℃的水浴中迅速融化,在超净台中转移至装有已预热完全培养基的细胞培养瓶中,放入CO2培养箱中培养。培养12 h后,将NSC转移至离心管中,800r/min离心3 min,弃上清,更换新的完全培养基继续于CO2培养箱中培养2d。于培养的第4天进行传代:将NSC球转移至离心管中,800r/min离心3min,弃上清;用1 mL0.05%的胰酶37℃消化5min(中间轻轻摇动几次,以保证消化效果更充分);加入1mL培养基(或PBS)终止消化,轻轻吹打,将细胞球打散,1000r/min离心3min,弃上清重悬后进行传代。
1.2.2 细胞毒性检测 NSC接种于96孔培养板中,培养至对数生长期进行标准品的毒性检测。每孔分别加入170μL培养液和10μL标准品(剂量分别为0.2、0.4、0.6、0.8、1.0、1.2、1.4ng),各剂量设5个重复孔,每孔再加10mmol/L的乌本苷10μL及1mmol/L的藜芦碱10μL。同时设置5个乌本苷及藜芦碱对照孔,以培养液替代STX阳性剂。另设5孔为只加30 μL的培养基的空白对照孔。将培养板放入细胞培养箱中培养24h,倒置显微镜观察细胞形态。每孔加20 μLCCK-8溶液(注意不要产生气泡),轻摇混匀,将培养板在培养箱内孵育2h。用酶标仪在450nm处测定各孔D(450)值。
1.3 统计学方法
采用SPSS17.0软件进行数据处理,计算出各组数据的平均数和方差,在Excel中输入数据,以D(450)值为纵坐标,STX含量为横坐标建立直角坐标系,绘制标准曲线,通过散点相关性分析得到标准曲线方程,并得到直线相关系数R2以判断线性关系。
2 结果
2.1 显微镜观察NSC生长情况
显微镜下观察正常NSC生长情况,结果见图1。NSC培养第1天,为单细胞悬液;于培养第2~3天,NSC聚集成为小神经球;培养第4天,由于NSC克隆增殖,小神经球逐渐增大为大神经球。
2.2 加入STX后各组NSC生长情况
空白对照组NSC生长活跃,形态为正常圆球状;乌本苷及藜芦碱对照组可见较多细胞出现肿胀破裂,STX组可见肿胀或破裂死亡的细胞,但细胞形态多为正常(见图 2)。
2.3 STX各剂量组D(450)值测定
通过酶标仪测定的空白对照组、乌本苷及藜芦碱对照组以及各STX剂量组平均D(450)值及标准差见表1。
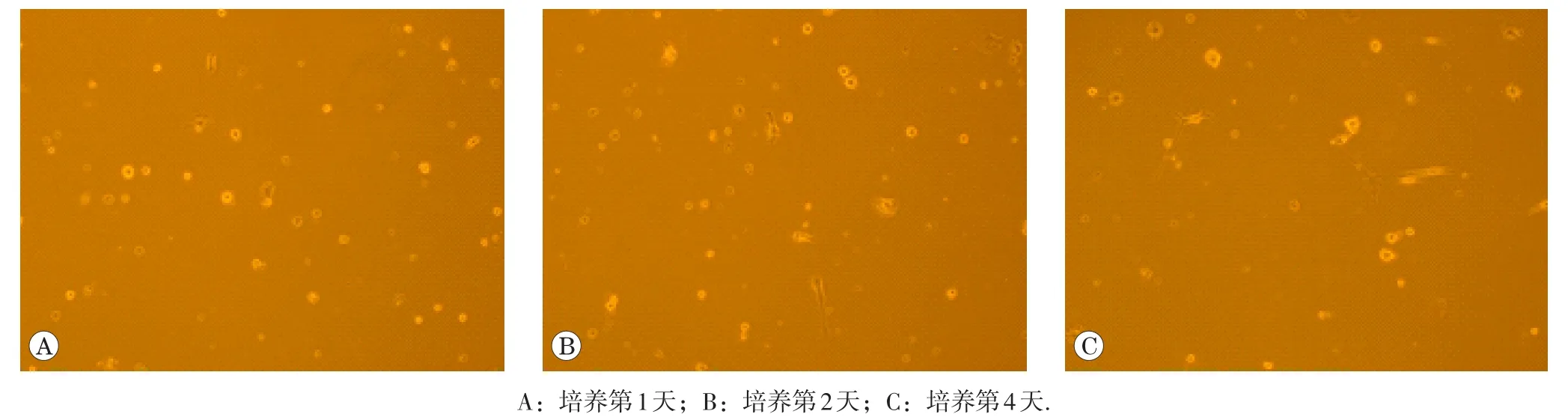
图1 显微镜下观察神经干细胞生长情况

图2 显微镜下观察加入STX后各组神经干细胞生长情况

表1 各组D(450)值测量结果
2.4 标准曲线的建立
STX的含量在0.2~1.0ng范围内与D(450)值呈剂量反应关系,而在1.0~1.4ng范围内不具有剂量反应关系,其在0.2~1.0ng范围内得可得到直线回归方程:y=1.252+0.495x(r=0.9980,P<0.01)。根据此结果制作出标准曲线,见图3。
3 讨论
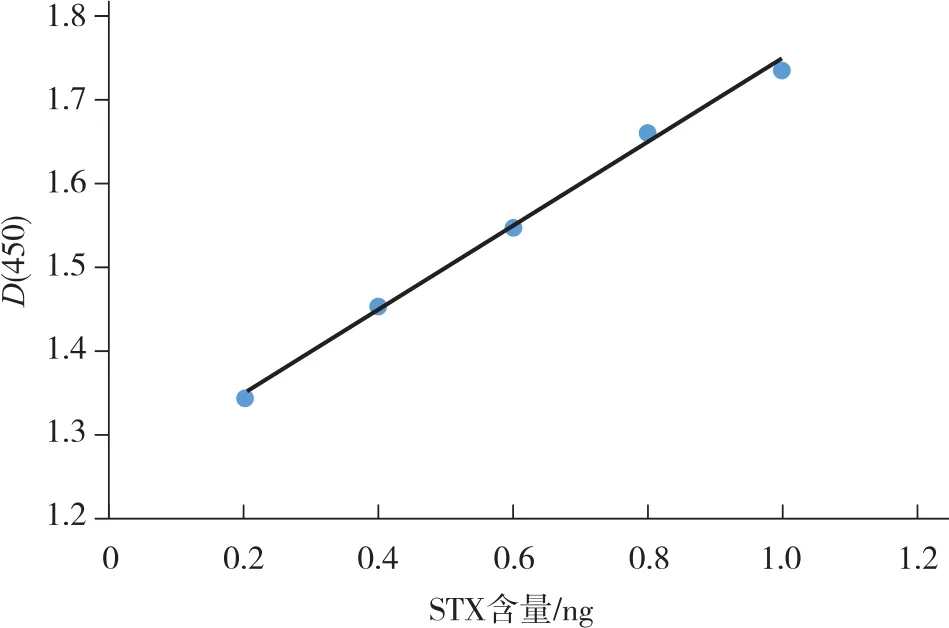
图3 STX细胞毒性试验标准曲线
现阶段,对于麻痹性贝类毒素的检测方法主要为小鼠生物法、高效液相色谱法和ELISA检测法,这3种方法都是国家标准GB5009.213-2016中明确提到的检测方法,并且已被广大检测机构所采用,同时小鼠生物法更是由于其检测结果更接近人体对毒素的反应以及不需要特殊仪器设备等优点,而成为了检测麻痹性贝类毒素的首选方法[7]。但是该方法也暴露出了很多问题,如小鼠之间存在个体差异,对毒素的敏感性不尽相同,因此,造成了检测灵敏度不高,结果偏差较大[8]。高效液相色谱法由于麻痹性毒素的标准品较少、仪器设备昂贵、需要专业的技术人员等问题限制了其广泛的应用于各个检测机构[9-10]。于兵[11]、罗辉武等[12]一致认为ELISA是快速筛选麻痹性贝类毒素的首选技术,但ELISA检测法需要应用麻痹性贝类毒素的相关抗体,由于难以获得大量抗体,造成麻痹性贝类毒素的ELISA检测试剂盒价格居高不下,使其检测成本过高,推广难度较大。综上,目前急需一种新型检测方法满足检测需要。体外细胞检测方法由此应运而生,其具有上述3种方法中不可替代的优点:减少动物的使用,检测成本低,操作简便。因此,此方法可成为一种新型麻痹性贝类毒素的检测手段。
本研究应用STX等麻痹性贝类毒素能够抑制乌本苷和藜芦碱引起的Na+内流造成的细胞肿胀破裂,减少细胞死亡的原理,建立检测麻痹性贝类毒素方法。应用96孔细胞培养板,对细胞的需求量不大,应用小鼠神经干细胞,由于其具有自我更新和多向分化的特性,其生理特点更接近于原代细胞,其检测结果较致瘤化的细胞系更能体现动物体内细胞对毒素的真实反映。同时本方法操作简便,灵敏度高,制作标准曲线的阳性剂只需纳克级,对待检样品的需求量较小。并且在一定范围内测量的吸光度值与STX的含量具有正相关关系,以此初步建立了麻痹性贝类毒的细胞检测方法。
本研究建立的检测方法对细胞状态要求较高,细胞生长活跃可以提高检测的灵敏度,其后续研究将进一步优化条件并应用建立的细胞检测方法对待检样品进行检测。

