2-乙酰基-4-羟基-丁基咪唑对小鼠细胞免疫功能的影响
段骁骁,肖倩倩,魏雪涛,郝卫东*
(北京大学公共卫生学院毒理学系/食品安全毒理学研究与评价北京市重点实验室,北京 100191)
焦糖色,又名焦糖、焦糖色素,是糖类物质在高温下脱水、分解、聚合而成的红褐色或黑褐色混合型化合物,是我国允许在食品中使用的最重要天然色素之一,其产销量占到天然色素的80%以上[1-2],广泛用于酱油、醋、啤酒、调味料等食品中。焦糖色按照使用添加剂的不同可分为普通法生产的I类焦糖色,加亚硫酸盐生产的II类焦糖色,加氨生产的III类焦糖色和亚硫酸氨法生产的IV类焦糖色,其中IV类焦糖色使用率最高,其次为III类。2-乙酰基-4-羟基-丁基咪 唑 (2-Acetyl-4-tetrahydroxy-butylimidazole, THI)是III类焦糖色生产、加工过程中的主要副产物,因其在动物实验中表现出免疫毒性而受到广泛关注。研究表明,大鼠摄入III类焦糖色后约1/3的有色物质被吸收[3],其经口半数致死剂量(LD50)高于17500mg/kg[4],长期摄入可导致大鼠外周血中淋巴细胞数显著减少,同时抑制大鼠特异性和非特异性免疫功能[5-8]。Sinkeidam等[5]发现III类焦糖色对大鼠免疫系统的影响是由THI导致的,Gobin等[8]进一步证实,单独摄入THI可影响多项大鼠免疫功能指标,如胸腺淋巴细胞数显著增加,T细胞增殖能力降低和NK细胞活性下降等。Gugasyan等[9]发现单独摄入THI可以抑制小鼠的接触性超敏反应,并引起外周血中淋巴细胞的减少,而补充维生素B6可在不同程度上缓解THI引起的淋巴细胞减少症[10-11],目前尚无THI遗传毒性和致癌性的报道[12]。因THI可导致啮齿类动物出现可逆性的淋巴细胞减少症,FAO/WHO食品添加剂联合专家委员会(JECFA)将III类焦糖色的每日允许摄入量(acceptable dailyintake,ADI)定为200mg/kg,THI限量25mg/kg。因Maekawa等[13]提出THI在大鼠体内的无可见有害作用水平(noobservedadverseeffectlevel,NOAEL)为20g/kg,欧洲食品安全局(EFSA)据此将III类焦糖色的ADI下调为100mg/kg,THI限量10mg/kg。
鉴于焦糖色在我国食品生产加工过程中应用广泛,公众对焦糖色及其副产物健康风险的关注度不断增加,因此国家卫生和计划生育委员会在2017年对中国居民膳食焦糖色暴露风险进行了专项评估,在该过程中发现,THI相关的毒理学资料十分陈旧,研究内容有限且研究结果不一,不能针对敏感的毒性效应终点获得可靠的毒理学数据,难以满足对其开展健康风险评估的需求。为弥补相关毒理学资料的空缺,同时为开展THI健康风险评估提供毒理学数据,本实验研究了7d和30d连续暴露THI对小鼠免疫功能的影响。
1 材料与方法
1.1 实验动物
SPF级BALB/c雌鼠,购自北京大学医学部实验动物科学部。6~8周龄,体质量18~22g,饲养于屏障环境,温度20~25℃,相对湿度40%~70%,12h/12h明暗交替循环,饲料为符合国家标准的普通维持饲料,无菌垫料,饮用水经过滤除菌处理,动物自由饮水和摄食。动物实验符合北京大学动物福利和管理委员会的相关规定。
1.2 主要试剂与仪器
2-乙酰基-4-羟基-丁基咪唑(THI)、1-磷酸鞘氨醇(sphingosine-1-phosphate,S1P)购自美国Sigma公司;RPMI-1640培养液购自美国Hyclone公司;流式抗体 anti-mouseCD3FITC、anti-mouseCD4PE/CyTM5、anti-mouseCD8PE/Cyanine7购自北京达科为生物技术有限公司。
全自动血球计数仪购于日本NIHONKOHDEN公司;流式细胞仪购于美国Beckman公司;多功能酶标仪购于德国Omega公司;低温高速离心机购于德国Heraeus公司。
1.3 分组与处理
将小鼠按体质量随机分为对照组(超纯水组)和THI低、中、高剂量组,每组12只。按染毒周期分为7d和30d实验组,连续每天灌胃给药,灌胃量均按20 μL/g。7d染毒剂量为0、0.5、2.5、12.5mg/kg,30d为0、0.2、0.5、2.5mg/kg。小鼠麻醉后摘除眼球取血,颈椎脱臼处死动物,进行相关指标检测。
1.4 检测指标与方法
1.4.1 外周血白细胞分类计数 眼球取血于抗凝管内,全自动血球计数仪计数白细胞总数;制备血涂片,瑞氏染液进行染色,镜下计数200个白细胞。
1.4.2 胸腺T细胞分类计数 分离胸腺于PBS,研磨至单细胞悬液;细胞计数后转移至5mL流式管中(每管1×106个细胞),PBS洗涤一次(4 ℃、350g/min,离心5min);弃上清,用100μL流式染色液重悬细胞沉淀,加入细胞表面分子抗体CD3、CD4和CD8混合液,混匀后4℃避光孵育30min;孵育结束,加入2 mL流式染色液洗涤一次(4℃、350g/min离心5 min);弃上清,样品用300μL流式染色液重悬,立即采用流式细胞仪进行T细胞分类检测。
1.4.3 T淋巴细胞增殖功能测定 无菌条件下分离脾脏于 Hanks液,研磨至单细胞悬液;转移至15mL离心管,Hanks液洗涤一次(350g/min,5min);弃上清,重悬于2mLRPMI-1640完全培养液中,台盼蓝染色计数活细胞数(活细胞应在95%以上),并调整细胞浓度至2×106/mL;每份细胞悬液分2孔加入24孔板中(1mL/孔),其中一孔加入50μLConA液(终浓度为5μg/mL),另一孔作为对照,培养72h;培养结束前4h,每孔弃去培养液0.7mL,加入0.7mL不含小牛血清的RPMI-1640培养液,同时加入MTT(5mg/mL,50μL/孔);培养结束后每孔加入1mL酸性异丙醇,混匀后分装到96孔板中,每孔分装3个平行样,用多功能酶标仪检测,结果以波长570nm处的光密度值表示。
1.4.4 NK细胞活性实验 实验前72h将YAC-1细胞(靶细胞)传代培养,实验中用RPMI-1640完全培养液调整细胞浓度至1×105/mL;无菌条件下分离小鼠脾脏于Hanks液,研磨至单细胞悬液;转移至15mL离心管,Hanks液洗涤一次(350g/min,5min);弃上清,重悬于2mLRPMI-1640完全培养液中,台盼蓝染色计数活细胞数(活细胞应在95%以上),并调整细胞浓度至5×106/mL;取靶细胞和效应细胞各100μL加入U型96孔板中,同时设靶细胞自然释放孔(靶细胞和培养液各100μL)、靶细胞最大释放孔(靶细胞和5%TritonX-100各100μL),培养4h;培养结束后,1500r/min离心5min,每孔吸取上清100μL置于平底96孔板,加入LDH基质液100μL,反应3min,每孔加入1mol/L的HCl30μL,测定D(490)值,按下式计算NK细胞活性:

1.4.5 T细胞趋化功能检测 无菌条件分离脾脏于PBS中,研磨至单细胞悬液,PBS洗涤一次(4℃,350g/min,离心5min);弃上清,重悬于RPMI-1640完全培养液中,调整细胞浓度为8×106/mL,加至96孔Transwell趋化小室上室(25μL/孔),将含不同浓度1-磷酸鞘氨醇(S1P)的相同培养基用于下室(29μL/孔);培养1h后,收集下室内容物于EP管内,350g/min离心5min;将细胞沉淀重悬于流式染色液中,进行抗体染色,具体过程同1.4.2。
1.5 统计学方法
采用SPSS13.0统计软件进行数据分析,多组均数间比较采用单因素方差分析,方差不齐时采用Dunnett'sT3检验,两组均数之间比较采用t检验,方差不齐时采用t检验,数据表达方式为。以α=0.05为检验水准。
2 结果
2.1 THI对小鼠体质量和脏器质量的影响
THI对BALB/c小鼠体质量和脏器质量的影响如图1所示。7d和30dTHI连续染毒结束时,染毒组小鼠体质量、肝、胸腺、双侧腹股沟淋巴结和浅表淋巴结(颌下、腋下和腹股沟淋巴结)质量与对照组相比均未出现明显变化(P>0.05),仅连续染毒30d时高剂量组(2.5mg/kg)小鼠脾脏质量明显下降(P<0.05)。
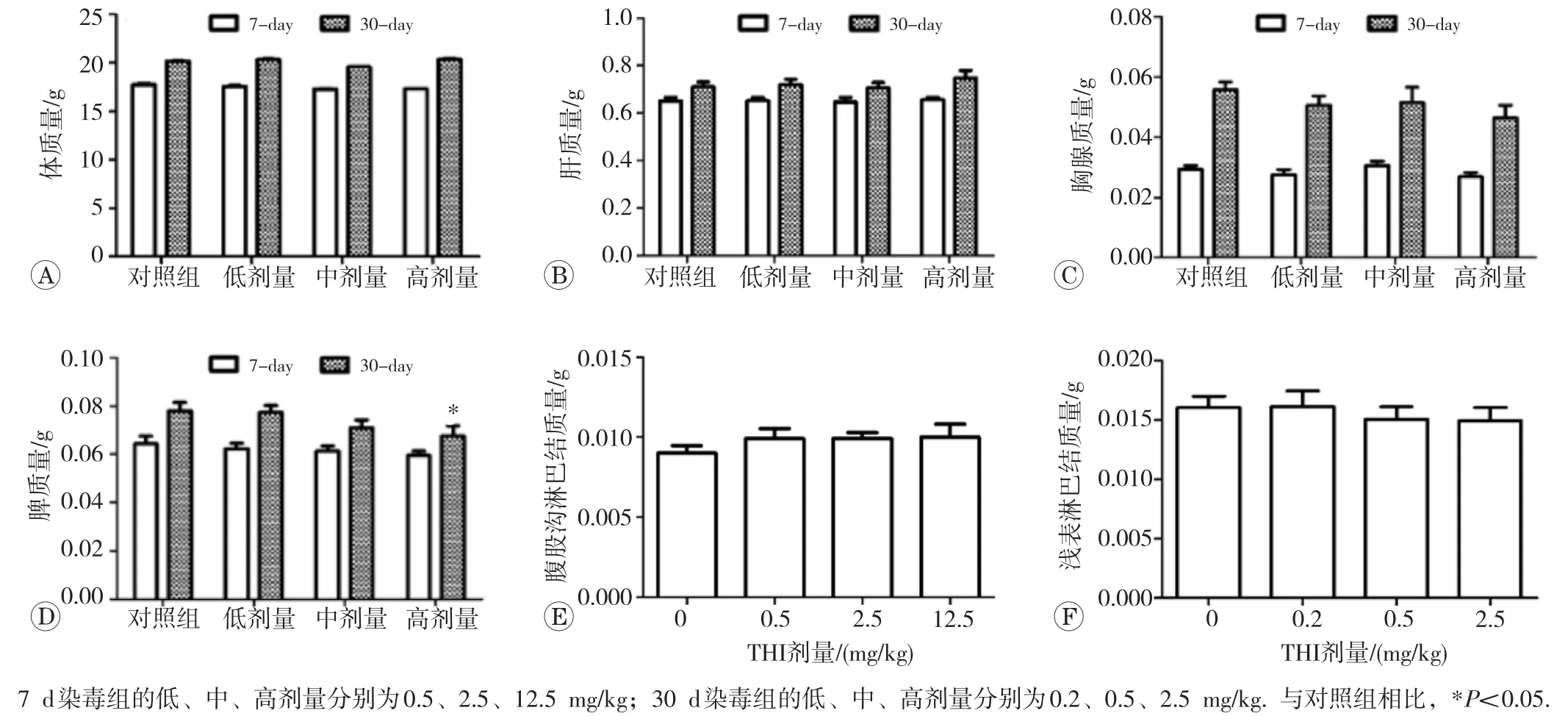
图1 THI对小鼠体质量和脏器质量的影响(n=12)
2.2 THI对外周血白细胞数的影响
THI染毒7d对小鼠外周血白细胞数的影响如图2所示。与对照组相比,THI2.5和12.5mg/kg剂量组白细胞总数均明显降低(P<0.05);12.5mg/kg剂量组淋巴细胞数明显降低(P<0.05);2.5和12.5mg/kg剂量组淋巴细胞占白细胞总数比值下降(P<0.05)。

图2 THI染毒7d对小鼠外周血白细胞数的影响(n=12)
THI30d染毒小鼠外周血白细胞数变化情况如图3所示。与对照组相比,THI0.5和2.5mg/kg组白细胞总数明显降低(P<0.05),2.5mg/kg组淋巴细胞数显著下降(P<0.05),淋巴细胞占白细胞数比值、单核细胞数、中性粒细胞数在各剂量组中未观察到明显变化(P>0.05)。THI染毒7d和30d各组的红细胞数均在正常值范围内。

图3 THI染毒30d对小鼠外周血白细胞数影响(n=12)
2.3 THI对胸腺T细胞数的影响
THI染毒7d小鼠胸腺细胞数的变化结果如图4所示。与对照组相比,12.5mg/kg剂量组胸腺细胞总数和T细胞数显著升高(P<0.05),0.5和2.5mg/kg剂量组变化不大,T细胞占胸腺细胞总数比例在各组中基本保持一致。T细胞数升高主要是由于单阳性T细胞(CD4+和CD8+T细胞)数增加所致,2.5和12.5mg/kg剂量组单阳性T细胞数显著升高(P<0.05),双阳性T细胞(CD4+CD8+T细胞)和双阴性T细胞(CD4+CD8+T细胞)数在各组间差异不明显,具体见表1。
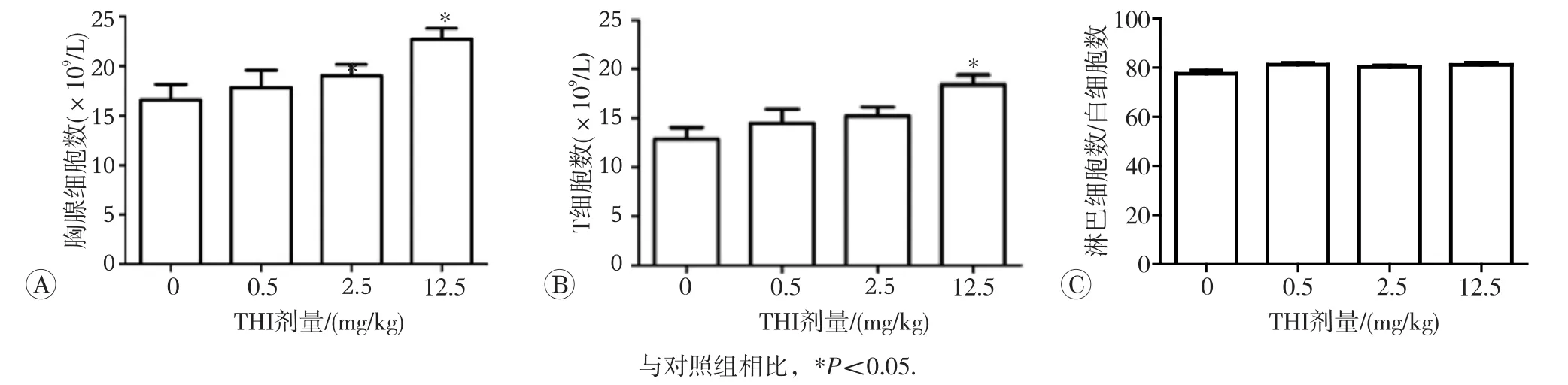
图4 THI染毒7d对小鼠胸腺细胞数的影响(n=12)

表1 THI染毒7d对T淋巴细胞不同亚群细胞数的影响(×109/L,n=12)
如图5所示,THI染毒30d,与对照组相比,2.5 mg/kg组胸腺细胞数和T细胞数显著性升高(P<0.05)。2.5mg/kg组CD4+T细胞和CD8+T细胞明显升高(P<0.05),0.5mg/kg剂量组CD4+T细胞数明显升高(P<0.05),但CD8+T细胞数未观察到明显变化。见表2。

图5 THI染毒30d对小鼠胸腺细胞数的影响(n=12)
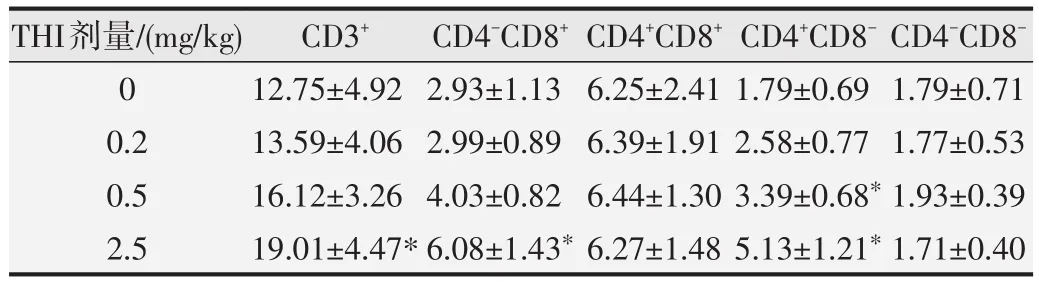
表2 THI染毒30d对T淋巴细胞不同亚群细胞数的影响(×109/L,n=12)
2.4 THI对T细胞增殖功能的影响
如图6所示,与对照组相比,THI染毒7d仅在12.5mg/kg剂量组表现出对T细胞增殖功能的抑制,THI染毒30d,0.5和2.5mg/kg剂量组T细胞增殖功能均明显降低(P<0.05)。
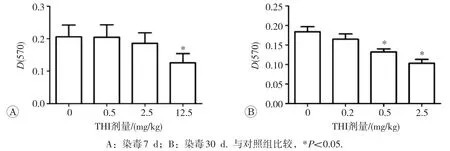
图6 THI对小鼠T细胞增殖功能的影响(n=12)
2.5 THI对NK细胞活性的影响
如图7所示,与对照组相比,THI染毒7d和30d后,均在2.5mg/kg剂量组观察到NK细胞活性明显降低(P<0.05);0.5mg/kg剂量组仅在30d染毒中表现出对NK细胞活性的影响(P<0.05)。

图7 THI对小鼠NK细胞活性的影响(n=12)
2.6 THI对T细胞趋化功能的影响
如图8所示,THI染毒7d,与对照组相比,在1 nmol/L的S1P处理组,CD4+T和CD8+T细胞均在12.5 mg/kg时出现对S1P趋化功能的明显降低(P<0.05),CD8+T细胞在2.5mg/kg剂量组也出现该功能的降低(P<0.05)。10nmol/L的S1P对CD4+和CD8+T细胞的趋化诱导作用最为明显,两种细胞在2.5和12.5mg/kg剂量组均出现趋化功能的明显降低(P<0.05);0.5mg/kg剂量组CD8+T细胞也表现出趋化功能的下降(P<0.05)。在100nmol/L浓度的S1P处理组,CD4+T细胞2.5和12.5mg/kg剂量组趋化功能受到抑制(P<0.05),而CD8+T细胞仅在12.5mg/kg剂量组出现趋化功能抑制(P<0.05)。

图8 THI染毒7d对T细胞趋化功能的影响(n=6)
如图9所示,在30d染毒实验中,与对照组相比,1和10nmol/L浓度S1P处理组,0.5和2.5mg/kg剂量组CD4+T细胞和CD8+T细胞的趋化功能均明显降低(P<0.05);100nmol/LS1P浓度处理组,0.5和2.5 mg/kg剂量组CD4+T细胞趋化功能明显受到抑制(P<0.05),但CD8+T细胞仅在2.5mg/kg剂量组表现出趋化功能的降低(P<0.05),0.5mg/kg剂量组未观察到该功能的明显改变。

图9 THI染毒30d对T细胞趋化功能的影响(n=6)
3 讨论
THI作为III类焦糖色生产加工过程中的主要副产物之一,因其在动物体内具有免疫毒性而得到广泛关注,但有关THI的毒理学研究,年代久远,资料陈旧,数据缺失严重,结果缺乏统一标准,且受限于实验方法和技术,评价内容和手段有限,不能针对敏感的毒性效应终点得到可靠的毒理学数据;研究对象较为单一,多数亚急性毒性实验和亚慢性毒性实验的研究对象均为大鼠,以小鼠为受试动物开展的相关研究较少。鉴于我国对于开展THI健康风险评估的迫切需要,本实验选用BALB/c雌鼠作为研究对象,运用多种敏感的免疫功能评价方法,从多个方面全面地、系统地评价了THI的对小鼠免疫功能的影响,包括非特异性免疫功能和特异性免疫功能,初步得到小鼠THI连续染毒30d的NOAEL水平为0.2mg/kg,对于开展THI风险评估具有重要的参考价值。
因多数研究指出,THI的免疫毒作用在啮齿类动物中不会表现出性别差异[13-15],故本实验选用单一性别小鼠作为研究对象。7d染毒实验剂量设置时,综合考虑III类焦糖色和THI在人群中的实际可能暴露水平[我国III类焦糖色平均摄入量约为33.71mg/(kg·d),其中THI平均摄入量约为24.12mg/(kg·d)]、JECFA和EFSA对于III类焦糖色中THI的限量规定以及对历史文献相关毒理学数据进行换算等多个方面,最终确定剂量梯度为0、0.5、2.5和12.5mg/kg。THI7d染毒的研究结果显示,THI表现出剂量反应关系和免疫抑制作用,2.5mg/kg剂量组在多项检测指标上已出现明显改变,同时0.5mg/kg剂量组在部分指标上已出现剂量相关的轻微变化,虽然差异不具有统计学意义。考虑到THI30d连续染毒实验更长的暴露周期,并以获得小鼠30d暴露的NOAEL水平为研究目的,故将30d染毒实验的剂量调整为0、0.2、0.5和2.5mg/kg。
研究结果显示,THI连续暴露7d和30d均不会改变小鼠体质量、摄食量和饮水量,也不会影响小鼠胸腺、肝、浅表淋巴结的质量和脏器系数。因7d染毒实验中未发现THI对双侧腹股沟淋巴结质量的影响,故在30d染毒实验中摘取了小鼠双侧腹股沟淋巴结、颌下淋巴结和腋下淋巴结,但均未在实验中观察到THI对这3类浅表淋巴结质量的影响。但值得注意的是,THI30d染毒在2.5mg/kg剂量组观察到脾脏质量的明显降低,而7d染毒2.5mg/kg剂量组及更高的12.5mg/kg剂量组均为未观察到脾脏质量的明显变化。
研究结果显示,THI在小鼠体内可引起血中白细胞数显著减少和胸腺细胞数显著增加。7d和30d染毒中,红细胞数、中性粒细胞数、单核细胞数等均未观察到明显变化,淋巴细胞变化情况与白细胞一致,且所占比例在各组基本保持不变,可认为外周血中白细胞数的减少是由于淋巴细胞数减少所引起的,而胸腺细胞总数的升高是由于T细胞数明显增加导致的。两次实验中胸腺细胞总数变化情况与T细胞变化情况均保持一致,且T细胞占胸腺细胞总数比值在各组间基本保持一致。同时还观察到THI可对胸腺T细胞亚群细胞数产生明显影响。THI染毒7d,2.5和12.5 mg/kg剂量组的单阳性T细胞(CD4+和CD8+)数均显著性升高,双阳性(CD4+CD8+)和双阴性(CD4-D8-)T细胞数基本保持不变,而THI30d染毒2.5mg/kg剂量组单阳性T细胞数也出现明显升高,0.5mg/kg剂量组仅出现CD4+T细胞数的升高,CD8+T细胞数未观察到明显变化。以上实验结果提示THI可能影响T细胞阳性选择过程或影响T细胞凋亡,但已有研究指出THI不会改变胸腺中T细胞凋亡比率[16],故THI是否作用于T细胞分化成熟过程有待进一步的研究。
在THI对免疫功能影响方面,7d染毒仅在12.5 mg/kg剂量组出现T细胞增殖功能的明显降低,而30 d染毒的0.5和2.5mg/kg剂量组均出现T细胞增殖功能受损,两次实验脾中T细胞数各剂量组与对照组相比未出现明显差异,说明THI可以抑制单个T细胞的增殖功能。THI染毒7d的2.5和12.5mg/kg剂量组出现NK细胞活性的降低,0.5mg/kg剂量组未观察到该现象,而30d染毒的0.5和2.5mg/kg均表现出NK细胞活性的明显降低。趋化性功能研究中,连续染毒7d和30d,CD4+和CD8+T细胞均对10nmol/L浓度的S1P处理表现出最强的趋化能力,同时该条件在THI作用下,两种细胞趋化功能受损程度最大。7d染毒2.5和12.5mg/kg剂量组CD4+T细胞在10和100nmol/L S1P浓度处出现趋化功能降低,仅12.5mg/kg剂量组在1nmol/L浓度处理下细胞出现功能受损,而2.5和12.5mg/kg剂量组的CD8+T细胞在1和10nmol/LS1P浓度处理条件下均出现趋化功能降低,100nmol/L浓度处理组该细胞功能的降低仅在12.5mg/kg剂量组出现,说明CD8+T细胞对低浓度S1P的趋化功能在THI连续染毒7d条件下更易受到影响,而CD4+T细胞对较高浓度S1P的趋化功能改变更易在THI连续染毒7d条件下出现。30d染毒实验中,0.5和2.5mg/kg剂量组CD4+T细胞在3种浓度S1P条件下均出现趋化功能明显降低,CD8+T在1和10nmol/LS1P浓度处理下出现趋化功能受损,100nmol/LS1P处理下功能的降低仅在2.5mg/kg剂量组出现。研究结果显示,CD4+T细胞和CD8+T细胞针对不同浓度S1P的趋化功能,受到THI染毒剂量和染毒周期的影响,本实验为进一步开展THI相关研究时设置的染毒剂量、染毒时间和设置的S1P浓度条件,合理选择细胞类型提供了依据。
从THI连续染毒7d和30d实验结果来看,THI可以抑制小鼠的细胞免疫功能,引起血液淋巴细胞减少,胸腺中单阳性T细胞增加、T细胞趋化功能受损等。染毒剂量为0.5mg/kg条件下,当染毒时间从7d延长至30d时,会表现出7d染毒实验中未出现的免疫抑制作用,说明THI的毒性作用具有剂量和时间依赖性。在本研究中,THI连续染毒30d,0.2mg/kg剂量组未出现明显毒性作用,且有研究表明,略高于0.2mg/kg剂量THI连续染毒30d不会引起小鼠胸腺组织病理样改变[17-19],可初步认为0.2mg/kg是小鼠THI连续暴露30d的NOAEL水平,但是否是小鼠THI作用的安全剂量,还需要更长染毒时间的毒性研究进一步确认。

