肉苁蓉苯乙醇总苷脂质体对大鼠肝星状细胞增殖、凋亡及细胞周期的影响
张石蕾,由淑萍,马晓婷,马 龙,赵 军,刘 涛,*
(1.新疆医科大学公共卫生学院卫生毒理学教研室,新疆 乌鲁木齐 830011;2.新疆医科大学护理学院基础护理学教研室,新疆 乌鲁木齐830011;3.新疆维吾尔族自治区药物研究所,新疆 乌鲁木齐 830004)
肝纤维化的发展和结局是一个复杂的过程,涉及实质和非实质肝细胞以及浸润的免疫细胞。由于细胞外基质(extracellularmatrix,ECM)蛋白质的产生、沉积增加而形成瘢痕的纤维反应是肝脏结构变化的关键步骤[1]。活化的肝星状细胞(hepaticstellatecells,HSCs)转为静止状态及其凋亡是逆转肝纤维化的关键因素[2]。肉苁蓉是常见的补益类中药,因其疗效切实,药性温和,自古就被视为强身壮体、滋补的中药,有“沙漠人参”之佳誉。化学及药理作用研究显示肉苁蓉苯乙醇总苷(Cistanchephenylethanoid glycosides,CPhGs)具有抗氧化、抗抑郁、抗炎、抗病毒、抗肿瘤、抗菌和免疫调节等多种生物功能,是肉苁蓉发挥药效的主要物质基础之一[3]。本课题组前期实验研究证实,CPhGs对改善肝功能、抗肝纤维化有显著疗效,且随CPhGs浓度的增加,HSCs的凋亡率逐渐增高,呈现一定的剂量依赖关系[4]。目前许多已经被批准临床应用的抗肝纤维化作用药物,对晚期肝纤维化和肝硬化的治疗效果不佳,因此,研发靶向高效、高纯度、高稳定性、低免疫原性的抗肝纤维化药物势在必行。脂质体作为新型药物载体,可以增加药物透过细胞膜的能力,能够迅速到达病灶且主要分布于肝脏,从而降低药物毒性,其缓释性更能够增强药物的作用浓度,延长作用时间,减少药物用量,提高药物疗效[5-6]。因此,本实验以脂质体为药物载体包裹传统中药制成CPhGs脂质体,研究CPhGs脂质体对体外培养大鼠肝星状细胞增殖、凋亡、周期的作用,并初步探讨其相关的分子机制,旨在研究可能为临床所用的抗肝纤维化的靶向药物治疗途径,为进一步药物开发提供实验依据。
1 材料与方法
1.1 实验材料
HSCs,购于上海中乔新舟生物科技有限公司;胎牛血清,购于美国Gibco公司,-20℃分装保存;双抗(青霉素、链霉素)、DMEM高糖培养基、0.25%胰酶(1×),均购于美国Hyclone公司;AnnexinV-FITC细胞凋亡检测试剂盒、细胞周期检测试剂盒,均购于美国BD公司;四甲基偶氮唑盐MTT、DMSO,均购于美国Sigma公司;兔抗β-actin多克隆抗体,购于北京博奥森生物科技有限公司。
1.2 实验仪器
超净工作台,美国ThermoScientific公司;CK-40型荧光倒置显微镜,日本Olympus公司;AEL-200型电子天平;TGL-16G型台式低温高速离心机;CO2细胞培养箱,英国NEWBRUNSWICKGalaxy®系列;全波长自动酶联免疫反应检验测试仪,美国Thermo Scientific公司;低温离心机,美国Sigma公司;数显恒温水浴锅,上海博迅实业有限公司医疗设备厂;脱色摇床,北京市六一仪器厂;电热恒温培养箱,上海一恒科技有限公司;Westernblot使用的电源、电泳装置及转膜装置,美国Bio-Rad公司;移液器,美国ThermoScientific公司;FluorChemE化学发光高灵敏凝胶成像仪,美国ProteinSimple公司。
1.3 CPhGs脂质体的制备
采用薄膜分散法制备CPhGs脂质体。称取卵磷脂、DPPC、胆固醇(质量比 5mg∶10mg∶10mg),溶于适量氯仿和甲醇混合溶剂中(V氯仿∶V甲醇=2∶1),在49~50℃下旋转使成膜状,加入250μg/mL的苯乙醇总苷不断旋转水化,使磷脂膜转入水中形成脂质体,将所得脂质体放入4℃冰箱中备用。所得脂质体用0.45μm的微孔滤膜挤压4~5次,0.22μm的微孔滤膜挤压18~20次,即得粒径均匀的苯乙醇总苷脂质体。包封率(38.46±7.85)%;电位45mV;粒径209 nm;载药量(3.71±0.23)%。
1.4 细胞培养及分组
将复苏的HSCs常规培养于含10%胎牛血清的DMEM培养基中,培养在37℃、CO2体积分数为5%的厌氧培养箱中,待细胞贴壁率约为80%时即可传代,复苏后传2~3代,待细胞状态稳定后即可用于实验。将HSCs分为4组:空白对照组(未加入受试物,只加培养液)、CPhGs脂质体低、中、高浓度(分别为7.36、14.72、29.45 μg/mL)处理组。
1.5 MTT法检测CPhGs脂质体对HSCs增殖的影响
选择对数生长期的细胞、弃去培养液,加入500 μL0.25%的胰酶进行消化,制备单细胞悬液,调整细胞浓度为1×105个/mL后接种96孔板,每孔100μL,12h贴壁后,吸去上清液,加入含各浓度CPhGs脂质体药物的完全培养基,每孔100μL,每个浓度设3个复孔。CPhGs脂质体药物用完全培养基倍比稀释成7.36、14.72、29.45μg/mL共3个浓度。分别于培养24、48、72h后加入5mg/mL的MTT20 μL,4h后吸去上清加入150μLDMSO,492nm处测定吸光度D(492)值,并计算其均值。

1.6 流式细胞术检测CPhGs脂质体对HSCs凋亡的影响
HSCs按1×105个/mL的浓度接种至6孔板,分组情况同1.4,给予受试物24h后将细胞吸至15mL离心管,每孔加入500μL胰酶消化细胞,用对应的完全培养液终止消化,轻轻吹打孔里的细胞混匀,每孔加入2mLPBS冲洗细胞,将孔里的PBS移至15mL离心管,尽可能多收集孔里的细胞,1000r/min离心5 min后弃上清,加5mLPBS至15mL离心管冲洗细胞,重复1次。每个样品加入100μL1×Binding Buffer,重悬细胞,将细胞移至1.5mLEP管,各样品加AnnexinV、PE双染,混匀避光放置30min后,分别加入400μLBindingBuffer,1h内上机检测细胞凋亡率。
1.7 流式细胞术检测CPhGs脂质体对HSCs周期的影响
HSCs按1×105个/mL的浓度接种至6孔板,细胞分组及处理同1.4。完成后逐滴加入5mL或更多预冷的75%的乙醇,涡旋以混匀细胞,4℃避光过夜(>18 h)。1000r/min离心10min后弃上清,清洗细胞2次以去除所有的乙醇。分析前4℃避光保存样本,1h之内采用流式细胞仪检测细胞周期。
1.8 CPhGs脂质体对HSCs中caspase-3和p27蛋白表达的影响
HSCs按1×105个/mL的浓度接种至6孔板,分组情况同1.4,给予受试物24h后收集细胞,提取各组细胞中的总蛋白,上样于聚丙烯酰胺凝胶进行还原性SDS-PAGE电泳,湿转(PVDF膜),200mA恒流电转90min。封闭液(5%脱脂奶粉)封闭PVDF膜过夜,用1×TBST缓冲液充分振荡清洗,TBST稀释抗体,一抗浓度分别为 caspase-3(1∶1000)、p27(1∶1500)、β-actin(1∶5000),ECL显色。FluorChemE化学发光高灵敏凝胶成像仪上检测条带灰度值。
蛋白相对表达量=目的条带灰度值/内参条带β-actin灰度值×100%
1.9 统计学方法
2 结果
2.1 CPhGs脂质体对HSCs增殖的影响
采用MTT比色法检测CPhGs脂质体对HSCs增殖的影响,结果见图1。与空白对照组相比,CPhGs脂质体低、中、高即7.36、14.72、29.45μg/mL剂量组的细胞生长速度均明显减慢(P<0.05)。同一时间点,与空白对照组相比较,随着药物浓度升高,抑制细胞增殖作用增加(P<0.05);同一浓度组,随时间延长,细胞活力不断降低;且随着时间以及药物浓度的增加,抑制HSCs增殖能力不断上升。提示CPhGs脂质体具有抑制HSCs增殖的作用。
2.2 CPhGs脂质体对HSCs凋亡的影响
7.36 、14.72、29.45μg/mL的CPhGs脂质体作用于HSCs24h后,早期凋亡与晚期凋亡的细胞总和分别为(18.5±2.7)%、(26.6±2.3)%、(31.6±1.9)%,与空白对照组的(5.0±0.9)%相比,差异均有统计学意义(P<0.05),结果见表1和图2。分析表明CPhGs脂质体3个剂量组均可明显诱导HSCs的早、晚期凋亡(与空白对照组比较,P<0.05),提示CPhGs脂质体可通过诱导HSCs凋亡,从而抑制HSCs的激活及肝纤维化的发生。
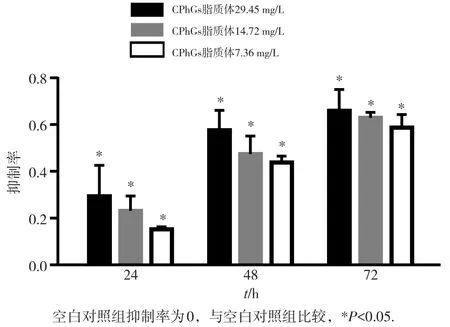
图1 MTT法检测CPhGs脂质体对HSC增殖的影响
表1 CPhGs脂质体各剂量组对HSCs细胞凋亡率的影响(n=3,)

表1 CPhGs脂质体各剂量组对HSCs细胞凋亡率的影响(n=3,)
与空白对照组比较,*P<0.05
images/BZ_33_1273_1476_2297_1713.png
2.3 CPhGs脂质体对HSCs细胞周期的影响
细胞周期分析结果(表2和图3)显示,CPhGs脂质体各剂量组处理的HSCs,与空白对照组相比,G0/G1期的细胞比例均明显增多(P<0.05),而S期细胞比例明显减少(P<0.05),G2/M期细胞比例明显减少(P<0.05)。提示CPhGs脂质体可通过诱导细胞周期阻滞抑制HSCs增殖,CPhGs脂质体可引起细胞周期明显阻滞。
表2 CPhGs脂质体各个剂量组对HSC周期的影响(%,n=3,)

表2 CPhGs脂质体各个剂量组对HSC周期的影响(%,n=3,)
与空白对照组比较,*P<0.05.
images/BZ_33_1273_2325_2297_2561.png
2.4 CPhGs脂质体对大鼠肝星状细胞caspase-3、p27蛋白表达水平的影响
Westernblot检测结果见图4。与正常对照组比较,CPhGs脂质体(29.45、14.72μg/mL)组大鼠肝星状细胞caspase-3蛋白的表达水平明显升高,差异有统计学意义(P<0.05);其中CPhGs脂质体29.45μg/mL浓度组上调作用最明显(P<0.05);与空白对照组比较,CPhGs脂质体各剂量组p27蛋白的表达水平均明显升高,差异有统计学意义(P<0.05);CPhGs脂质体29.45 μg/mL浓度组上调作用最明显(P<0.05)。

图2 AnnexinV-FITC/PE双染流式细胞术检测CPhGs脂质体对HSCs细胞凋亡的影响

图3 PE单染流式细胞术检测CPhGs脂质体对HSCs细胞周期的影响
3 讨论
肝纤维化是因ECM合成与降解失衡所致,是各种肝病发展为肝硬化的共同途径。HSCs的激活是肝纤维化形成的中心环节,在肝损伤修复过程中发挥作用。肝损伤后,HSCs受各种致病因子刺激,从静态转化为具增生性、纤维原性和可收缩性的肌成纤维细胞,肌成纤维细胞产生大量ECM沉积于肝脏,最终导致肝纤维化。近年来研究发现,随着肝星状细胞数量的减少,肝纤维化程度可得到明显改善[7-8]。因此,抗肝纤维化的药物研究多数以肝星状细胞为作用点寻找突破,经抑制炎症反应,减少肝损伤因素如酒精药物等,干扰相关细胞因子的活性调节和信号转导的正常进行,以达到抑制肝星状细胞活化及增殖,并诱导其凋亡,减少ECM生成,寻找能以HSCs为作用靶点,成为治疗肝纤维化的重要策略[1]。

图4 Westernblot检测CPhGs脂质体处理HSCs后caspase-3、p27蛋白的表达水平
迄今为止,国内外的研究中,抑制HSCs活化并促进其凋亡、调节ECM的合成和降解等方面已取得一些成果,对肝纤维化的临床治疗提供了一些药物和方法,但总体疗效仍不理想。目前多认为,限制抗肝纤维化药物效果的原因,可能与药物无法达到靶细胞、或到达靶细胞但无法在其周围形成有效的药物浓度及半衰期短和药物对其他组织细胞的副作用大过增加剂量带来的疗效等有关[9]。随着肝脏疾病病死率的提高和中医药现代化进程的深入,中药防治肝纤维化的机制研究越来越被人们所关注,可用于肝纤维化防治药物的分子靶点也与日俱增[10]。肉苁蓉(CistanchesHerba)为列当科植物肉苁蓉(CistancheDeserticolaY.C.Ma)或管花肉苁蓉[C.tubulosa(Schenk)Wight]的干燥带鳞叶的肉质茎,作为滋补类传统中药在中国具有悠久的应用历史化学作用及药理作用[11]。课题组前期研究结果显示,CPhGs可明显抑制HSC的增殖,诱导其凋亡。且随CPhGs浓度的增加,HSCs的凋亡率逐渐增高,预示其在治疗肝脏疾病中有着广阔的应用前景[12]。因此,研发靶向高效、高纯度、高稳定性、低免疫源性的CPhGs势在必行,同时应加强CPhGs抗肝纤维化机制的深入研究,为进一步可能的临床研究提供最扎实的理论基础。本实验在体外水平研究3种不同剂量的CPhGs脂质体对HSCs增殖、凋亡、周期及相关蛋白表达的影响,探讨CPhGs脂质体的抗肝纤维化机制,以期为肝纤维化的防治奠定基础。
MTT检测结果显示,高、中及低剂量组CPhGs脂质体各浓度组24、48及72h均能抑制HSCs的增殖(P<0.05)。
细胞凋亡,又称程序性细胞死亡,细胞调亡是由基因调控的一种主动的细胞死亡过程,在某些生理或病理条件下,对维持机体正常的生理和功能活动具有重要的生物学意义[13]。Caspase蛋白家族成员组成凋亡通路的关键基因,细胞色素C是发现的第一种线粒体释放促凋亡蛋白,是线粒体呼吸链的重要组成部分。细胞色素C使Apaf1寡聚化并能使caspase-9前体聚集,最终导致caspase-9前体水解形成活性酶。随后caspase-9促使其他caspase酶(如caspase-7)的执行者即caspase-3前体转换为有活性的caspase-3。Caspase-3是细胞凋亡早期一种非常重要的物质,被认为是执行酶中最为重要的一个,能够被所有的起始凋亡蛋白酶活化,并降解细胞主要结构,最终瓦解细胞[14]。本次细胞凋亡检测结果显示,CPhGs脂质体3个剂量组均可明显诱导大鼠肝星状细胞的早、晚期凋亡(与空白对照组比较,P<0.05)。蛋白水平检测结果显示,与正常对照组细胞相比,在CPhGs脂质体(29.45、14.72μg/mL)处理的细胞中,caspase-3蛋白水平表达显著上调。这与细胞凋亡分析结果显示的CPhGs脂质体处理的HSCs出现了明显凋亡,证实CPhGs脂质体可能是通过上调caspase-3基因的表达而抑制细胞的增殖能力,从而诱导HSCs发生凋亡。
细胞周期分为分裂间期和分裂期,其中分裂期又可分为:DNA合成前期(G1期)、DNA合成期(S期)和DNA合成后期(G2期)[15]。细胞周期的正常运行依赖于正、负调节因子的共同参与。正调节因子包括细胞周期蛋白(cyclin)和细胞周期蛋白依赖性激酶(cyclin dependentkinase,CDK);负调节因子主要是细胞周期蛋白依赖性激酶抑制剂(cyclindependentkinase inhibitor,CKI)。以上3种调控因子在维持细胞有序的增殖、分裂活动中起重要作用,三者相互作用,共同参与细胞周期调控[16]。p27属于CKI,可通过抑制cyclin/CDK形成异二聚体结构,使细胞停滞于G1期,从而实现对细胞周期的调控功能[17]。细胞周期检测结果显示,CPhGs脂质体3个剂量组处理的HSCs,与空白对照组相比,G0/G1期的细胞比例均明显增多(P<0.05),而S期细胞比例明显减少(P<0.05),G2/M期细胞比例明显减少(P<0.05),且呈一定的剂量依赖关系。与正常对照组细胞相比,在CPhGs脂质体(7.36、14.72、29.45μg/mL)处理的细胞中,p27蛋白水平表达显著上调。这与细胞凋亡分析结果显示的CPhGs脂质体处理的细胞出现明显的G1期阻滞,S期和G2/M期细胞比例显著减少是一致的。说明p27在CPhGs脂质体抑制HSCs增殖中可能具有重要作用。
本研究结果显示,在细胞水平上,探讨了CPhGs脂质体对HSCs的影响。将不同剂量的CPhGs脂质体药物对HSC进行处理,CPhGs脂质体3个剂量组均可以抑制HSC的增殖,增加了HSC的凋亡,这一过程可能是通过激活以及caspase-3蛋白表达而引起细胞凋亡。此外,CPhGs脂质体可使HSC细胞周期更多地停滞在S期,可能的作用机制是影响了细胞周期蛋白p27蛋白的表达,从而抑制细胞周期的能力。提示细胞凋亡和细胞周期调节是CPhGs脂质体防治肝纤维化的两个靶点,根据这一结论,可对细胞周期和凋亡相关的信号通道进行更深入的研究,进一步揭示CPhGs脂质体的抗纤维化机制,以达到靶向或抑制肝纤维化的目的。
(本实验主要在新疆医科大学中心实验室完成,在此特别感谢实验室的负责老师及研究生同学的支持与帮助)

