在学科融合中全面培养学生的学习能力和综合素养
宁夏
王开山
学科融合是多门学科的参与和介入,旨在通过多门学科资源的融合,有效地呈现问题、解答问题,在更好地达到教学目标的过程中全面培养学生的学习能力和综合素养。将数学学科对数函数、坐标图与化学学科电解质溶液融合为一体的图象问题就是非常好的学科融合的范例。
以数学学科对数(常用对数)为数据处理方式,以坐标图象为信息呈现方式,考查电解质溶液中微粒之间的定量关系是近年化学高考热门题型。该类型试题信息新颖,问题设置灵活、多变,考查学生整合不同学科信息的能力,综合性较强。
一、对数应用在电解质溶液相关试题中的优势
对数的出现化简了大数据的计算,改进了数字的计算方法,已经在各个领域发挥着重要作用。将对数作为数据处理方式,可以使电解质溶液中复杂的离子浓度关系在坐标轴上形象地呈现出来。数学学科的精确性和化学原理的逻辑性得到巧妙融合。
1.微粒在电解质溶液中浓度一般都比较小,直接用数据表达不方便。对一些较小(<10-1)的数据取常用负对数后可以变为整数,便于后续分析和比较。例如,c(H+)=10-4mol/L,pH=-lg10-4=4。
2.电解质溶液微粒之间量的关系一般是非线性的,取对数后可以实现将一些物理量之间的非线性关系转变为线性关系,使图象信息更加直观。例如变量之间的曲线关系xy=k(x>0,y>0)取对数后转变为x′+y′=k′的直线关系。
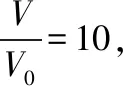
二、学科融合思想下解答电解质溶液相关试题策略分析
1.平衡移动是分析电解质溶液微粒变化的核心原理。通过数与形的相互转化来解决问题的数形结合是数学核心思想之一。将化学平衡移动过程中“数”的变化以“形”的方式呈现在对数坐标图中,能很好地解答与化学反应原理和反应过程中平衡移动有关的问题。
2.数学上常用对数函数:y=lgx(因变量y和自变量x成正比)和常用负对数函数:y=-lgx(因变量y和自变量x成反比)是解决电解质溶液中不同微粒浓度之间定量关系的重要切入点。
3.对坐标曲线上关键点(起步点、交叉点)的物理意义及其数据的分析融合数学学科数据分析核心素养和化学学科证据推理核心素养,是判断强弱电解质、计算平衡常数的重要证据。
三、试题赏析
【例1】(2017·全国卷Ⅲ·13)在湿法炼锌的电解循环溶液中,较高浓度的Cl-会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是
( )
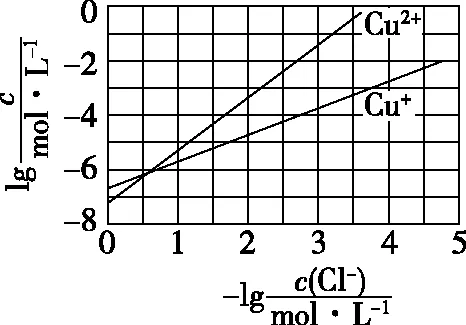
A.Ksp(CuCl)的数量级为10-7

C.加入Cu越多,Cu+浓度越高,除Cl-效果越好

【答案】C
【解答要点】横轴和纵轴所表示的物理量和变化趋势以及坐标轴中的关键点数据是解答问题的关键。

【点评】本题以含铜化合物的性质及应用为素材,综合考查Ksp的计算、反应原理、平衡移动的分析、平衡常数,对学生的分析能力和计算能力要求较高。注意题中所给信息以及图标的分析,把握溶度积的计算,难度适中。
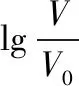
( )
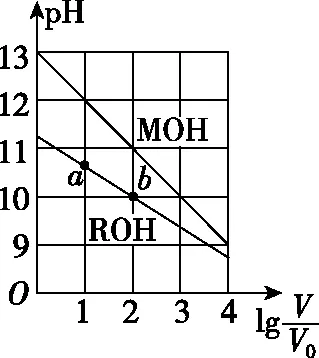
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
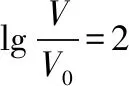
【答案】D
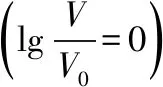

【点评】本题基于弱电解质的“越稀越电离”原理,以坐标图直观呈现了强弱电解质溶液稀释与pH变化之间的关系,重在考查学生对图象的分析能力,试题难度适中。
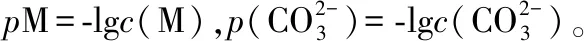
( )
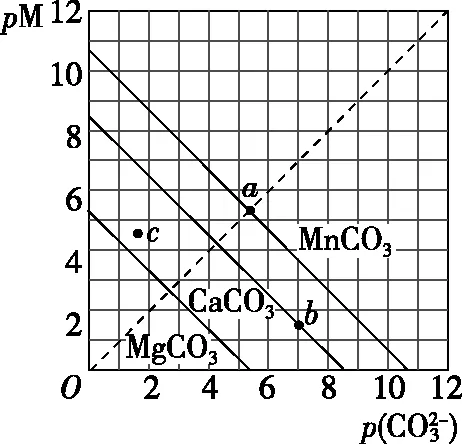
A.MgCO3、CaCO3、MnCO3的Ksp依次增大
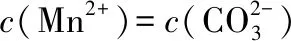

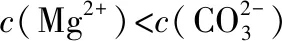
【答案】BD
【解答要点】线上的任何一点都代表相应难溶电解质的饱和溶液,线右上方的点代表该难溶电解质的不饱和溶液,难溶物在不断溶解;线左下方的点代表该难溶电解质的过饱和溶液,有沉淀不断析出。
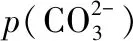
【点评】本题基于难溶电解质沉淀溶解平衡的Ksp,通过取负对数将难溶电解质离子浓度之间的非线性关系转变为线性关系。侧重考查学生基于图象的分析能力和计算能力,难度适中。
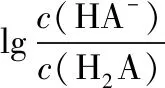
( )

B.该温度下,H2A的Ka2约为10-4.1
D.若升高温度,则图中曲线a、b上移
【答案】C
【解答要点】二元弱酸的电离程度与相应溶液的碱性有关。溶液碱性越强,二元弱酸的电离程度越大,离子的浓度也会发生变化。温度不变时,电离平衡常数Ka1、Ka2都是定值,可选取关键点进行计算。

【点评】本题基于二元弱酸的分步电离,通过取常用对数,建立起离子浓度比值与溶液pH之间的关系,全面考查外界条件对弱电解质电离的影响。对学生的“量意识”要求较高。

