物质结构与性质分析思维模型的构建及应用
广东
刘汉国
物质结构包括原子结构(原子核外电子排布、原子的杂化方式、元素电负性大小比较、元素金属性、非金属性的强弱)、分子结构(化学键、分子的电子式、结构式、结构简式的书写、化学式的种类、官能团等)、晶体结构(晶体类型的判断、物质熔沸点的高低、影响因素、晶体的密度、均摊方法的应用等)。物质结构的考查,涉及前36号元素核外电子排布式的书写、元素周期律、第一电离能规律、空间构型、杂化轨道、晶体熔点高低的判断、晶体类型以及晶胞的计算等,要求学生掌握物质结构与性质基础知识,做到知识的灵活运用等,考查了学生综合运用所学化学知识解决相关化学问题的能力。只有掌握这些,才可以更好地解决物质结构的问题。本文通过构建“分析晶体熔沸点、分析空间立体构型和晶体密度相关计算”的思维模型,突破考查物质结构与性质知识的难题,供同仁们在教学时参考借鉴。
一、思维模型的构建与应用
1.分析晶体熔沸点的思维模型
在分析晶体熔沸点时,首先判断晶体属于同种类型还是不同种类型,若为不同种晶体类型,则按照一般规律:原子晶体>离子晶体>分子晶体,而金属晶体的熔沸点差别很大,如钨、铂等沸点很高,汞、镓、铯等沸点很低,金属晶体一般不参与比较。若为同种晶体类型:原子晶体中原子半径小的键长短,键能大,晶体的熔沸点高;离子晶体,一般地说,阴、阳离子所带电荷数越多,离子半径越小,则离子间的相互作用就越强,其离子晶体的熔沸点就越高;分子晶体,分子间作用力越大,物质的熔沸点越高;具有氢键的分子晶体,熔沸点反常的高;金属晶体,金属离子半径越小,离子所带电荷数越多,其金属键越强,金属熔沸点就越高。构建分析晶体熔沸点的思维模型如图1所示。
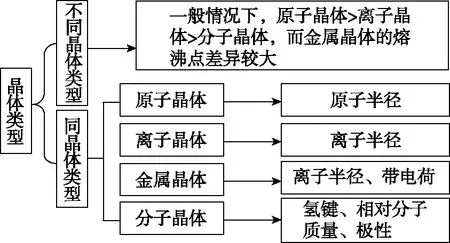
图1 分析晶体熔沸点的思维模型
【例1】(2018·全国卷Ⅱ·35·节选)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为___________________。

图(a)
【答案】S8相对分子质量大,分子间范德华力强
【解析】根据分析晶体熔沸点的思维模型,首先判断出S8和二氧化硫同属于分子晶体类型,而S8的相对分子质量比二氧化硫的相对分子质量大,S8的分子间范德华力比二氧化硫的大,所以S8的熔点和沸点比二氧化硫的高。
【例2】(2016·全国卷Ⅲ·37·节选)砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:GaF3的熔点高于1 000℃,GaCl3的熔点为77.9℃,其原因是___________________。
【答案】GaF3为离子晶体,GaCl3为分子晶体
【解析】根据分析晶体熔沸点的思维模型,GaF3的熔点高于GaCl3,而GaF3相对式量低于GaCl3,因此可以推断出GaF3与GaCl3属于不同晶体类型。由不同类型晶体熔点高低的一般规律可以推断出:GaF3是离子晶体,GaCl3是分子晶体,所以离子晶体GaF3的熔沸点更高。
2.分析空间立体构型的思维模型
由价层电子特征判断分子立体构型时需注意:价层电子对互斥模型说明的是价层电子对的立体构型,而分子的立体构型指的是成键电子对的立体构型,不包括孤电子对。①当中心原子无孤电子对时,两者的构型一致;②当中心原子有孤电子对时,两者的构型不一致;价层电子对互斥模型能预测分子的几何构型,但不能解释分子的成键情况;杂化轨道理论能解释分子的成键情况,但不能预测分子的几何构型。两者相结合,具有一定的互补性,可达到处理问题简便、迅速、全面的效果。分析空间立体构型时,对于ABm型分子或离子,可以先根据价层电子对互斥模型判断出杂化类型,再根据孤对电子的有无,最终判断出分子或离子的空间构型;而对于AnBm型分子或离子,要根据结构求出σ键数和孤对电子的数目判断出杂化类型,再根据孤对电子的有无最终判断出分子或离子的空间构型。构建分析空间立体构型的思维模型如图2所示。
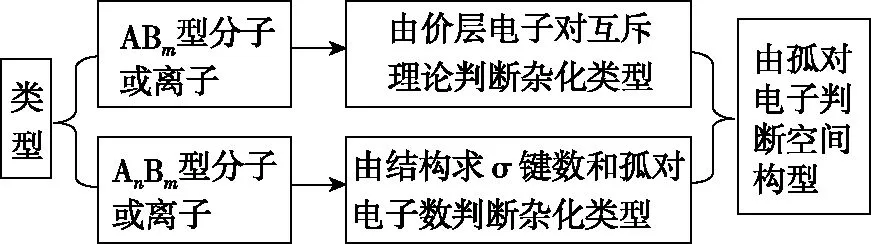
图2 分析空间构型的思维模型
【例3】(2018·全国卷Ⅱ·35·节选)气态三氧化硫以单分子形式存在,其分子的立体构型为________形,其中共价键的类型有________种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。

图(b)
【答案】平面三角 2 sp3
【解析】气态三氧化硫以单分子形式存在,根据价层电子对互斥模型计算出中心原子含有的价层电子对数是3,从而判断出中心原子杂化类型为sp2,且不存在孤对电子,所以其分子的立体构型为平面三角形;分子中存在氧硫双键,因此其中共价键的类型有2种,即σ键、π键;固体三氧化硫中存在如图(b)所示的三聚分子,根据结构求出该分子中硫原子形成4个σ键,孤对电子的数目为0,因此其杂化轨道类型为sp3。
【答案】V形 sp3

【答案】sp2和sp39NA
【解析】丙酮属于AnBm型分子,根据结构可知甲基上每个C原子都有4个σ键且无孤对电子,故甲基上的碳原子的杂化方式为sp3,同理,羧基(或酮基)上的碳原子为sp2杂化;据以上分析1 mol丙酮分子中含有σ键的数目为9NA。
3.晶体密度相关计算的思维模型
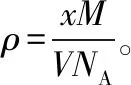
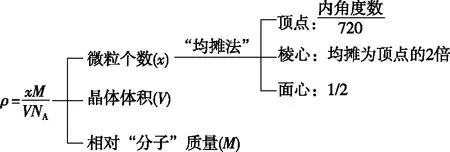
图3 晶体密度相关计算的思维模型

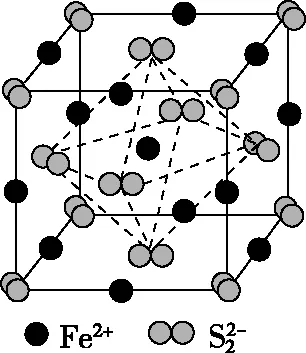
图(c)
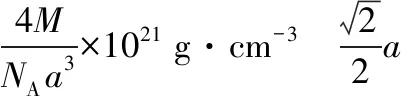
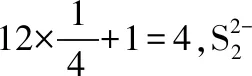
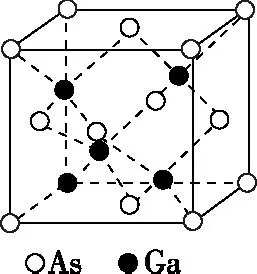
【例7】(2016·全国卷Ⅲ·37·节选)砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:GaAs的熔点为1 238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGag·mol-1和MAsg·mol-1,原子半径分别为rGapm和rAspm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为________。
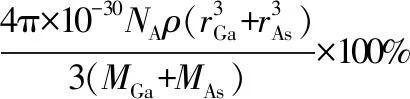
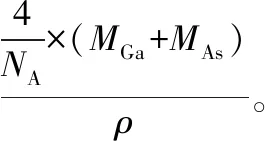
二、备考建议
1.结合《考试大纲》,夯实基础
一轮复习时,教师应引导学生依据《考试大纲》,结合教材,逐一把考点消化。对于晶体结构的相关计算,一是要掌握晶体“均摊法”的原理,二是要有扎实的立体几何知识,三是要熟悉常见晶体的结构特征,并能融会贯通,举一反三。
2.精选习题,适量训练
复习中,除了注重知识的网络构建,也要重视练习。选择高考热点、难点、易错点等典型题目进行适量练习,在训练中掌握常考题目的套路,寻找创新题的答题模式。
3.细研真题,构建模型
把同种类型的高考题放在一起,准确了解高考题型、命题方式、命题意图和热点,难点,通过构建思维模型,形成高效的解题思维,提高解题效率,提升解题能力。

