一种EDTA测定含钡矿物中铅含量的新方法
施宏娟
(昆明冶金研究院, 云南 昆明 650031)
EDTA滴定法测定矿物中的铅,一般采用硫酸溶解矿物样品,生成硫酸铅沉淀,使其与其它杂质分离,然后在pH值在5.5~6.0的乙酸- 乙酸钠缓冲溶液中,通过滴定EDTA与铅形成络合物来测定铅[1]。但用此方法在测定含钡矿物的铅含量时,铅元素是以硫酸铅钡沉淀状态存在,该沉淀物不能溶于pH值为5.5~6.0的乙酸- 乙酸钠缓冲溶液中,使得测定终点不稳定造成结果偏低[2-6]。为消除钡离子的干扰,在长期试验中发现,在氨性溶液中加入硫酸钾使钡离子先沉淀为硫酸钡,之后加入1∶1的硫酸沉淀铅离子,此时利用硫酸钡不溶于乙酸- 乙酸钠缓冲溶液,而硫酸铅能完全溶解于缓冲液的特性,在pH值为5.5~6.0的乙酸- 乙酸钠缓冲溶液中通过EDTA标准溶液滴定,从而测定铅的含量。该方法能有效消除钡离子的影响,测定终点稳定,操作简便,且与国家标准方法GB/T 8152.2—2006中的硫酸铅沉淀- EDTA返滴定法[7]结果一致。
1 试验部分
1.1 主要仪器
电子分析天平(AB104-S)。
1.2 主要试剂
EDTA:0.01 mol/L AR;
盐酸:1.19 g/mL AR;
硝酸:1.42 g/mL AR;
硫酸:1.84 g/mL AR;
氢氟酸:1.15 g/mL AR;
酒石酸:AR;
柠檬酸:200 g/L AR;
氨水:AR;
硫酸钾:AR;
硫酸:(1+1)AR;
乙酸- 乙酸钠缓冲:200 g/L AR(pH介于5.5~6.0);
二甲酚橙溶液:5 g/L AR;
硫酸钾洗液配制:25 g/L硫酸钾+20 mL硫酸。
1.3 试验方法
称取试样0.100 0 g至250 mL烧杯中,用少量蒸馏水润湿样品,加入15 mL盐酸和5~10滴氢氟酸,加热煮沸后加入5 mL硝酸,盖表皿高温电炉加热至近干(剩余体积约为3 mL)。取下烧杯吹洗表皿及杯壁,加入适量酒石酸和10 mL柠檬酸,加热煮沸,取下烧杯冷却加入15 mL氨水和10 g硫酸钾,蒸馏水稀释至100 mL。低温煮沸30 min(此步骤形成硫酸钡沉淀并出去多余的氨水),加入5 mL(1+1)硫酸,蒸馏水稀释至150 mL,加热煮沸,冷却沉淀1 h,快速定量滤纸过滤,用洗液吹洗烧杯及沉淀各4遍,将沉淀吹洗至烧杯,滤纸置于杯壁,加入20 mL缓冲溶液。将烧杯置于电炉上煮沸2 min,取下后趁热将滤纸浸入试液,用水稀释至体积约为150 mL,滴入2滴二甲酚橙溶液,用EDTA标准液滴定至试液由橙红色突变为亮黄色即为终点。
2 结果与讨论
2.1 方法比对
为检验本文方法测定含钡矿物中铅含量的准确性,分别采用国标法和本文采用的测定方法对样品进行检测。对比结果见表1。
对比结果表明,本文采用的测定方法测试结果与国标测试结果基本一致,且与标准值吻合,因此本文采用的测定方法测定含钡矿物中铅含量结果准确,能够较好的满足实验室快速、准确、低成本等检测工作的需要。

表1 国标法和本文滴定法测试结果对比
2.2 氨水加入量的确定
为最大限度消除钡离子对测定结果的影响,需加入适量的氨水使钡离子在碱性条件下与硫酸钾充分反应形成不溶于酸性缓冲液的硫酸钡沉淀,同时阻止硫酸钾与铅离子反应。分别加入0 mL、5 mL、10 mL和15 mL氨水时测定铅含量结果见表2。
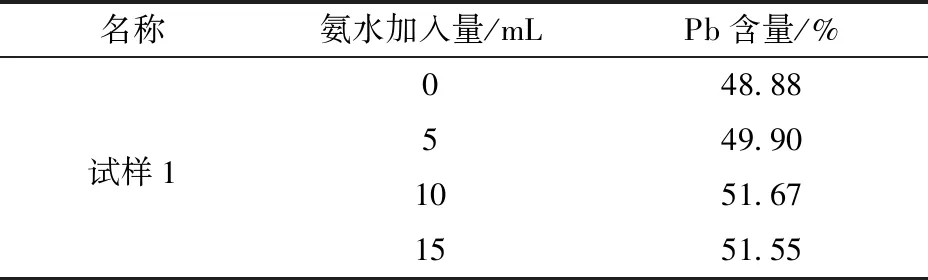
表2 不同氨水加入量测定铅含量结果比对
试验结果表明:氨水加入量以10 mL为足量,本文采用过量5 mL的氨水以保证硫酸钡充分沉淀。
2.3 沉淀时间的确定
将硫酸铅沉淀放置可以使铅沉淀完全,本文在加5 mL(1+1)硫酸沉淀铅时,将其煮沸后用冷水冷却,设定放置时间分别为0 min,30 min,45 min,60 min,75 min,90 min,经测定硫酸铅在放置60 min时已完全沉淀。故本文沉淀时间确定为60 min。
2.4 精密度试验
按照本试验方法,测定三个含钡试样,平行测定六次,其测定结果见表3。

表3 样品分析准确度和精密度结果
结果表明三个样品的测定相对标准偏差均小于1%,表明本方法精密度良好。
3 结语
本文所采用的EDTA测定含钡矿物中铅的含量,相对标准偏差均小于1%,且能有效消除钡离子的影响,与国家标准方法GB/T 8152.2—2006中的硫酸铅沉淀- EDTA返滴定法结果一致。该方法操作简便,重现性好,容易掌握,能够满足生产需求。

