RAD001或阿霉素联合索拉非尼用于晚期胰腺癌治疗的价值
孙清森,孙连生,徐建利,谷斌,李超
胰腺癌是常见消化道系统恶性肿瘤,发病隐匿,早期确诊率及手术切除率低,而传统放化疗疗效差,探寻可靠的靶向治疗药物是提升患者预后的关键[1]。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)信号通路是调控细胞生长与凋亡的重要通路[2],在胰腺癌中也存在过度激活并参与肿瘤的发生发展[3],但体外研究[4]发现胰腺癌对mTOR抑制剂RAD001存在耐药性,而联合应用索拉非尼则有助于改善耐药,提升抗肿瘤效果,但尚未见相应的体内研究。另外,索拉非尼本身即具备较好的抗肿瘤作用[5],有报道[6]显示索拉非尼联合阿霉素治疗晚期胰腺癌有较可靠的疗效。基于此,本研究拟以索拉非尼联合阿霉素为对照,探讨索拉非尼联合RAD001对晚期胰腺癌的临床疗效,报告如下。
1 资料与方法
1.1 一般资料
纳入2016年1月至2017年6月河北省沧州市人民医院收治的68例晚期胰腺癌患者为对象,本研究已获得我院伦理委员会批准。纳入标准:病理诊断为晚期胰腺癌;具有CT可测量的病灶;生存质量卡氏评分评分(Karnofsky score, KPS)[7]70~80分;患者知情同意。排除标准:具备手术治疗指征患者;肝肾功能明显异常者。采用信封随机法将患者划分为观察组和对照组,两组一般资料对比,差异无统计学意义(P>0.05),见表1。
1.2 治疗方案
对照组:索拉非尼联合阿霉素治疗。索拉非尼(拜耳医药,H20110599)口服,400 mg/次,2次/d。阿霉素(山西普德药业,H14023143)静脉注射,60 mg/m2,每21 d给药一次。
观察组:索拉非尼联合RAD001治疗。索拉非尼用法用量痛对照组。RAD001(商品名飞尼妥,瑞士诺华公司,H20130064)口服,10 mg/次,1次/d,随患者口腔溃疡程度适度调整用量至5 mg/d或隔日5 mg/d。
1.3 随访方案
两组均持续用药至肿瘤进展或死亡。每月住院或门诊随访1次,记录毒副反应。每2个月进行影像学复查,且患者主诉病情变化需要复查时随时复查影像学,观察肿瘤进展情况,末次随访日期为2018年7月31日,观察终点为末次随访或死亡。
1.4 观察指标
①临床疗效。在治疗2个月时评定。②毒副反应。采用美国国立癌症研究所通用不良事件术语标准4.0版(National Cancer Institute-Common Terminology Criteria Adverse Events Version 4.0, NCI-CTC)[8]进行评定。③治疗前及治疗2个月后外周血循环肿瘤细胞(circulating tumor cells, CTCs)计数。检测方案参考辛宝宝等[9]报道方案。采集7.5 mL外周静脉血样本,置于CellSearch平台专用存储管CellSave中,由检验科进行检查,以血样本中表达上皮细胞黏附分子的细胞代表CTCs,进行检测。④无进展生存时间。
1.5 疗效判定标准
参考实体瘤疗效评价标准(Response Evaluation Criteria In Solid Tumors, RECIST)[10]将疗效划分为完全缓解(所有目标病灶消失)、部分缓解(基线病灶长径总和缩小≥30%)、疾病稳定(基线病灶长径总和有缩小但未达部分缓解或有增加但未达疾病进展)和疾病进展(基线病灶长径总和增加≥20%或出现新病灶)。

表1 两组患者一般资料对比[n(%)]
注:*采用连续性校正2检验
1.6 统计学方法
2 结果
2.1 两组化疗临床疗效对比
两组均无患者达到完全缓解或部分缓解。观察组临床疗效略好于对照组,但差异无统计学意义(P>0.05),见表2。
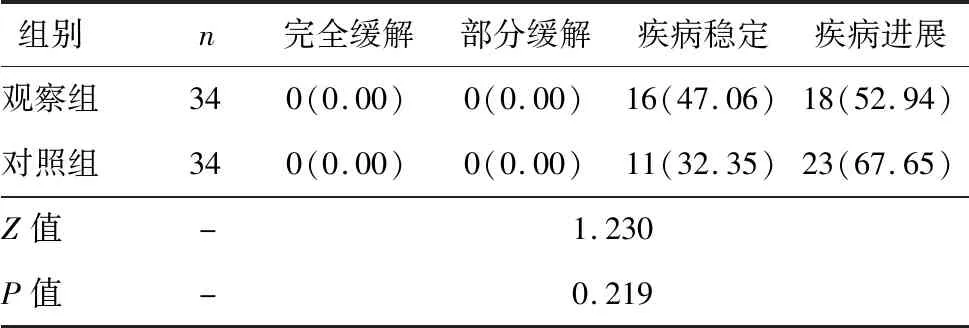
表2 两组患者化疗临床疗效对比[n(%)]
2.2 两组化疗不良反应对比
两组所有患者均表现出一定的不良反应,其中对照组8例患者表现出3~4级不良反应,观察组9例患者表现出3~4级不良反应,两组3~4级不良反应发生率对比,差异无统计学意义(2=0.078,P=0.779)。观察组口腔炎发生率明显高于对照组,差异有统计学意义(P<0.05),两组其它主要不良反应发生率对比,差异无统计学意义(P>0.05),见表3。
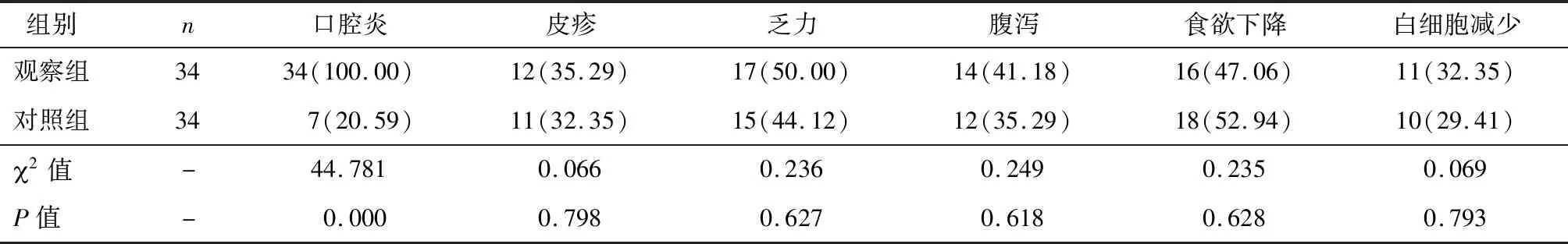
表3 两组主要不良反应类型对比[n(%)]
2.3 两组外周血CTCs计数对比
治疗前,两组外周血CTCs计数对比,差异无统计学意义(P>0.05)。治疗后,观察组外周血CTCs计数明显少于对照组,差异有统计学意义(P<0.05),见表4。
2.4 两组累积无进展生存时间对比
观察组累积无进展生存时间6~15个月,中位时间11个月;对照组累积无进展生存时间6~13个月,中位时间9个月。观察组累积无进展生存时间明显长于对照组,差异有统计学意义(P<0.05),见图1。
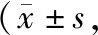
表4 两组患者外周血CTCs计数对比个/7.5 mL)
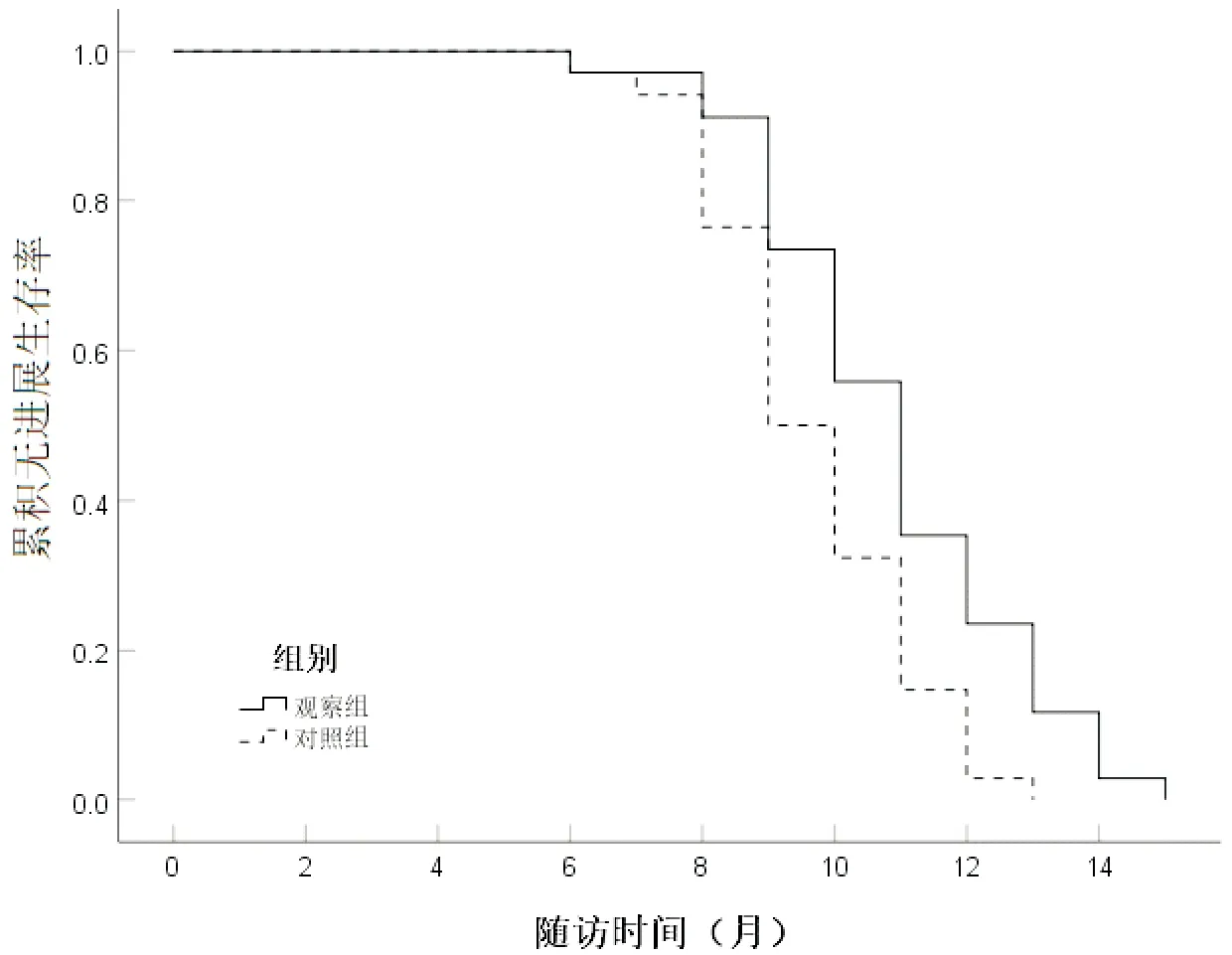
图1 两组累积无进展生存时间对比
3 讨论
胰腺癌预后差,致死率高,严重威胁国人健康,报道[11]显示2014年国内胰腺癌发病和死亡分别位居恶性肿瘤的第10位和第6位。该疾病早期诊断效果差,多数患者就诊时已发展至晚期。研究[12-13]显示,晚期转移性胰腺癌中位生存时间仅约7~9个月。可见,寻求更可靠的治疗方案意义重大。
随着对肿瘤细胞生物学行为及分子学机制的研究,越来越多分子靶向药物已逐渐应用至晚期胰腺癌,并已取得一定疗效[14]。研究显示mTOR信号通路在细胞生长、自噬、凋亡等方面发挥重要作用,且胰腺癌等多种恶性肿瘤中,该通路呈异常激活状态[15]。针对胃癌[16]、非小细胞肺癌[17]的报道显示mTOR通路抑制剂有可靠的抗肿瘤作用,但针对胰腺癌的报道[18]则提示mTOR抑制剂RAD001对胰腺癌的治疗效果不理想,这主要因胰腺癌细胞对RAD001有不同程度耐药。而报道[4, 19]显示,RAD001反馈激活c-RAF-MEK-ERK1/2信号通路是导致胰腺癌对RAD001产生耐药的主要原因:RAD001能够激活c-Raf,然后使丝裂原激活蛋白激酶的激酶(mitogen-activated protein kinase kinase, MEK)的2个丝氨酸残基磷酸化,活化其唯一的底物细胞外信号调节激酶(extracellular-signal-regulated kinase, ERK),活化的ERK1/2形成二聚体,进入细胞核,参与细胞的增殖、存活、分化和凋亡,改通路持续激活,则细胞增殖失控、凋亡受阻,因此导致胰腺癌耐药。而索拉非尼单药能够有效抑制ERK通路活性[20],与RAD001联用能够同时阻断mTOR和c-RAF-MEK-ERK1/2信号通路,可明显抑制肿瘤生长。本研究观察组采用索拉非尼联合RAD001治疗,47.06%在治疗2个月后疾病稳定,且患者中位生存时间达到11个月,提示其具备良好的治疗价值。
本研究未选用索拉非尼或RAD001单药治疗,主要因两类药物均已被证实不适宜单独应用至晚期胰腺癌[21],而索拉非尼联合阿霉素对晚期胰腺癌有相对可靠的疗效[22]。本研究进一步显示,观察组化疗近期疗效略好于对照组,但差异并不显著,提示两种联合用药方案均能够在短期内有效抑制肿瘤生长,但观察组累积生存时间明显长于对照组,说明索拉非尼联合RAD001对抑制肿瘤复发有更好的作用,其原因尚不明确,推测可能与RAD001的抗肿瘤作用更具靶向性有关。
本研究显示,观察组口腔炎发生率明显高于对照组,既往报道[23]也显示RAD001易导致口腔炎,但症状主要为1~2级,不会严重影响患者用药及预后。两组其它主要不良反应发生率对比,无明显差异,提示两种治疗方案均有较好的耐受性。
CTCs是实体瘤原发瘤体脱落,散播入患者血循环中的肿瘤细胞[24],既往报道[25-26]显示早期检测该指标对胰腺癌病理分期及预后有一定预测价值。本研究发现疾病治疗过程中,胰腺癌患者CTCs呈升高趋势,提示化疗过程中,患者疾病可能仍处于进展状态,而观察组化疗2个月后CTCs低于对照组,也提示该治疗方案具有更好的应用价值,同时这可能也使得观察组疾病进展时间延长,从而使观察组患者累积生存时间更长。
综上,索拉非尼联合RAD001对晚期胰腺癌患者外周血循环肿瘤细胞计数的抑制作用及生存预后均优于索拉非尼联合阿霉素。

