冷冻干燥法制备聚乳酸多孔支架
尹浩月,邓久鹏,马丽娟,田宜文
(华北理工大学口腔修复科,河北唐山 063000)
1 引 言
由肿瘤、外伤、交通事故等造成的口腔颌面部骨组织缺损是临床常见症状之一,如何修复大量骨缺损一直是临床治疗的难题[1-2]。为了更好地解决这一问题,制备出具有三维多孔支架作为骨组织替代品的骨组织工程技术受到广泛的关注[3]。目前,应用于骨组织工程领域的材料主要包括金属、陶瓷、高分子聚合物和复合材料[4],虽然研究人员已经做了大量的实验,但是目前为止尚未制备出一种可以完全替代人类骨骼的理想的骨移植材料[5]。聚乳酸(PLA)具有良好的机械和物理性能以及优异的生物相容性,是目前被美国食品药品监督管理局批准用于医疗用途的少数聚合物之一,广泛应用于生物医疗领域[6]。本实验采用冷冻干燥法,制备PLA多孔支架,为组织工程的研究提供实验依据。
2 材料与方法
2.1 材料和仪器
聚乳酸(PLA,美国);1,4-二氧六环(分析纯,天津);二氯甲烷(分析纯,天津);无水乙醇(分析纯,天津);L929细胞株(上海细胞库提供);胎牛血清、DMEM培养基(Gibco公司,美国);PBS缓冲液;噻唑蓝(MTT,Sigema,美国);二甲基亚砜(DMSO,Sigema,美国);酶标仪(上海永创);冷冻干燥机(比朗,上海);扫描电子显微镜(S-4800,日本);电子万能试验机(AGS-X,日本)。
2.2 方法及分组
2.2.1 实验分组 将1,4-二氧六环与二氯甲烷按体积比随机分为3组(n=5):A组,95:5;B组,90:10;C组,85:15。
2.2.2 实验方法 将0.5 g PLA在60℃真空干燥箱内充分干燥24 h后加入到4 mL有机溶剂(1,4-二氧六环/二氯甲烷,v/v)中,有机溶剂按体积比分为3组(n=5),见2.2.1。恒温搅拌至透明溶液后,放入-20℃冰箱内冷冻1 h后,冷冻干燥24 h。将样品放入无水乙醇中浸泡24 h,鼓风干燥箱内干燥24 h后,检测样品的表面形貌、孔隙率、压缩强度及细胞毒性。
2.2.3 PLA多孔支架材料浸提液制备 浸提标本为本实验所制备的支架材料,样品经过紫外线照射72 h灭菌后,按重量与含有10% 胎牛血清的DMEM培养基体积比为0.1 g:1 mL比例浸润,于37℃恒温箱中静置48 h,取出材料过滤除菌,获取浸提液,4℃冰箱保存备用。
2.3 评价方法
2.3.1 支架形貌观察 采用扫描电镜(S-4800,日本日立)对支架表面形貌进行观察,孔径大小及连通性。
2.3.2 孔隙率的检测 采用重量法测量复合多孔支架的孔隙率,每组测试样品3个,计算公式如下:
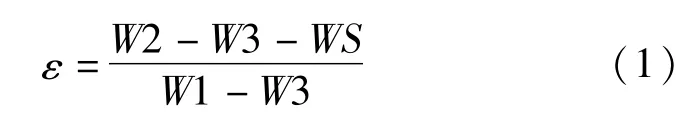
式中ε为支架孔隙率;WS为支架质量;W1为比重瓶装满乙醇后的总质量;W2为组织支架完全排出气泡后充满乙醇后的质量;W3为把支架从乙醇中取出后剩余物的总质量。
2.3.3 力学性能的检测 采用万能试验机进行抗压强度的测试。将样品切割成直径10 mm,高10 mm的圆柱体,按照GB-T 1041-1992的标准测试多孔支架的压缩强度。加载速度为5 mm/min,每组试件为3个样品。
2.3.4 MTT法检测细胞毒性 取对数生长期的L929细胞制备成密度为1×104个/mL细胞悬液,接种于96孔板,每孔100μL,置于37℃、5% CO2细胞培养箱内培养24 h,待细胞贴壁后,吸去原培养基,PBS缓冲液洗涤2次。实验组分别加入100μL浸提液,阴性对照组加入100μL完全培养基,阳性对照组加入0.64%苯酚溶液,实验组和对照组分别设置5个副孔,继续培养,培养至1、3和5 d后,加入20μL MTT液,培养4 h后弃去原培养液,每孔加入150μL DMSO,低速摇床避光震荡10 min,用酶标仪于570 nm波长测定吸光度(A)值,取平均值。
2.3.5 统计学分析 采用SPSS20.0统计软件分析处理,用±s表示多组间比较,采用方差分析并进行两两比较。方差齐用LSD检验,方差不齐则用Dunnett'sT3检验。P<0.05为差异有统计学意义。
3 结果
3.1 扫描电镜观察结果
图1为放大200倍的扫描电镜图。由图可知,采用真空冷冻干燥法可以制备出PLA多孔支架材料。PLA多孔支架材料具有大小不一的孔隙结构,孔径大小在10~200μm之间,孔隙连通性良好。图1(a)为A组扫描电镜图,孔主要为长圆形和圆形,孔径大小不一,孔隙较密,但是有封闭孔隙存在;图1(b)为B组扫描电镜图,图中孔主要为长椭圆形;图1(c)为C组扫描电镜图,图中大孔的孔壁上面存在较多的小孔,孔壁粗糙。
图2为放大500倍的扫描电镜图。图2(a)为A组扫描电镜图,图中孔径较大,孔壁较粗糙,但存在封闭式的孔隙;图2(b)为B组扫描电镜图,图中孔径主要有圆形和椭圆形,孔壁凹凸不平,孔壁内有小孔;图2(c)为C组扫描电镜图,图中孔径较均匀,孔壁粗糙,孔壁内小孔数量较多。

图1 PLA支架SEM 图(×200)Fig 1 SEM images of PLA scaffolds(×200)

图2 PLA支架SEM 图(×500)Fig 2 SEM images of PLA scaffolds(×500)
3.2 孔隙率测定结果
表1为PLA多孔支架材料孔隙率的测定结果。由表1可以看出,采用冷冻干燥法制备出的PLA多孔支架材料的孔隙率在(68.97±0.12)%~(73.75±0.47)%之间,差异有统计学意义(P<0.05)。

表1 PLA支架孔隙率Table 1 Porosity of PLA scaffolds
3.3 抗压强度测试结果
由表2可以看出,PLA多孔支架材料的平均抗压强度在(2.90±0.53)~(4.11±0.05)MPa之间,差异有统计学意义(P<0.05)。
3.4 细胞毒性检测结果
细胞毒性检测显示(见图3),在观察期间内阴性对照组与实验组细胞增值良好,而阳性对照组细胞几乎不增长,表明支架材料未显示出任何毒性,符合体外细胞毒性实验的要求。

表2 PLA支架的抗压强度Table 2 Compressive strength of PLA scaffolds
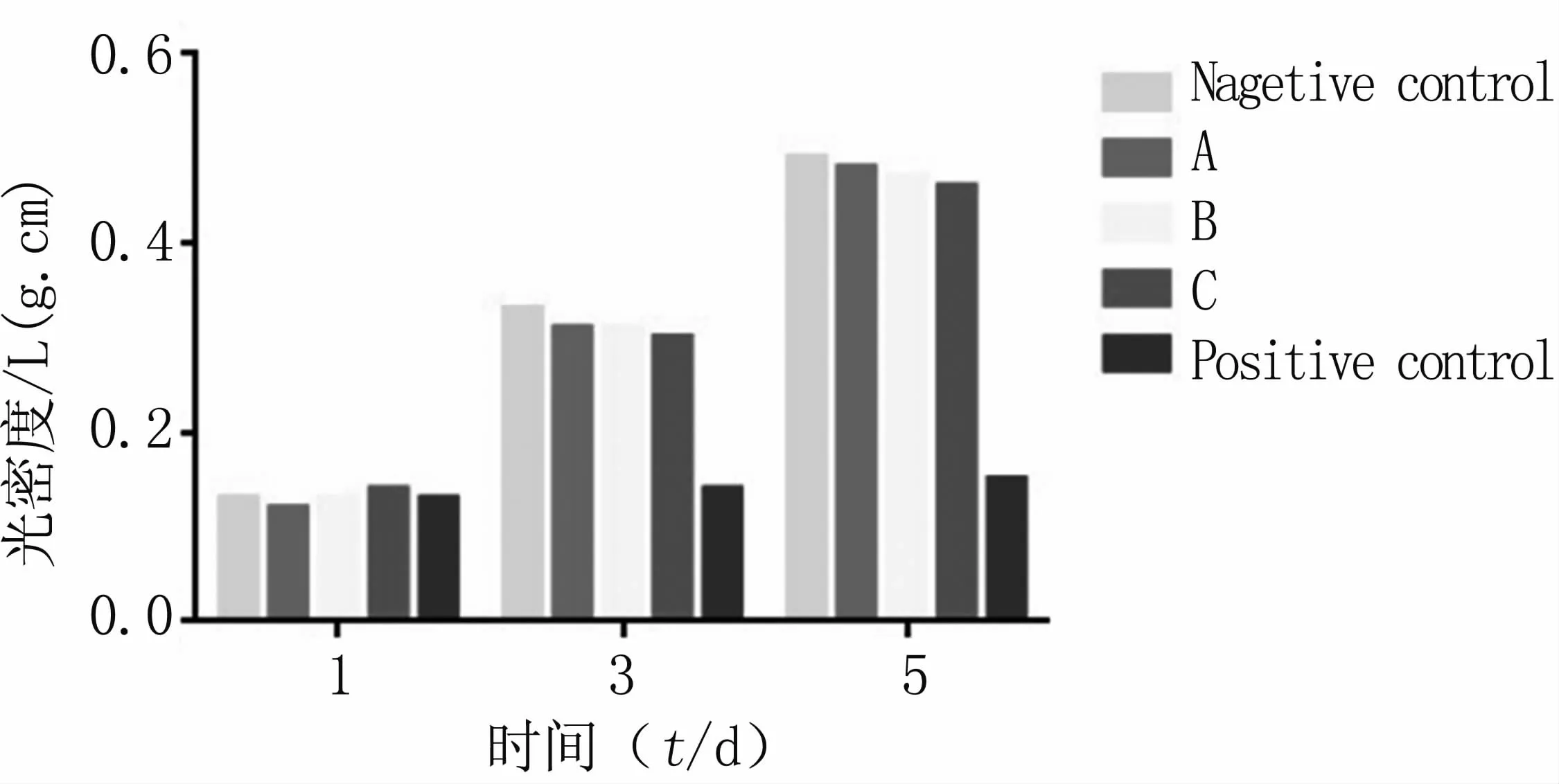
图3 MTT法检测细胞增殖情况Fig 3 Cell proliferation detected by MTT method
4 讨论
在组织工程中,支架材料主要作为骨修复中支持细胞生长和营养物质交换的初始结构,理想的支架材料除了具有生物相容性、可降解性和良好的力学性能,还应具有较高的孔隙率,孔隙介于100~800μm之间的孔隙率高达50%及以上,为细胞粘连和生长以及营养物质的交换提供了微观环境,并且在松质骨的范围内具有足够的机械强度[7-8]。
聚乳酸(PLA)又名聚丙交酯,化学式为(C3H6O3)n是一种在生物体内可完全降解为二氧化碳和水的高分子材料,因其具有低密度,易加工,良好的机械性能及生物相容性,独特的抗菌作用以及电活性特性,与人骨相似,再加之来源广泛等优点而备受青睐,被广泛应用于生物组织工程医学领域[9-10]。
本实验以PLA为原料制备出的组织支架,应用扫描电镜观察具有三维孔隙结构。由图2可以看出,大孔孔内壁粗糙不平不仅增加了比表面积,更有利于细胞的粘附及生长;微孔的存在赋予了支架良好的孔连通性,微孔形成的通道更有利于组织营养物质的运输以及细胞代谢产物的交换。微孔的存在同样可以影响支架应力的大小和分布,进而影响支架的承重能力。孔隙率检测结果显示(见表1),制备的PLA多孔复合支架材料孔隙率在(68.97±0.12)% ~(73.75±0.47)%,强度在(2.90±0.53)~(4.11±0.05)MPa,满足天然松质骨机械强度的基本要求[11]。由表1可知,随着孔隙率的升高,抗压强度逐渐降低。这是由于孔隙的增加导致了支架材料实体体积的减小,进而减少了支架材料的承重面积,由此可见,孔隙率的增加直接影响了抗压强度的大小,导致支架材料的抗压强度降低,蒋学泉等[12]的研究也得出了类似的结果。林建华[13]和徐文峰[14]同样采用冷冻干燥法制备聚乳酸支架材料,在体外细胞毒性实验测定结果显示支架材料具有良好的细胞相容性,符合支架材料安全无毒的基本要求。
当前,制备多孔支架材料的技术主要包括溶剂浇铸/粒子沥虑、相分离技术、冷冻干燥技术以及气体发泡技术等[15]。冷冻干燥技术的原理是将聚合物溶液与水或有机溶液在低温条件下冷冻结晶而得到聚合物相和溶剂固相,进而在真空条件下使溶剂固相升华去除溶剂得到多孔结构。本实验所用的有机溶剂因低温冷冻结晶温度的不同而形成相分离,致使在低温条件下溶剂结晶与聚合物形成固液相分离,然后在溶剂结晶点温度以下真空去除溶剂,从而形成多孔结构。相比较于其它方法,冷冻干燥技术主要有以下优点:在制备支架过程中最大限度的保留了材料原有的理化性能;致孔剂为有机溶剂而并非氯化钠、冰粒子和糖球等颗粒状物质,有效避免了致孔剂的残留,减少了封闭孔隙的出现;制备工艺相对简单,效率高等。根据有关报道显示,采用冷冻干燥技术制备的支架材料对生物活性并不产生负面影响[16],本研究的体外细胞毒性检测结果也证明这一点。
本研究采用真空冷冻干燥技术成功制备出符合骨组织要求的PLA多孔支架材料。

