IgA肾病患者肾组织中TIM-1、TGF-β1的表达及临床意义
王建芳,康乐
(驻马店市中心医院,1.检验科;2.新生儿科,河南 驻马店 463000)
IgA肾病(IgAN)是一种常见的原发性肾小球疾病,发病机制较为复杂,目前大多认为是多种细胞因子及炎性因子水平异常导致机体免疫功能障碍而引发[1]。病理表现为肾小管间充质细胞弥漫性增生、细胞外基质堆积,对患者预后造成不利影响。转化生长因子-β1(Transforming growth factor β1,TGF-β1) 能刺激细胞外基质的合成和沉积,促进间充质细胞增生,参与肾小管间质纤维化及肾小球硬化过程[2]。而T细胞免疫球蛋白与黏蛋白分子-1 (T-cell immunoglobulin and mucin domain,TIM-1)作为一种跨膜蛋白,广泛参与了多种T细胞介导的免疫反应,可促进T细胞活化及免疫物质分泌[3]。有研究发现,在系统性红斑狼疮患者体内TIM-1表达水平与促炎因子水平呈正相关,而IgAN发病与体内免疫系统异常同样密切相关[4]。目前临床上对TIM-1、TGF-β1与 IgAN患者病理相关性研究较少,因此本次研究通过检测IgAN患者肾组织中TIM-1、TGF-β1的表达水平,探究其与病理及临床指标的关系。
1 资料与方法
1.1 一般资料 选取2017年1月到2018年12月我院收拾的75例IgA肾病患者作为A组,纳入标准:⑴经肾组织活检确诊为IgAN,参考中华医学会肾病学主编的 《临床诊疗指南·肾脏病学分册》[5];⑵年龄18~65岁;⑶患者知情并签署知情同意书。排除标准:⑴合并严重心肝脾肺功能异常、糖尿病、恶性肿瘤、遗传性或继发性肾脏疾病等;⑵合并其他脏器有纤维化病变(除肾脏);⑶患者资料不全。选取40例微小病变肾病患者作为B组,排除标准与A组相同,同时选择30例肾脏肿瘤切除术后肿瘤周边正常肾组织作为对照组,A组男40例,女 35 例,年龄(35.7±3.0)岁;B 组男 22 例,女18 例,年龄(36.1±3.2)岁,对照组男 17 例,女 13例,年龄(35.9±2.8)岁,各组患者性别、年龄等基线资料比较差异无统计学意义(P>0.05)。
1.2 方法 采集各组患者清晨空腹血5ml,离心取上清液,采用ELLSA法检测白细胞介素-4(Interleukin,IL-4)和干扰素-γ(Interferon-γ,IFN-γ)水平,并计算IFN-γ/IL-4比值。采用Jaffe法检测血肌酐(SCr)含量。 肌酐清除率(CCr)采用 Cockcroft公式计算,CCr(ml/min)=(140-年龄)×体重(kg)/N×血肌酐(mg/dL),N 取值:男性,N=72,女性,N=85。收集患者24h尿液,采用考马斯亮蓝法检测24h尿蛋白量。将A、B组患者肾活检组织及肿瘤周边正常组织于10%甲醛固定,脱水、包蜡、切片、免疫组化 (分别加入 TIM-1、TGFβ1一抗)、DBA 显色,标本放大400倍后,取肾小球8个以上、肾小管50个以上视野,采用Image pro-plus 6.0系统对其中阳性信号进行图像分析,计算肾小球阳性面积占总肾小球面积的比值,作为TIM-1、TGFβ1在肾小球中的相对表达量。采用Haas法[6]对A组患者进行分型,Ⅰ型为轻微病变,Ⅱ型为局部增生;Ⅲ型为弥漫性增生,Ⅳ型为弥漫性增生,Ⅴ型为进行性慢性肾炎。采用Katafuchi法[7]按照肾小管间质病变面积对A组患者进行分级,0级为无明显病变,Ⅰ级为病变面积小于30%,Ⅱ级为病变面积30%~70%,Ⅲ级为病变面积大于70%。
1.3 统计方法 采用SPSS 22.0统计软件包进行数据分析,符合正态分布计量资料以均数±标准差表示,组间比较采用独立样本t检验,相关性分析采用Spearman法,P<0.05为差异有统计学意义。
2 结果
2.1 各组肾功能指标比较 A组24h尿蛋白量、SCr水平明显高于B组和对照组,CCr低于B组和对照组,差异具有统计学意义(P<0.05),见表 1。
表1 各组肾功能指标比较

表1 各组肾功能指标比较
组别A组B组对照组例数 SCr(μmol/L)75 40 30 70.58±4.62 46.74±2.57 46.12±2.40 CCr(ml/min) 24h尿蛋白定量(g)98.54±2.79 129.25±3.56 130.25±3.48 1.83±0.48 1.44±0.39 1.42±0.35
2.2 各组炎性因子比较 A组IL-4明显高于B组和对照组,IFN-γ/IL-4低于B组和对照组,差异具有统计学意义(P<0.05),各组 IFN-γ 水平差异无统计学意义(P>0.05),见表 2。
表2 各组炎性因子比较
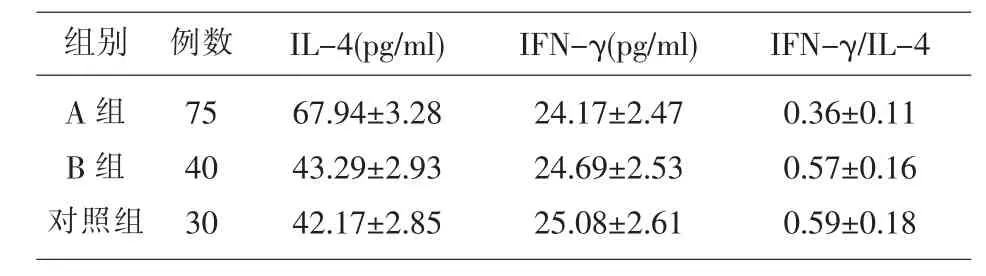
表2 各组炎性因子比较
组别A组B组对照组例数 IL-4(pg/ml)75 40 30 67.94±3.28 43.29±2.93 42.17±2.85 IFN-γ(pg/ml) IFN-γ/IL-4 24.17±2.47 24.69±2.53 25.08±2.61 0.36±0.11 0.57±0.16 0.59±0.18
2.3 各组肾组织TIM-1、TGF-β1表达水平 A组肾组织中TIM-1、TGFβ1表达水平明显高于B组和对照组,差异具有统计学意义(P<0.05),见表 3。
表3 各组肾组织TIM-1、TGF-β1表达水平

表3 各组肾组织TIM-1、TGF-β1表达水平
组别A组B组对照组例数 TIM-1(%)75 40 30 7.48±0.53 2.15±0.46 2.09±0.42 TGF-β1(%)10.82±0.72 3.10±0.53 3.14±0.51
2.4 A 组患者 TIM-1、TGF-β1表达水平与临床指标的相关性 Spearman相关性分析显示,A组肾组织中TIM-1表达水平与IL-4呈正相关 (r=0.497,P<0.05), 与 IFN-γ/IL-4 呈负相关 (r=-0.309,P<0.05),TGFβ1表达水平与 24h 尿蛋白定量呈正相关(r=0.330,P<0.05),见表 4。

表4 TIM-1、TGF-β1表达水平与临床指标的相关性
2.5IgAN患者不同 Haas分型肾组织 TIM-1、TGF-β1表达水平 IgAN患者Haas各分型中Ⅳ、Ⅴ型肾组织中TIM-1、TGFβ1表达水平高于Ⅰ-Ⅲ型,差异具有统计学意义(P<0.05),见表 5。
表5 IgAN患者不同Haas分型肾组织TIM-1、TGF-β1表达水平

表5 IgAN患者不同Haas分型肾组织TIM-1、TGF-β1表达水平
HaasⅡ(n=15)HaasⅢ(n=22)HaasⅣ(n=14)HaasⅤ(n=12)7.44±0.52 9.39±0.81 7.52±0.56 9.83±0.90 8.73±0.79 12.05±1.54 9.02±0.86 12.26±1.73指标 HaasⅠ(n=12)TIM-1 TGF-β1 7.31±0.48 9.32±0.72
2.6 IgAN患者不同Katafuchi分级肾组织TIM-1、TGF-β1表达水平 随Katafuchi分级增加,IgAN患者肾组织中TIM-1、TGFβ1表达水平逐渐升高,差异具有统计学意义(F=77.49、216.07,P<0.05),见表6。
2.7 IgAN 患者肾组织 TIM-1、TGF-β1表达水平与病理情况的相关性 Spearman相关分析显示,IgAN患者肾组织中TIM-1、TGFβ1表达水平与Haas分型、Katafuchi分级呈正相关(r>0,P<0.05),见表 7。
表6 IgAN患者不同Katafuchi分级肾组织TIM-1、TGF-β1表达水平

表6 IgAN患者不同Katafuchi分级肾组织TIM-1、TGF-β1表达水平
Ⅰ级(n=28) Ⅱ级(n=13) Ⅲ级(n=7)7.58±0.43 12.36±0.63 8.43±0.52 13.57±0.68 9.68±0.55 15.74±0.72指标 0级(n=27)TIM-1(%)TGF-β1 7.02±0.41 9.84±0.59

表7 IgAN患者肾组织TIM-1、TGF-β1表达水平与病理情况的相关性
3 讨论
IgAN临床表现为血尿、蛋白尿、水肿等症,病理表现为肾小球硬化、系膜增生、或肾小管萎缩、或肾间质纤维化等,是我国透析患者主要病因,给患者健康及家庭带来较大危害和负担[8]。目前IgAN发病机制尚不明确,推测可能是糖基化异常的IgA和抗体形成复合物在肾脏中沉积从而对肾脏造成损伤。有文献报道,约22%血尿患者表现为肾间质纤维化和(或)肾小球萎缩,表明肾小管和间质损伤可能在肾小球疾病发展中起到重要作用,且对患者预后造成一定影响[9,10]。目前针对IgAN尚无确切治疗方法,因此探讨IgAN疾病发展相关因素对指导临床诊疗具有重要意义。
TGF-β1是一种由脂多糖及巨噬细胞分泌、表达于机体多种组织器官中的细胞因子,能参与胚胎、骨骼发育、肿瘤发生、免疫调节等生理过程[11]。TGF-β1在组织损伤初期能促进损伤修复和再生,并能促进血管平滑肌的增生,同时通过多条信号途径参与细胞增殖、分化和凋亡。有研究发现,TGF-β1能促进胶原蛋白类物质在组织中沉积,激活成纤维细胞,促进间质区域血管生成,在组织纤维化过程中起到关键作用[12,13]。本次研究中发现,A组肾组织中TGF-β1表达水平明显高于B组和对照组,且在Haas分型(Ⅳ和Ⅴ型)及Katafuchi分级患者中表达水平逐级升高。相关性分析显示,TGF-β1表达水平与24h尿蛋白定量、Haas分型、Katafuchi分级呈正相关,表明患者肾组织中TGF-β1表达水平与肾功能、IgAN病理发展密切相关。推测原因可能是TGF-β1可通过影响蛋白多糖、Ⅲ型胶原蛋白、纤连蛋白的表达水平,促进胞外基质的生成及沉积,加重了肾脏组织损伤[14]。
TIM是一种最早发现于小鼠体内的基因家族,能共同编码具有生物活性的跨膜蛋白,通过影响T细胞亚群的分化及平衡[15]。人体TIM家族包括TIM-1、TIM-3、TIM-4, 其中 TIM-1 能特异性表达在T细胞表面,与TIM-4结合为细胞活化提供协同信号并促进Th0向Th2分化,从而影响T细胞亚群Th1/Th2平衡[16]。有研究发现,在过敏性紫癜患者外周血单核细胞中TIM-1 mRNA表达上调,且伴随Th2水平的升高[17]。在SLE患者中,TIM-1表达水平与病情及体内IL-4水平呈正相关,表明在TIM-1可通过调节T淋巴细胞亚群参与多种自身免疫疾病的发生发展过程[18]。IFN-γ是Th1参与免疫反应的主要执行细胞因子,IFN-γ/IL-4可反映Th1/Th2平衡情况。本次研究中发现,A组TIM-1表达水平明显高于B组和对照组,CCr、IFN-γ/IL-4比值低于B组和对照组,IgAN患者Haas各分型中Ⅳ和Ⅴ型肾组织中TIM-1表达水平高于Ⅰ-Ⅲ型,且随Katafuchi分级(0-Ⅲ级)增加,肾组织中TIM-1表达水平逐渐升高,经Spearman相关分析,IgAN患者肾组织中TIM-1表达水平与Haas分型、Katafuchi分级、IL-4水平呈正相关,与IFN-γ/IL-4呈负相关,推测TIM-1可能通过促进Th2分化表达,促进了Th2细胞优势反应,增加局部免疫反应强度,加重了对肾组织的免疫损伤[19]。因此临床诊疗中可以考虑通过抑制TIM-1信号通路或下调TGF-β1表达水平从而降低免疫反应及肾小管间质损伤,可能成为一个治疗IgAN新途径[20]。
综上所述,TIM-1、TGF-β1通过调控 Th免疫、肾小管间质病理损伤过程参与了IgAN发生和发展过程,TIM-1、TGF-β1高表达可加重IgAN病情发展及恶化,可作为肾小管间质损伤的标志物之一。我们设想通过降低TIM-1、TGF-β1表达水平从而减弱肾脏免疫损伤,为临床诊疗提供新的依据和思路。

