盘县火腿微生物多样性及主体挥发性风味解析
母雨,苏伟,母应春
(贵州大学酿酒与食品工程学院,贵州 贵阳 550025)
盘县火腿作为贵州省特色产品,于2012年取得国家地理标志产品”称号,具有独特的地域特色[1]。风味是干腌火腿最重要的质量指标之一,其形成途径主要有两条:一是火腿中的脂肪、蛋白质等物质在内源酶的作用下产生风味物质;二是微生物的生长繁殖产生大量风味代谢产物[2]。近年来,对于干腌火腿挥发性风味的研究较多,如刘登勇[3]通过气味指纹技术确定了金华、宣威和如皋火腿的主体风味;谭椰子等[4]研究了金华、宣威和如皋火腿3 个不同年份皮下脂肪的挥发性风味成分,得到15 种可区分不同样品的主体风味物质。但是,对于火腿挥发性风味物质与微生物组成的相关性研究较少,Wang 等[5]认为火腿挥发性风味的形成与自然环境(如微生物)和原料肉有关;黄盼盼等[6]综述了微生物与火腿风味的关系,认为火腿中的优势微生物是其风味形成的关键;Martínez-Onandi 等[7]报道微生物来源的挥发性化合物占伊比利亚火腿总挥发性化合物的6%以上。因此,微生物与香气物质的关联分析对于火腿品质的提升有着重要意义。
为了解干腌火腿中的微生物组成,过去常依赖培养法,但某些环境因素会使部分微生物随机地进入可存活但不可培养(viable but non-culture,VBNC)状态,导致无法培养和检测[8]。近年来兴起的Illumina MiSeq高通量测序技术具有准确率高、操作简单、成本低等优势,已被广泛应用于食品微生物组成的研究[9]。在食品风味研究领域,固相微萃取(solid phase microextraction,SPME)结合气相色谱-质谱(gas chromatographymass spectrometry,GC-MS)法占有重要地位。SPME 技术集合了采样、萃取、浓缩和进样,大大提升了检测速率;GC-MS 则常用于风味化合物的分离和鉴定。
本研究利用Illumina MiSeq 高通量测序技术和SPME-GC-MS 对不同地区盘县火腿的微生物组成和分布进行调查,并测定其挥发性风味化合物的种类和含量,旨在明确盘县火腿的优势微生物和主体风味化合物,并挖掘潜在功能微生物。
1 材料与方法
1.1 主要设备与试剂
1.1.1 主要设备
NanoDroB1000 超微量分光光度计:美国Thermo Fisher Scientific 公司;DYY-6c 电泳仪:北京市六一仪器厂;ABI GeneAmp9700 PCR仪:美国ABI 公司;Bio-Tek ELx800 酶标仪:美国Bio-Tek 公司;Illumina Miseq测序仪:美国Illumina 公司;M220 基因剪切仪:中国基因有限公司;QuantiFluorTM-ST 微型荧光计:美国Promega 公司;7980GC-700MS 气相色谱质谱联用仪:美国安捷伦公司;75 μm CAR/PDMS 萃取头:上海洽姆仪器科技有限公司。
1.1.2 主要试剂
土壤DNA 快速提取试剂盒:美国MP Bio 公司;2%琼脂糖凝胶:西班牙Biowest 公司;FastPfu 聚合酶:北京全式金生物技术有限公司;AxyPrep DNA 凝胶回收试剂盒:美国Axygen 公司;TruSeqTMDNA Sample Prep Kit:美国 Illumina 公司。
1.2 样品采集
火腿样品采自贵州省盘州市不同地区:乌蒙镇(WM)、普古镇(PG)和红果新区(HG)。所有样品采集两份装入无菌密封袋中,24 h 内干冰运送至实验室并储存于-80 ℃冰箱中,一份用于DNA 提取,另一份用于风味检测。
1.3 高通量测序试验方法
1.3.1 总DNA 提取与聚合酶链式反应(polymerase chain reaction,PCR)扩增
在无菌条件下取10 g 肉样充分混匀,用MP-soil DNA 试剂盒提取样品总DNA。然后用超微量分光光度计对DNA 浓度和纯度进行检测,再用1%琼脂糖凝胶电泳检测DNA 提取质量。纯化后的DNA 用于细菌16S rRNA 和真菌 ITS 基因的扩增。以 338F(5’-ACTCCTACGGGAGGCAGCAG -3’) 和 806R (5’-GGACTACHVGGGTWTCTAAT-3’)为引物对细菌V3-V4 可变区进行PCR 扩增;以 ITS1F(5’-CTTGGTCATTTAGAGGAAGTAA -3’) 和 ITS2R (5’-GCTGCGTTCTTCATCGATGC-3’)为引物对真菌 ITS1 区进行PCR 扩增。扩增程序为:95 ℃预变性3 min,95 ℃变性 30 s,55 ℃退火 30 s,72 ℃延伸 30 s,27(细菌)/35(真菌)个循环,72 ℃延伸 10 min。扩增体系(20 μL):4 uL 5×FastPfu 缓冲液,2 μL 2.5mmol/L dNTPs,0.8 uL 引物(5 μmol/L),0.4 μL FastPfu 聚合酶,10 ng DNA 模板,剩下的用ddH2O 补齐。
1.3.2 Illumina Miseq 测序
使用2%琼脂糖凝胶回PCR 产物,然后利用DNA凝胶回收试剂盒对产物进行纯化,Tris-HCl 缓冲液洗脱后用2%琼脂糖电泳检测。参照电泳初步定量结果,将PCR 产物用QuantiFluorTM-ST 微型荧光计蓝色荧光定量系统进行检测定量,之后按照每个样本的测序量要求,进行相应比例的混合。根据Illumina MiSeq 平台标准操作规程将纯化后的扩增片段构建PE 2×300 的文库。
构建文库步骤:(1)连接“Y”字形接头;(2)使用磁珠筛选去除接头自连片段;(3)利用PCR 扩增进行文库模板的富集;(4)氢氧化钠变性,产生单链DNA 片段。利用Illumina 公司的Miseq PE300 平台进行测序(上海美吉生物医药科技有限公司)。
1.4 挥发性风味成分检测方法
1.4.1 顶空固相微萃取
首先将萃取头置于250 ℃老化2 h,再准确称取5.00 g 样品置于20 mL 顶空瓶中并插入老化后的萃取头,在40 ℃下萃取30 min,之后将萃取头拔出并插入气质联用仪进样口,在250 ℃条件下解吸5 min 后进行检测分析。
1.4.2 GC-MS 检测条件
色谱条件:DB-WAX 毛细管柱(30 m×0.25 mm×0.25 μm);恒定流量模式;柱升温程序:起始温度40 ℃,保持 15 min,然后以 3 ℃/min 升到 160 ℃,保持 0 min,再以 4 ℃/min 升到 230 ℃,保持 5 min。载气:He;流量:0.8 mL/min。
质谱条件:电子轰击离子源(EI);电子能量70 eV;离子源温度230 ℃;传输线温度250 ℃;扫描范围25 ms~400 ms。
1.4.3 定性及定量方法
定性方法:试验数据与数据库NIST 和WILEY 中的图谱进行对比分析,再结合保留指数进一步确定。选用C6~C18的正构烷烃为标准,计算各挥发性化合物的保留指数(retention index,RI),并与数据库进行对比,计算公式如下:
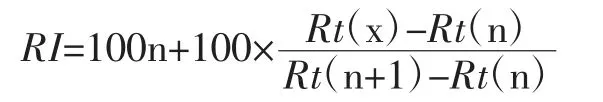
式中:Rt(x)、Rt(n)及Rt(n+1)分别为待测挥发性成分、含n 个碳原子正构烷烃及n+1 个碳原子正构烷烃的保留时间,min。
定量分析:以25 mg/L 的环己醇为内标,采用内标法计算样品中各组分的含量,计算公式如下:
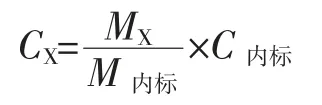
式中:CX和MX分别为待测挥发性化合物的浓度(mg/L) 和峰面积;C内标和 M内标分别为内标物的浓度(mg/L)和峰面积。
1.4.4 主体挥发性风味评价方法
采用气味活动值(odor activity value,OAV)法对火腿的主体风味成分进行评价,各挥发性风味化合物的OAV 值按下式计算:
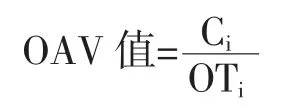
式中:Ci为某挥发性风味化合物的含量,μg/g;Ti为该化合物的嗅觉阈值,μg/kg。
1.5 数据分析
利用Trimmomatic 软件去除长度低于50 bp、平均质量值低于20 的序列;使用FLASH 软件进行拼接,barcode 需精确匹配,引物允许2 个碱基的错配,去除模糊碱基,根据重叠碱基overlap 将两端序列进行拼接,overlap 需大于10 bp,去除无法拼接的序列。使用UPARSE 软件(version 7.1 http://drive5.com/uparse/),根据97%的相似度对序列进行可操作分类单元(operational taxonomic units,OTU)聚类;然后使用核糖体数据库项目(ribosomal database,RDP)分类器针对Silva(SSU123)数据库使用70%的置信度阈值分析每个序列的分类;最后使用UCHIME 软件鉴定并除去嵌合序列。Mothur 软件用于评估α 多样性;聚类分析图是根据QIIME 软件计算结果使用R 软件绘制的。对于网络图的绘制,首先利用SPSS 计算微生物与核心风味物质间的皮尔逊相关系数,然后利用Cytoscape 软件进行网络可视化。
2 结果与分析
2.1 测序结果
火腿样品测序数据统计分析见表1。
如表1所示,剔除不合格序列后,从三地样品中共获得227 253 个有效真菌序列和140 276 个有效细菌序列,基于97%相似度发现真菌和细菌OTU 数量分别为139 和808。虽然真菌序列数大于细菌,但细菌OTUs 数量远高于真菌,表明细菌多样性高于真菌。所有样品的真菌和细菌覆盖率均为0.99,表明测序深度已足够反映样品所包含的微生物群落。
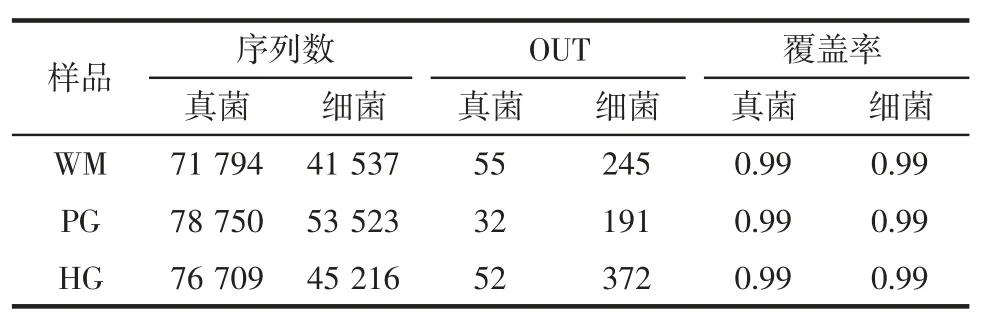
表1 火腿样品测序数据统计分析Table 1 Statistical analysis of ham sample sequencing data
2.2 微生物多样性分析
三地样品的Alpha 多样性指数如表2所示。
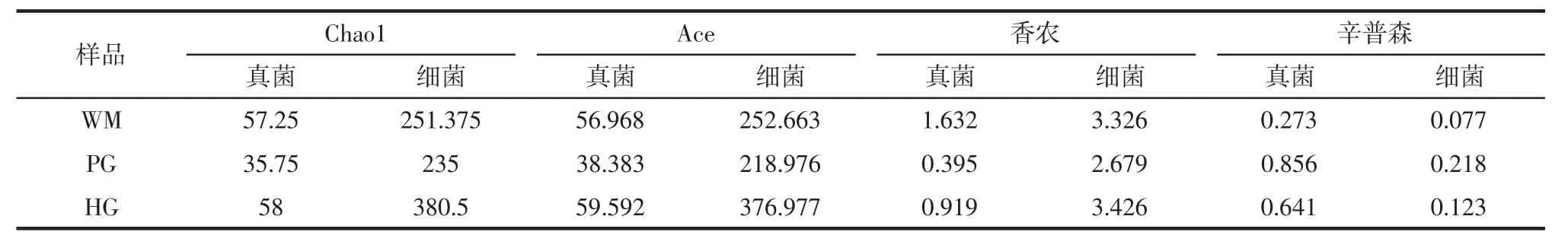
表2 火腿样品的α 多样性Table 2 The α diversity index of ham samples
群落丰富度与Chao1 和ACE 指数的大小呈正相关;而群落多样性与香农指数呈正相关,与辛普森指数呈负相关。三地样品的细菌丰富度和多样性均大于真菌,样品间的丰富度和多样性高低顺序为:HG>WM>PG。
2.3 微生物群落组成分析
群落组成分析可反映不同样品在各分类学水平上的组成情况。火腿样品细菌类群门和属水平分布图见图1。
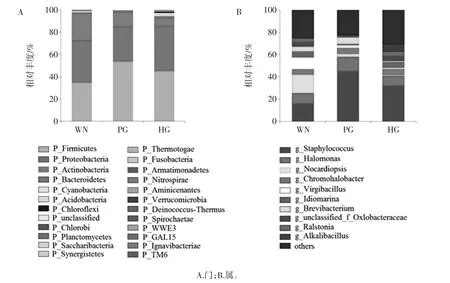
图1 火腿样品细菌类群门和属水平分布图Fig.1 Phylum and genus-level distribution of bacteria in ham samples from Panxian
图1A 和图1B 分别显示样品在细菌门(phylum)水平和属(genus)水平的群落组成情况,图1B 只显示了丰度前十的属,其余属被归为“other”。从盘县三地样品中共检测到24 个细菌门,其中以Firmicutes(厚壁菌门)为优势菌群,约占OTU 总数的44.5%,其次为Proteobacteria(变形菌门)和Actinobacteria(放线菌门),约占OTU 总数的36.48%和14.72%。在属水平,从三地样品中共鉴定出433 个细菌属,WM 火腿中获得245 个属,其中优势类群包括Nocardiopsis(拟诺卡氏菌属)、Staphylococcus(葡萄球菌属)、Virgibacillus(枝芽孢杆菌属)、Halomonas(盐单胞菌属)及Idiomarina,分别占样品总丰度的16.78%、16.31%、10.17%、9.20%和5.76%;在PG 火腿中获得191 个属,以葡萄球菌属(45.39 %)、盐单胞菌属(12.58 %)、Brevibacterium(短杆菌属,5.76 %)及 Chromohalobacter(5.51 %)优势菌属;在HG 火腿中获得372 个属,优势菌属有葡萄球菌属(32.45%)、盐单胞菌属(8.56%)、Alkalibacillus(6.76%)、Chromohalobacter(5.39%)和Idiomarina(5.24%)。
火腿样品真菌类群门和属水平分布图见图2。
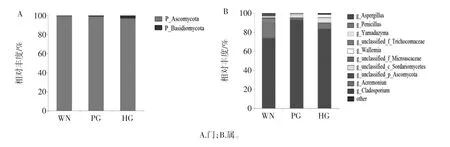
图2 火腿样品真菌类群门和属水平分布图Fig.2 Phylum and genus-level distribution of fungi in ham samples from Panxian
图2A 和图2B 分别展示样品在真菌门(phylum)水平和属(genus)水平(丰度前十)的群落组成情况,图2B 只显示了丰度前十的属,其余属被归为“other”。三地样品共检出2 个细菌门,以子囊菌门(Ascomycota)为优势菌群,约占真菌OTU 总数的98.7%。在属水平,共鉴定出68 个真菌属,WM 火腿中获得52 个属,其中优势菌群为Aspergillus(曲霉菌属)和Penicillium(青霉菌属),分别占样品总丰度的74.08%和15.41%;在PG 火腿中获得32 个属,以曲霉菌属(93.39%)为优势菌属;在HG 火腿中获得55 个属,优势菌属包括曲霉菌属(83.75 %)、青霉菌属(6.50 %)和 Yamadazyma(5.23%)。
结果表明盘县火腿的微生物组成丰富,不同地区盘县火腿的优势微生物群落存在一定差异,但葡萄球菌属、盐单胞菌属和曲霉菌属在三地样品中均占优势。其中,葡萄球菌属在我国金华和宣威火腿中同样作为最优势菌[10],具有较高的蛋白酶和脂肪酶活性,有助于发酵肉制品特殊风味的形成[11]。盐单胞菌属作为一种中度嗜盐菌,具有高淀粉酶活性[12],常分离于盐湖、盐碱地及海洋等,也存在于发酵食品中[13]。而曲霉菌属是我国金华火腿和意大利圣丹尼火腿的优势真菌[14-15],具有隔绝空气、抑制有害菌生长等多种功能[16]。
2.4 OTU水平的样品聚类分析
为研究不同火腿样品物种组成结构的相似性和差异性,根据每个样品的OTU 组成情况进行聚类分析,使用非加权平均算法(unweighted pair-group method with arithmetic mean,UPGMA)构建树状结构,可视化不同样品的差异程度。基于细菌和真菌OTU 的聚类树图见图3。
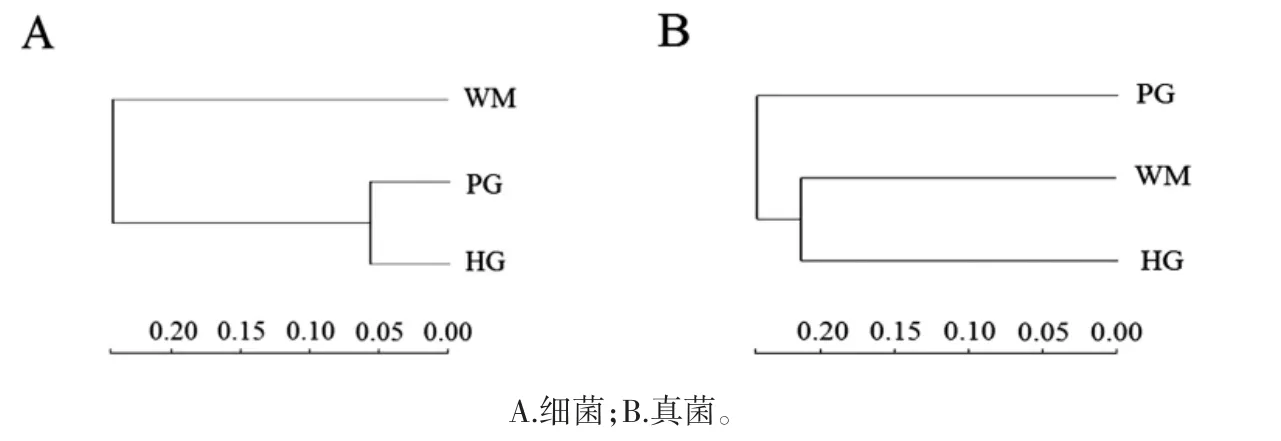
图3 基于细菌和真菌OTU 的聚类树图Fig.3 Cluster tree based on bacteria and fungi OTU
图3A 是基于细菌OTU 丰度的聚类,图3B 是基于真菌OTU 丰度的聚类。结果表明HG 和PG 火腿的细菌OTU 水平相近,而HG 和WM 火腿的真菌群落相似性更高。
2.5 GC-MS定量结果
火腿样品的挥发性风味化合物含量见表3。
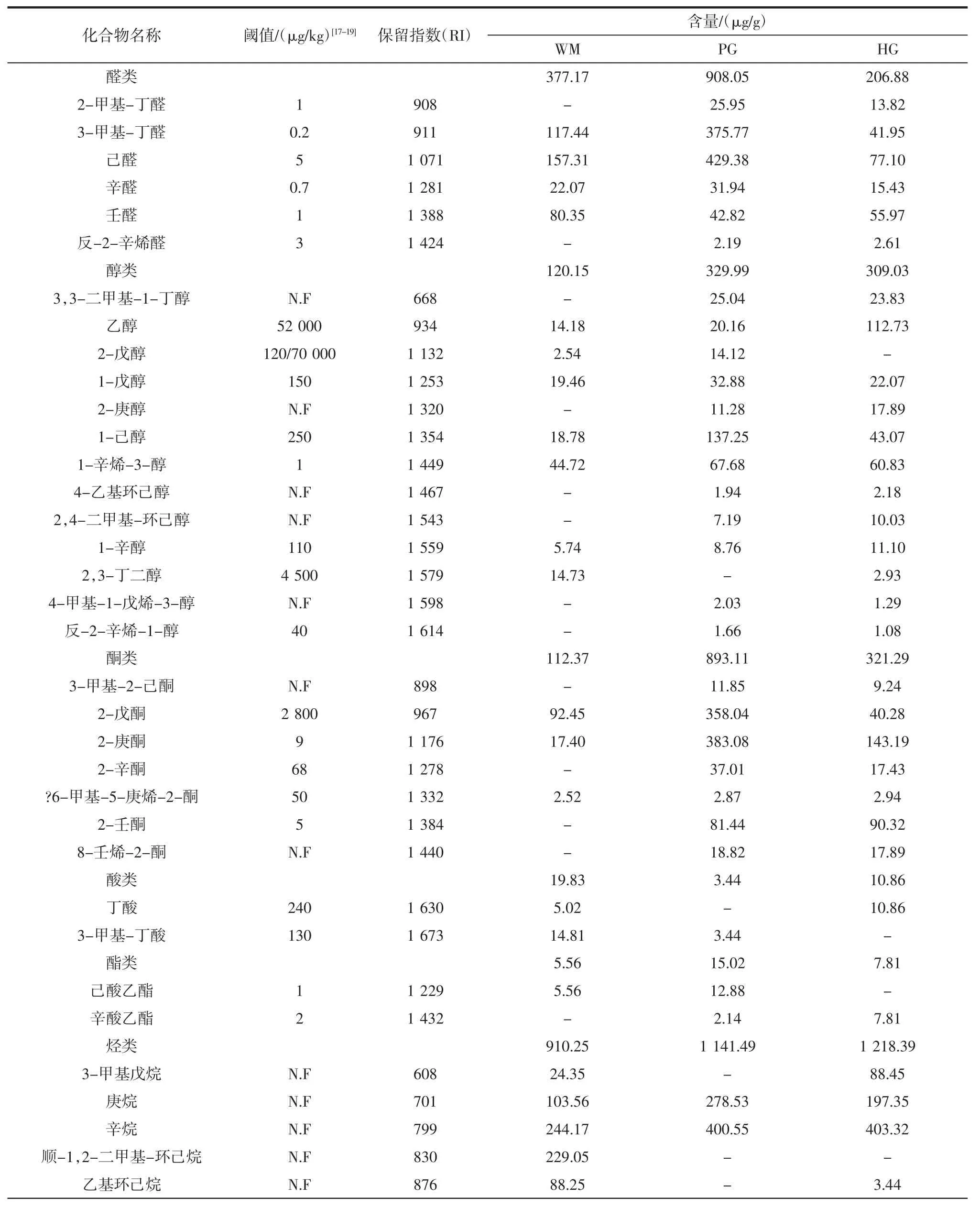
表3 火腿样品的挥发性风味化合物含量Table 3 Contents of volatile flavor compounds in ham samples from Panxian
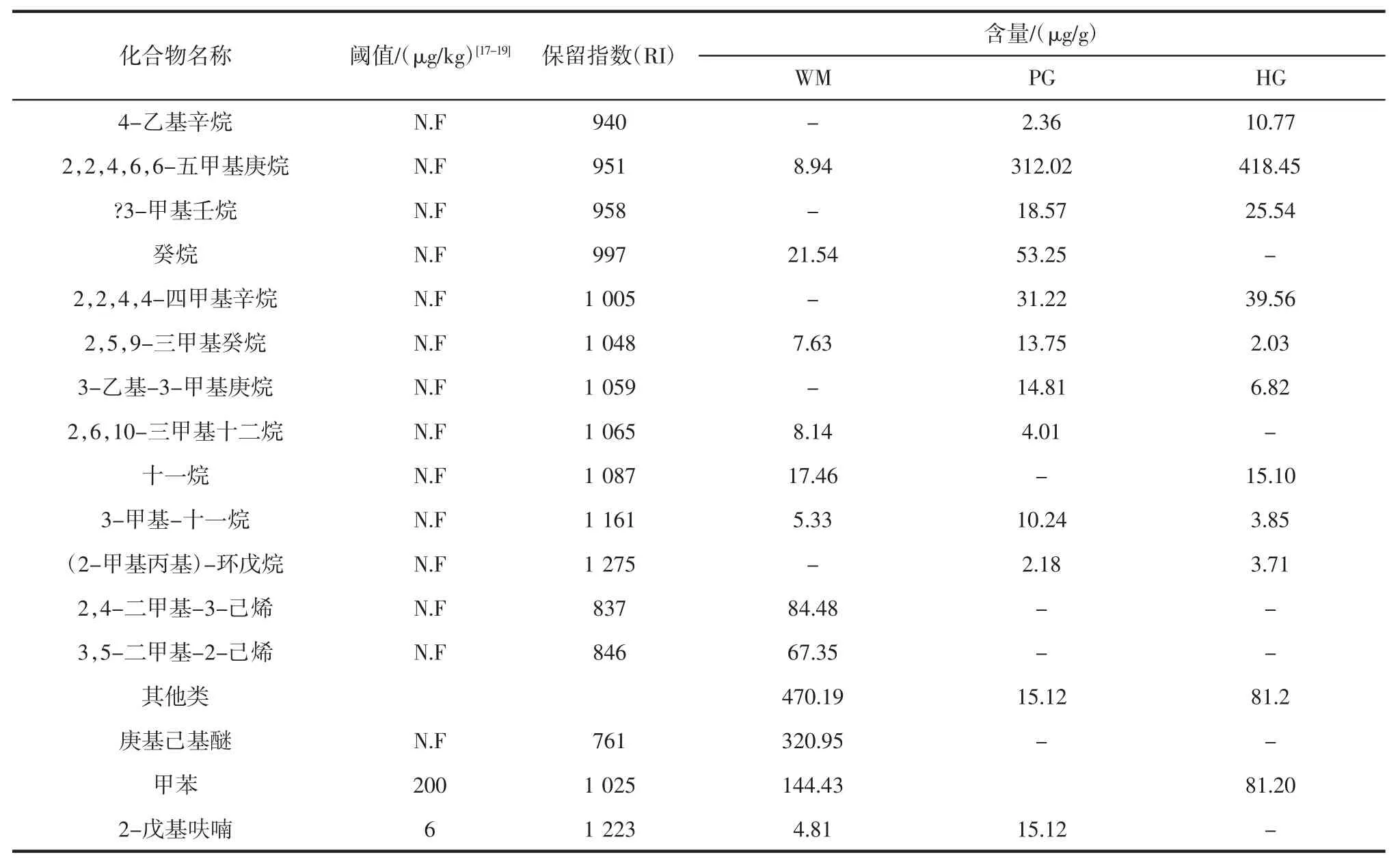
续表3 火腿样品的挥发性风味化合物含量Continue table 3 Contents of volatile flavor compounds in ham samples from Panxian
如表3所示,三地样品共检出51 种挥发性风味化合物,其中 WM 33 种,PG 和 HG 各 41 种。检出的风味物质可分为七大类:醛类、醇类、酮类、酸类、酯类、烃类及其它类。通过表3中各类物质的分类总结可知,PG火腿中醛类、醇类、酮类及酯类物质含量最高,特别是3-甲基丁醛、己醛、1-已醇、2-戊酮、2-庚酮和己酸乙酯。在WM 火腿中,酸类和其他类物质含量及种类最高,主要包括3-甲基丁酸、庚基己基醚及甲苯。烃类物质在HG 火腿中的含量最高,但烃类物质阈值较高,对火腿风味贡献甚微。
为进一步筛选各火腿样品的主体风味组成,根据表3中各物质的含量结合嗅闻阈值确定OAV 值。OAV法能从众多挥发性风味物质中筛选出对整体风味有重要贡献的物质,通常认为OAV≥1 的组分对样品风味有重要贡献,且OAV 值越大,对风味影响越大[20]。三地火腿挥发性化合物气味活度值OVA 分析见表4。
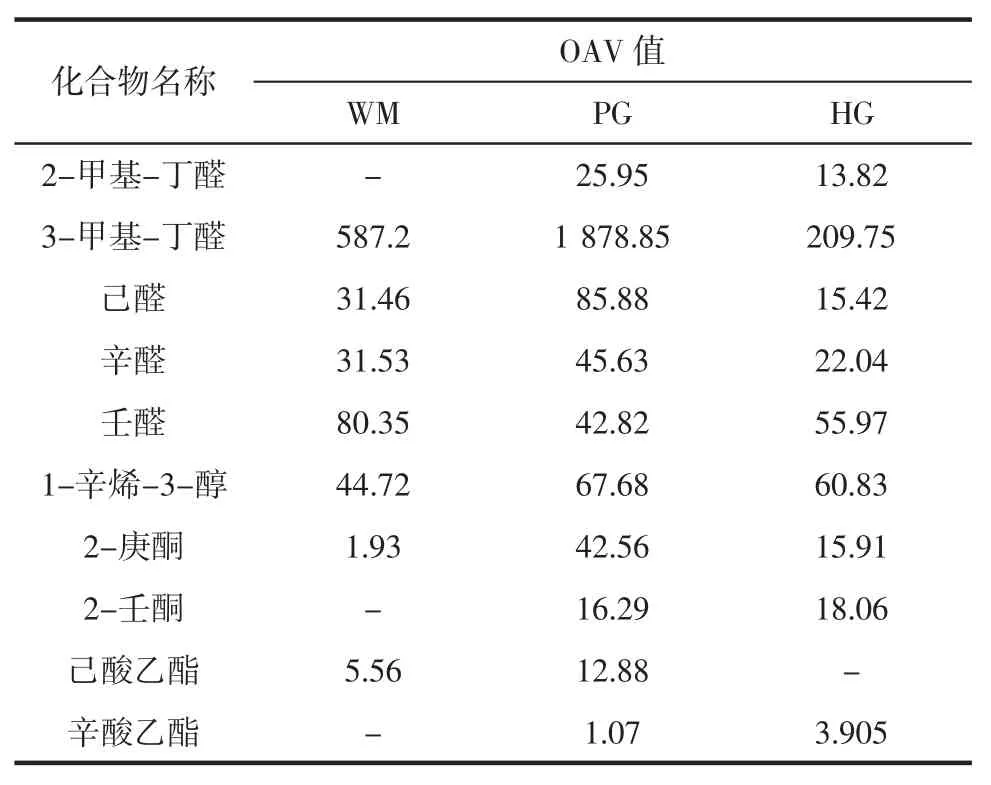
表4 三地火腿挥发性化合物气味活度值OVA 分析Table 4 OAVs of volatile compounds in Panxian ham from three regions
如表4所示,三地样品共检出OAV≥1 的关键风味化合物10 种,包括5 种醛类,1 种醇类,2 种酮类及2 种酯类。醛类化合物大部分来源于不饱和脂肪酸的氧化,少部分由美拉德反应生成,此类物质阈值较低,一般具有水果味,是火腿风味成分中最重要的一类化合物[21]。己醛在三地样品中均是含量最大的醛类物质,来自于脂肪酸的氧化降解,在低浓度时呈青草香气,高浓度时呈酸臭味[22]。支链醛2-甲基丁醛和3-甲基丁醛主要来自氨基酸的Strecker 降解,具有干果味、奶酪味和咸味,是意大利干腌火腿中含量最大的风味成分[23]。3-甲基丁醛在3 地样品中的OAV 值最大,表明它对盘县火腿的风味品质有重要影响。另外,壬醛有助于增加甜味和果味香气,而辛醛具有油脂味和辛辣味[24]。
醇类化合物的形成与脂肪氧化和酮类物质的还原反应密不可分。三地样品中含量较高的醇有乙醇、1-己醇和1-辛烯-3-醇,但OAV≥1 的仅有1-辛烯-3-醇。这是因为醇类物质具有相对较高的阈值,对风味贡献一般较小,但某些不饱和醇具有较低的阈值,如花生四烯酸氧化形成的1-辛烯-3-醇具有蘑菇味,是干腌火腿风味的重要组成部分[3]。
酮类化合物主要来自脂质的氧化降解和氨基酸或蛋白质之间的相互作用,其同样具有较低的阈值并主要表现为花香味,对干腌火腿香味有重要影响的酮类物质主要是甲基酮[25]。三地样品中检出含量较大的甲基酮为2-庚酮和2-壬酮。这两种酮类物质在Istrian干腌火腿中大量存在,具有强烈的奶酪香气,有助于火腿风味的形成[26]。
酯类化合物主要来自于羧酸和醇的酯化反应,由短链酸形成的酯具有果味,而由长链酸形成的酯具有脂肪气味[27]。在三地样品中检出的酯类物质有己酸乙酯和辛酸乙酯。这两种酯类物质具有甜味和果香味,通常作为发酵果酒中的特征风味化合物,对酒体香气有重要贡献[19,28]。
2.6 微生物与挥发性风味物质的关联分析
为了探索盘县火腿微生物群落中的潜在功能微生物,通过计算微生物与风味物质的皮尔逊相关系数,构建主要微生物属(丰度≥1%)与特征风味物质(OAV≥1)的相关性网络图。盘县火腿微生物群落与风味物质相关性分析见图4。
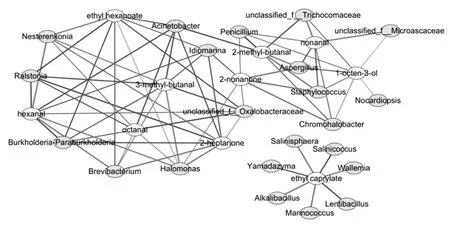
图4 盘县火腿微生物群落与风味物质相关性分析Fig.4 Correlations Analysis between microbial community and flavor compounds in Panxian ham
如图4所示,绿色节点代表微生物,黄色节点代表风味,节点间连线的粗细表示两者皮尔逊相关系数的大小,连线颜色为红色表示正相关,蓝色表示负相关。结果显示,盐单胞菌属、Nesterenkonia(涅斯捷连科氏菌属)和短杆菌属与3-甲基丁醛、2-庚酮、己醛、辛醛及己酸乙酯呈正相关;Idiomarina、Burkholderia -Paraburkholderia、Ralstonia(雷氏菌属)、Acinetobacter(不动杆菌属)及未分类的Oxalobacteraceae(草酸杆菌科)与相连的所有风味物质呈负相关;丰度较大的葡萄球菌属和曲霉菌属与2-甲基丁醛、2-壬酮及1-辛烯-3-醇呈正相关,与壬醛呈负相关。因此,葡萄球菌属、曲霉菌属、盐单胞菌属、涅斯捷连科氏菌属及短杆菌属可能是盘县火腿的潜在风味贡献者。
3 结论
研究对不同地区盘县火腿进行微生物多样性分析及挥发性风味物质检测。从三地样品中共检出24 个细菌门和2 个真菌门,以厚壁菌门和子囊菌门为优势菌门。在属水平上,共检出438 个细菌属和68 个真菌属,在WM、PG 和HG 火腿中均占优势的菌群为葡萄球菌属、盐单胞菌属和曲霉菌属。在OTU 水平上,PG和HG 火腿的细菌菌群结构类似,而WM 和PG 火腿在真菌群落结构上更相。从盘县火腿中检测到51 种挥发性风味物质,根据OAV≥1 的原则从WM、PG 和HG 火腿中分别筛选出8 种、10 种及9 种关键风味物质。基于微生物与风味物质的皮尔逊系数构建相关性网络图,对盘县火腿中潜在功能微生物进行挖掘,结果表明葡萄球菌属、曲霉菌属、盐单胞菌属、涅斯捷连科氏菌属和短杆菌属可能是盘县火腿的潜在风味贡献者。

