黔苦5号全麦荞茶的营养与抗氧化、免疫调节功效评价研究
曾海英,毛佳怡,李勇,朱怡,石明,秦礼康,2,6
(1.贵州大学酿酒与食品工程学院,贵州 贵阳 550025;2.贵州省荞麦工程技术研究中心,贵州 贵阳 550025;3.贵州省薏苡工程技术研究中心,贵州 贵阳 550025;4.贵州省植保植检站,贵州 贵阳 550001;5.黔西南喀斯特区域发展研究院,贵州 兴义 562400;6.西南药食两用资源开发利用技术国家地方联合工程研究中心,贵州 贵阳 550025)
荞麦属蓼科(Polygonaceae),荞麦属(Fagoprum),是双子叶植物。荞麦属有两个栽培种,即苦荞和甜荞[1]。苦荞所含蛋白质、脂肪、维生素、微量元素等都普遍高于其他作物[2-3]。苦荞兼具食用和药用价值,在我国医书《齐民要术》、《备急千金要方》、《群芳谱·谷谱》等著作中均有关于苦荞治病、防病之说。现代研究表明:苦荞黄酮具有降血糖血脂、抗疲劳、抗缺血、抗氧化、增强机体免疫力等多种保健作用[4-6]。
贵州地处西南,独特的地理优势孕育着丰富的苦荞资源,尤其是2016年国务院1 号文件把特色小杂粮作为粮食结构改革和特色作物产业发展重点后,贵州作为苦荞种植的三大基地之一,迎来了新的机遇,荞麦产业已成为贵州精准扶贫产业和大健康的特色优势产业。据统计,截止2016年,贵州荞麦种植面积近80 万亩,年产量约10 万吨,主要集中分布在毕节和六盘水等区域。黔苦5 号苦荞是贵州省威宁县农科所选育,2010年通过全国小宗粮豆品种鉴定委员会鉴定(鉴定编号为国品种鉴杂2010010)的贵州特有苦荞品种[7],近年来在全省范围内被广泛种植。然就其加工适应性、营养品质、功能组分活性及延伸产业链、开发精深加工产品缺乏科学、系统的理论与数据支撑。因此,本课题以黔苦5 号荞麦为原料,生产贵州特色全麦荞茶为研究对象,对其营养品质、抗氧化活性及免疫调节作用进行综合性评价,以期为黔苦5 号苦荞品种开发应用提供基础数据支撑,助力贵州苦荞产业发展。
1 材料与方法
1.1 材料与试剂
黔苦5 号全麦荞茶(QB5T)以贵州黔苦5 号荞麦为原料生产的贵州特色苦荞茶产品,由贵州荞麦生产企业提供,对照组(CK)为贵州黔苦1 号全麦荞茶。
KM 小鼠:6 周~8 周龄,雌雄各半,SPF 级,体重(20±2)g,重庆腾鑫生物技术有限公司提供,实验动物合格证号为:SCXK(军)2012-0011;IgG、IgM 测定试剂盒:上海鼓臣生物技术有限公司;鸡红细胞、补体(豚鼠血清):贵州省农畜产品贮藏与加工重点实验室自制。
芦丁、山奈酚、槲皮素、没食子酸标品:上海源叶生物科技有限公司;VC:湖南南化化学试剂厂;DPPH、ABTS:Sigma 公司;环磷酰胺:江苏恒瑞医药股份有限公司;2,4-二硝基氟苯 (2,4-dinitrofluorobenzene,DNFB):成都西亚试剂有限公司;瑞氏染料:天津市光复精细化工研究所。以上均为分析纯。
1.2 仪器
TU-1810 紫外分光光度计:北京普析通用仪器有限责任公司;FW100 高速万能粉碎机:天津市泰斯特仪器有限公司;TGL20M 台式高速冷冻离心机:长沙迈佳森仪器设备有限公司;SpectraMax 190 光吸收酶标仪:美谷分子仪器(上海)有限公司;MoticAE31 倒置相差显微镜:麦克奥迪实业集团有限公司;MB90 水分测定仪:奥豪斯仪器(常州)有限公司;JA1003 分析天平:上海精科仪表有限公司;1220 型液相色谱仪:美国安捷伦公司。
1.3 方法
1.3.1 感观评价
拟定详细的感官评分标准及分值,评定组由食品专业人员10 人组成,男女比例为1 ∶1,感观评分标准表如下。
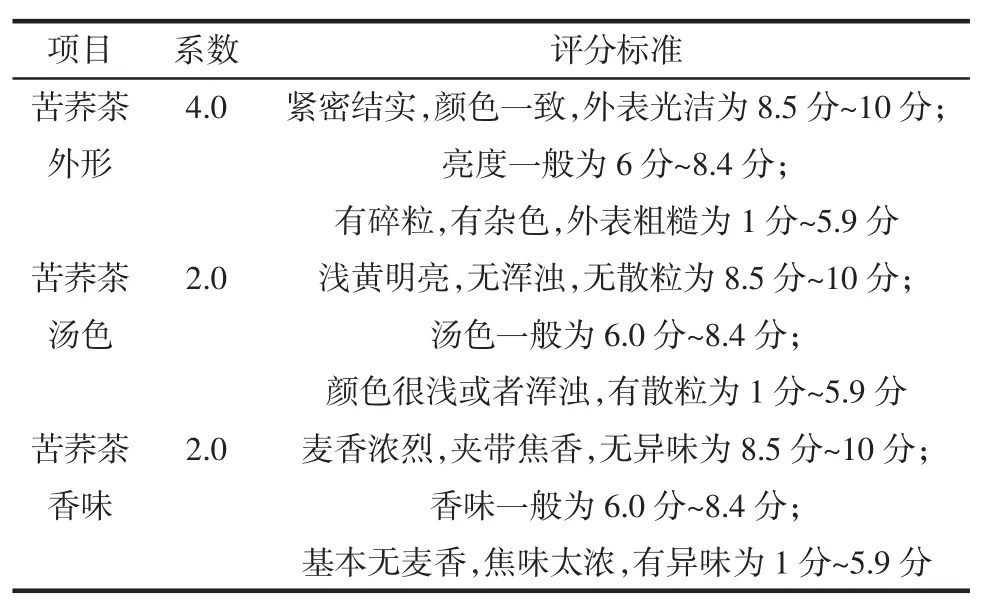
表1 苦荞茶感官评价指标Table 1 Sensory evaluation index of tartary buckwheat tea
1.3.2 营养成分分析
蛋白质的测定:GB 5009.6-2016《食品安全国家标准食品中蛋白质的测定》;脂肪的测定:GB 5009.6-2016《食品安全国家标准食品中脂肪的测定》;碳水化合物的测定:采用“减差法”[8];水分的测定:MB90 水分测定仪测定;灰分的测定:GB 5009.4-2016《食品安全国家标准食品中灰分的测定》。
1.3.3 功效成分分析
1.3.3.1 多酚测定
没食子酸标准曲线绘制:精密称取没食子酸标品10 mg,于10 mL 容量瓶中用60%乙醇溶解定容至刻度,摇匀。分别配制没食子酸浓度为 0、4、8、16、24、32、40、48、56 μg/mL 的标准溶液。精准吸取每个浓度的待测液0.2 mL,分别加入3 mL 饱和碳酸钠溶液和1 mL福林酚显色剂,混匀,26 ℃避光反应1 h。于765 nm 波长处测定其吸光度。以吸光度和没食子酸质量浓度求得回归方程,绘制标准曲线。
多酚的测定:准确称取样品2 g,加入一定乙醇溶液,水浴回流加热提取,冷却后于3 000 r/min 离心15 min,抽滤。用60%乙醇将澄清液定容至50 mL 即得到多酚待测液。取样液0.2 mL,与标准曲线相同的方法测定样品中多酚总含量。
1.3.3.2 黄酮测定
参照李勇等[9]的方法。芦丁、槲皮素、山奈酚等标准曲线制作略。
黄酮的测定:精称粉碎干样品1 g,60%乙醇20 mL,50 ℃超声浸提30 min(超声功率600 W,频率40 kHz),离心取上清液,加60%乙醇5 mL 清洗3 次,离心合并上清液,于 50 mL 容量瓶中定容,摇匀,过 0.22 μm 微孔滤膜,即得到黄酮待测液。取待测液0.2 mL,与标准曲线相同的方法测定样品中黄酮含量。
色谱条件:Agilent C1(8150 mm×4.6 mm,5 μm);流动相:甲醇 ∶0.4 %磷酸溶液(体积比1 ∶1);流速:1 mL/min;柱温:35 ℃;检测波长:360 nm;进样量:20 μL。
1.3.4 抗氧化能力测定
参照李海珊等[10]方法稍作修改,准确称取经粉碎样品 1 g,用 60 %的乙醇溶液,料液比 1 ∶25(g/mL),50 ℃超声浸提30 min(超声功率600 W,频率40 kHz),离心取上清液,加60%乙醇溶液5 mL 清洗然后离心合并上清液重复3 次,于50 mL 容量瓶中定容备用。分别将苦荞茶醇提物和VC配成浓度分别为0、25、50、100 μg/mL 的待测液。
1.3.4.1 清除DPPH 自由基能力测定
用甲醇稀释DPPH 至517 nm 下吸光值为0.98±0.02 得DPPH 自由基工作液,置于阴暗处反应40 min,4 ℃保存。取不同组别样液100 μL 分别与DPPH 自由基工作液 3.9 mL 混合,反应 30 min。用 100 μL 甲醇和3.9 mLDPPH 自由基工作液反应作对照,用无水乙醇为空白调节分光光度计,于517 nm 处测定吸光度。
计算公式:清除率/%=(A对照-A样品)/A对照×100
式中:A样品为样品液 100 μL 与 DPPH 自由基工作液 3.9 mL 混合吸光度,A对照为甲醇 100 μL 和 DPPH自由基工作液3.9 mL 混合吸光度。
1.3.4.2 清除ABTS+自由基能力测定
取 7 mmol/L ABTS 5.00 mL 和 140 mmol/L 过硫酸钾88 μL,避光反应16 h,将ABTS 溶液用乙醇稀释至在734 nm 波长处吸光值为0.7±0.02,取ABTS+自由基工作液3.9 mL 与样品液100 μL 混合,避光反应15 min。用100 μL 乙醇和3.9 mL ABTS+自由基工作液反应作对照,用无水乙醇为空白调节分光光度计,于734 nm处测定吸光度。
计算公式:清除率/%=(A对照-A样品)/A对照×100
式中:A样品为样品液 100 μL 与 ABTS+自由基工作液 3.9 mL 混合吸光度,A对照为乙醇 100 μL 和 ABTS+自由基工作液3.9 mL 混合吸光度。
1.3.4.3 铁离子还原能力(ferric reducing ability of plasma,FRAP 法)测定
用0.25 mol/L、pH 3.6 的乙酸缓冲液溶解TPTZ(10 mmol/L)和FeCl(320 mmol/L)配成FRAP 工作液。取样品液 0.5 mL 与FRAP 工作液 3.5 mL 混合,在 37 ℃下孵育10 min,用无水乙醇作空白对照,于593 nm 处测其吸光值。以FeSO4作为标准曲线。
1.3.5 免疫调节能力测定
1.3.5.1 构建小鼠免疫低下模型
参照宋金星等[11]方法稍作修改,KM 小鼠,随机分为空白对照组、环磷酰胺对照组、苦荞茶组高剂量组(TBH)、苦荞茶组中剂量组(TBM)、苦荞茶组低剂量组(TBL),高、中、低组灌胃剂量分别为600、300、150 mg/kg bw,每组10 只。各组小鼠腹腔注射环磷酰胺溶液,注射量为60 mg/kg bw,空白对照组腹腔注射等剂量的生理盐水,连续3 d,构建环磷酰胺所致小鼠免疫功能低下模型。小鼠免疫功能低下模型建立后,实验各组按照各自剂量灌胃,空白对照组及环磷酰胺对照组灌胃等剂量的生理盐水。
1.3.5.2 脾脏和胸腺指数测定
连续灌胃9 d 后禁食不禁水;24 h 后颈椎脱臼处死小鼠,取小鼠脾脏、胸腺,称重记数,计算脾脏指数及胸腺指数。脾脏指数=脾脏质量(mg)/体重(g),胸腺指数=胸腺质量(mg)/体重(g)。
1.3.5.3 耳肿胀率测定
连续灌胃6 d 后,于腹部涂抹8%的硫化钠去毛,均匀涂抹5%DNFB 50 μL;3 d 后于小鼠左耳均匀涂抹 1%DNFB 20 μL,于右耳均匀涂抹 20 μL 丙酮溶液进行对照;24 h 后颈椎脱臼处死,用打孔器取直径8 mm 的耳片,称重,计算肿胀率,肿胀率/%=[左耳质量(mg)/右耳质量(mg)-1]×100。
1.3.5.4 血清中IgG、IgM 含量测定
连续灌胃10 d 后摘眼球取血,1 500 r/min 离心10 min 取血清,按照IgG、IgM 测定试剂盒的使用说明书进行测定。
1.3.5.5 血清溶血素水平测定
连续灌胃6 d 后,腹腔注射2%鸡红细胞混悬液0.2 mL;4 d 后摘眼球取血,1 500 r/min 离心 10 min,取血清,用生理盐水稀释至100 倍;取1 mL 加10%的鸡红细胞悬浮液0.5 mL、10%的补体1 mL,混合均匀于37 ℃水浴30 min,置0 ℃冰箱中终止反应。1 500 r/min离心5 min,取上清液于540 nm 处测吸光度值。与不加血清的生理盐水试管作对照。
1.3.5.6 单核-巨噬细胞吞噬能力测定
连续灌胃6 d 后,每只小鼠腹腔注射4%的淀粉肉汤1 mL,以引诱体内的巨噬细胞向腹腔聚集;间隔2 h 后,每只小白鼠注射1%的鸡红细胞悬液1 mL。再间隔2 h,颈椎脱臼处死,放置于27 ℃环境下避免尸体僵硬,剪开腹壁皮肤,腹腔注射生理盐水2 mL,用手轻柔5 min,吸取腹液1 mL 均匀涂于载玻片上,立即37 ℃孵育30 min,用生理盐水缓慢冲洗1 min,吹干,染色进行观察。计数:油镜下观察,以巨噬细胞数200 个为记数范围,同时记数其中吞噬鸡红细胞的巨噬细胞数,记录结果,计算吞噬率,吞噬率/%=吞噬鸡红细胞的巨噬细胞/200×100。
2 结果与分析
2.1 感观、营养及功效成分分析
黔苦1 号全麦荞茶、黔苦5 号全麦荞茶感官、营养及功效成分测定结果见表2。

表2 QB5T 及QB1T 感官、营养及功效活性组分测定结果Table 2 Determination results of sensory,nutrient and bioactivity components of QB5T and QB1T
从表2感官评分及冲饮特性上分析,QB5T 与QB1T 差异显著(P<0.05),QB5T 茶汤更明亮,色金黄,有浓烈的麦香,夹带焦香,无异味。常规营养指标上,两者无显著差异,但QB5T 蛋白质含量达20.12%,较赵鑫[12]研究的11 个全麦苦荞茶蛋白高,可作为植物蛋白的良好来源[13-14]。QB5T 碳水化合物含量为69.50%,但苦荞比小麦含有更多的抗性淀粉和膳食纤维,因此苦荞引起糖尿病人血糖指数增加比小麦等谷物均低[15]。故此,荞茶在能满足糖尿病人对糖喜好及能量需求下,又能保持血糖稳定性,是糖尿病人的理想饮品之一。
QB5T 与QB1T 的黄酮组分高效液相色谱图见图1。
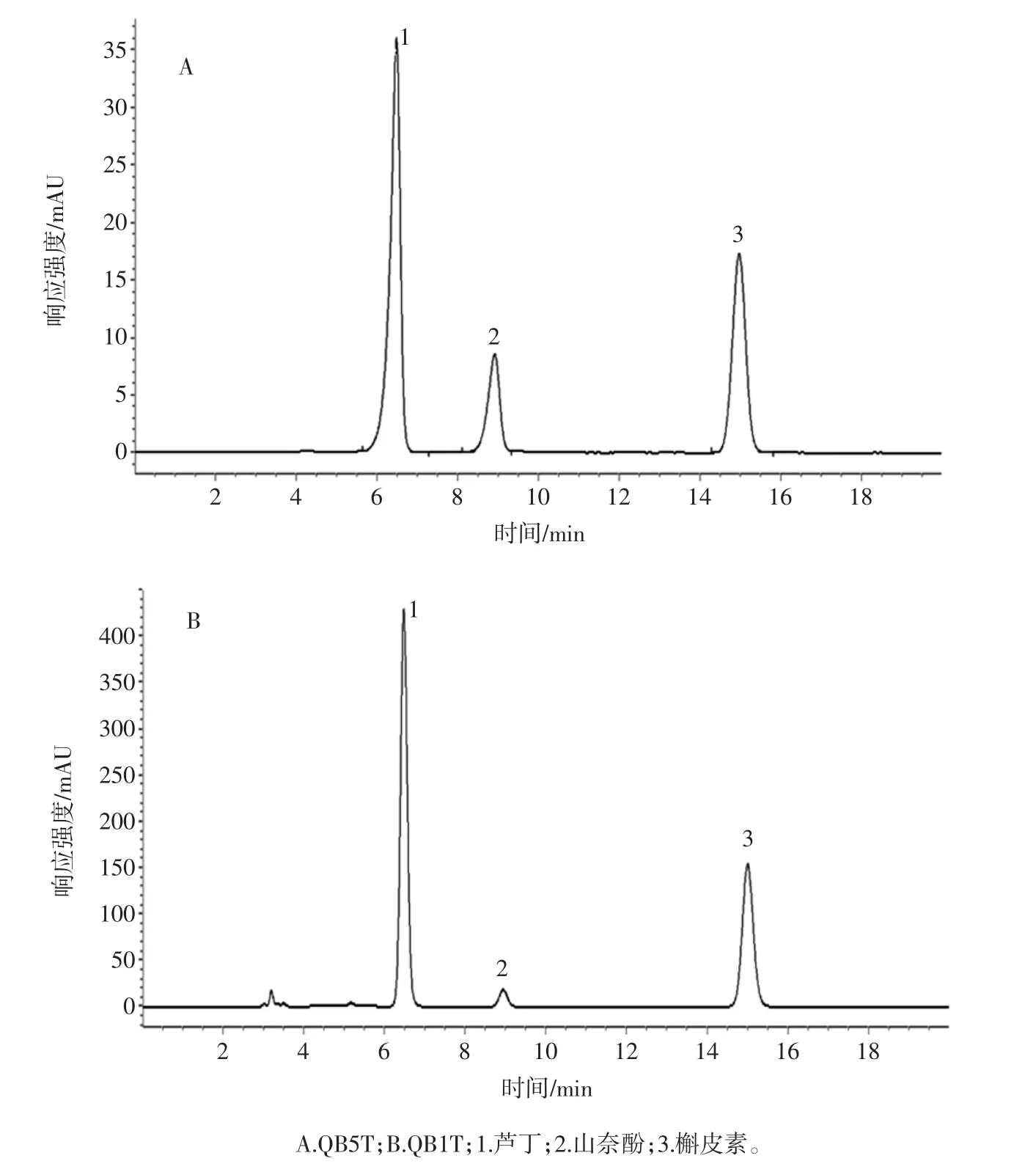
图1 QB5T 与QB1T 的黄酮组分高效液相色谱图Fig.1 High performance liquid chromatography of QB5T and QB1T
与QB1T 相比,QB5T 总黄酮及多酚含量丰富,分别为20.21 mg/g 和27.70 mg/g,显著高于 QB1T(P<0.05)。全麦荞茶黄酮组分主要为芦丁、山奈酚及槲皮素,由图1可知,QB5T 所含黄酮组分,其中芦丁为主成分,占黄酮含量的90.20%,含量为18.23 mg/g;山奈酚和槲皮素分别为 660.00 μg/g 和 412.33 μg/g。
2.2 醇提物的抗氧化活性
QB1T、QB5T 抗氧化活性评价结果见表3。
QB5T 醇提物的还原力及 ABTS+·、DPPH·清除率结果见图2。
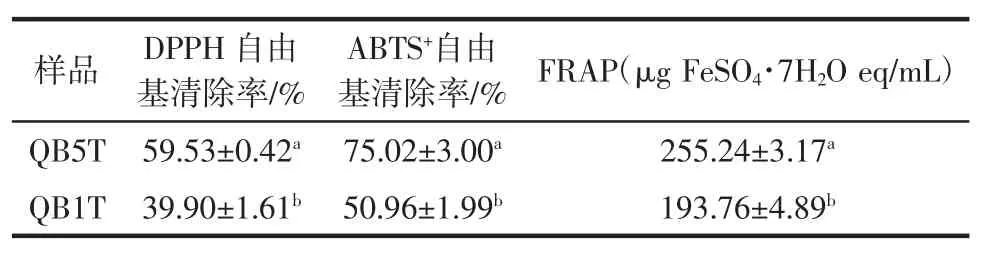
表3 QB5T 及QB1T 的抗氧化活性评价Table 3 Evaluation of antioxidant activity of QB5T and QB1T ethanol extract
由表3可知,QB5T 醇提物在 ABTS+·、DPPH·自由基清除率和铁还原力方面均显著强于QB1T(P<0.05),可能与其黄酮、多酚等物质含量较高有关。QB5T 与VC相比,两者抗氧化活性均随着质量浓度的增加而增加,且呈现量效关系。QB5T 对ABTS·+和DPPH·的IC50分别为 90.76 μg/mL 和 79.61 μg/mL,仅次于 VC的 71 μg/mL和 65.24 μg/mL;当 QB5T 质量浓度为 100 μg/mL 时,其最大清除率分别达59.53%、75.02%,自由基清除活性良好,这与Błaszczak W 等[16]的研究结果一致。相同浓度水平下QB5T 醇提物的FRAP 值相对高于 VC,且FRAP 值随着质量浓度的增加而增大,当质量浓度达到100 μg/mL 时,QB5T 醇提物的 FRAP 值达 255.24 μg FeSO·47H2O eq/mL,VC为 231.72 μg FeSO·47H2O eq/mL,表明QB5T 醇提物具有较好的还原能力且强于VC。
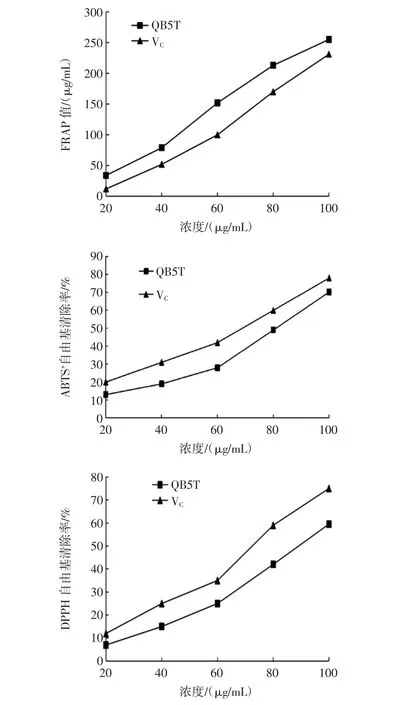
图2 QB5T 醇提物的还原力及ABTS+·、DPPH·清除率Fig.2 Reducing power and free radical scavenging rate of ABTS+·and DPPH·of QB5T ethanol extract
2.3 苦荞茶醇提物的免疫调节活性
QB5T 醇提物的免疫调节活性见图3。
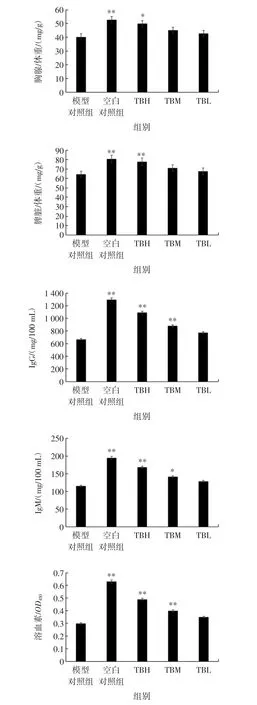
由图3可知,小鼠免疫低下模型成立(空白对照组与模型对照组差异极显著P<0.01)。QB5T 醇提物各剂量组,灌胃免疫低下小鼠,小鼠各项免疫指标均显著或极显著高于模型对照组,且呈现剂量-效应关系。QB5T醇提物高剂量组(TBH)免疫调节活性最强,表现在胸腺指数增加显著(P<0.05),脾脏指数增加极显著(P<0.01),分别为4.98 mg/g 和7.77 mg/g,表明QB5T 醇提物能修复小鼠脾脏和胸腺或促进其发育[17];IgG、IgM 含量增加极显著(P<0.01),分别为 1092.71、168.75 mg/100 mL,较模型组分别提高2.36 倍和1.91 倍,表明QB5T 醇提物可提高血清中IgG、IgM 含量水平,提升体液免疫能力[18];血清溶血素水平提高极显著(P<0.01),OD450值为0.49,表明QB5T 醇提物可提高血清溶血素水平,进而提高机体体液免疫能力[19];耳肿胀率增加极显著(P<0.01),耳肿胀率为122.09%,较模型组提高64.69%,表明QB5T 醇提物可提高细胞免疫功能;吞噬率增加极显著(P<0.01),吞噬率为 49.20 %,表明 QB5T 醇提物可提高机体非特异性免疫功能[20]。

图3 QB5T 醇提物的免疫调节活性Fig.3 Immunoregulation activity of QB5T ethanol extract
3 结论
贵州苦荞资源丰富,作为主要产区之一,衍生出众多苦荞企业与苦荞产品。黔苦5 号荞麦生产的全麦荞茶是地方优育品种生产的具有代表性的一类荞茶产品,其品质优良,营养丰富,多酚(27.70 mg/g)、总黄酮含量(19.83 mg/g)等功能活性组分含量高,醇提物具有较好的ABTS+·、DPPH·清除能力和还原能力,且浓度为100 μg/mL 时自由清除率分别为59.53%、75.02%,其自由清除率仅次于VC,而FRAP 值为255.24 μg FeSO4·7H2O eq/mL,高于VC,表现出较好的抗氧化活性。黔苦5 号全麦荞茶醇提物各剂量组均可提高免疫低下小鼠的胸腺和脾脏指数、血清中IgG、IgM 含量、血清血溶素水平、耳肿胀率及单核-巨噬细胞吞噬率,且高剂量组效果极显著(P<0.05),呈现剂量-效应关系,表现出较好的免疫调节作用。

