电针刺激后大鼠血清对成骨细胞OPG、RANKL mRNA及其蛋白表达的影响
金俊健
电针刺激后大鼠血清对成骨细胞OPG、RANKL mRNA及其蛋白表达的影响
金俊健
(临海市第二人民医院,临海 317016)
观察电针刺激去卵巢骨质疏松症模型大鼠的血清对体外培养成骨细胞的骨形成因子骨保护素(osteoprotegerin, OPG)和骨吸收因子(receptor activator for nuclear factor-kB ligand, RANKL)mRNA表达及其蛋白浓度的影响。将45只雌性SD大鼠,随机分为空白组(A组)、模型组(B组)、电针刺激组(C组),每组15只。除A组外,B组、C组均切除双侧卵巢。造模成功后,C组给予电针刺激,B组正常饲养,A组不做任何处理,常规正常饲养。12周后,采用水合氯醛麻醉各组大鼠,心脏采血,经过处理后加到体外培养的大鼠成骨细胞培养液中。采用碱性磷酸酶(ALP)检测成骨细胞活性,RT-qPCR法检测大鼠血清对OPG、RANKL mRNA表达的影响,ELISA法检测大鼠血清对OPG、RANKL蛋白浓度的影响。各组大鼠血清处理成骨细胞后,与A组比较,B组ALP的活性明显降低(<0.05),C组电刺激后成骨细胞内ALP的活性明显增加(<0.05)。与B组比较,A组及C组OPG mRNA表达及其蛋白浓度表达明显降低(<0.05);与A组比较,C组OPG mRNA表达及其蛋白浓度均明显降低(<0.05)。与B组比较,C组及A组RANKL mRNA表达及其蛋白浓度表达明显降低(<0.05);与A组比较,C组RANKL mRNA及蛋白浓度明显降低(<0.05)。C组大鼠骨密度明显高于B组(<0.05)。电刺激后的大鼠血清可以提升ALP、OPG水平,降低RANKL水平,其治疗骨质疏松症的机制可能与此有关。
针刺疗法;电针;骨质疏松;成骨细胞;骨保护素;骨吸收因子;大鼠
随着我国人口老龄化现象的加剧,患骨质疏松症的人数在逐年增加[1],其严重威胁人们的身体健康及生存生活质量[2],因此积极寻找有效的防治方法具有重要意义。中医是我国的瑰宝,其中应用针灸疗法治疗一些疾病具有显著疗效,近年来发现针灸治疗骨质疏松症具有一定的治疗效果[3],并且通过电针刺激法治疗骨质疏松症也已经成为国内外专家学者的研究点。在骨质疏松症发生发展过程中,OPG、RANKL系统在成骨细胞与破骨细胞相互调节的过程中起着重要作用。本文旨在通过研究电针刺激后的大鼠血清对体外培养的大鼠成骨细胞OPG、RANKL蛋白及mRNA表达的影响,探讨电针刺激疗法治疗骨质疏松症的机制。
1 材料和方法
1.1 实验动物与分组
采用3月龄SD大鼠45只(90 d),雌性,体质量为(280±20)g;SD乳鼠10只,购自北京维通利华实验技术有限公司[许可证号SCXK(京)2011-0011],饲养温度为25℃~27℃,湿度保持在50%~70%。实验对动物的处理方法符合中华人民共和国科学技术部颁发的《关于善待实验动物的指导性意见》。实验地点为临海市第二人民医院动物实验中心。动物适应性饲养1周后,将45只大鼠随机分为空白组(A组)15只和造模组30只。造模成功后,造模组再随机分为2组,模型组(B组)15只,电针刺激组(C组)15只。
1.2 主要试剂与仪器
10%水合氯醛(山东嘉颖化工科技有限公司);胎牛血清、DMEM培养基、胰酶、双抗(Gibico,美国);大鼠OPG、RANKL ELISA试剂盒(中国武汉博士德生物工程有限公司);碱性磷酸酶(ALP)试剂盒(南京建成生物工程研究所);RT-PCR试剂盒(日本,Takara)。
电针仪(广州市健玲医疗器械有限公司);多功能酶标仪(美国Bio-Rad公司);恒温箱(北京长安仪器厂);二氧化碳培养箱(Thermo Scientific);低温离心机型(美国Sigma公司);大鼠成骨细胞专用培养基(武汉普诺赛生命科技有限公司);PCR仪(美国ABI公司);微量移液器等。
1.3 模型建立[4]
大鼠腹腔注射10%水合氯醛(3 mL/kg)进行麻醉,固定于手术台上,经背部正中切口入路切除双侧卵巢后,逐层关闭,缝合肌肉、皮肤。乙醇消毒后,术后肌肉注射青霉素预防感染。术后第2天连续3 d做阴道细胞涂片,经证实卵巢切除完全,采用QDR4500A型双能X线骨密度测定仪测定大鼠骨密度(BMD,美国欧力士),采用放射免疫法测定血清雌二醇(BE,试剂盒购自上海信帆生物科技有限公司),大鼠BMD及BE明显降低,复制骨质疏松症模型成功。
A组不做任何处理,常规饲养。
B组造模成功后,常规饲养。
C组模型成功后,参照丁岩等[5]电针刺激方法干预大鼠,选背部L1-4夹脊、环跳(右侧)、足三里穴进行针刺。针刺深度为6~8 mm,针身接刺激仪指数曲线波3 Hz,强度控制在局部可见轻微肌肉收缩,留针刺激20 min。隔日1次,持续12周。
1.4 大鼠成骨细胞的体外培养
将SD乳鼠置于75%乙醇中浸泡,在无菌条件下取下颅骨(除去骨膜、结缔组织),用PBS清洗3次后将颅骨剪碎成约1 mm3。将骨片转到装有0.25%胰酶培养瓶中,消化完毕后去掉上清液;再用0.1%的Ⅱ型胶原酶消化收集合并上清液,终止消化,并将其用200目滤网过滤3次,1000 r/min离心10 min,弃掉上清,加入培养基制成细胞混悬液,接种于培养瓶,于5% CO2培养箱中37℃条件下培养,每3 d换液1次,直到80%细胞融合。细胞进行常规消化、传代,收集第二代细胞用于实验。
1.5 成骨细胞的血清处理方法
10%水合氯醛(3 mL/kg)麻醉各组大鼠后,心脏取血,冷置1 h,2500 r/min离心25 min,弃去沉淀物,保留上层血清。将上层血清采用56℃水浴灭活30 min,并用0.22mm的滤网抽滤除菌。将各组制备的血清按照10%的比例加入成骨细胞中培养3 d。
1.6 观察指标
1.6.1 ALP活性检测
收集各组血清处理后的成骨细胞上清液,按照试剂盒说明书操作,检测ALP活性。
1.6.2 RT-qPCR法检测成骨细胞OPG、RANKLmRNA表达的影响
收集各组血清处理后的成骨细胞上清液,提取细胞总RNA,于PCR仪中行逆转录,按照预先设定荧光定量PCR反应程序进行扩增,计算OPG、RANKL基因与GAPDH基因扩增条带表达量的比值表示。
1.6.3 ELISA法检测成骨细胞OPG、RANKL蛋白浓度的影响
收集各组血清处理后的成骨细胞上清液,严格按照试剂盒说明书操作。
1.7 统计学方法
所有数据采用SPSS19.0软件进行统计处理。符合正态分布的计量资料以均数±标准差表示,多组间比较采用单因素方差分析,组间比较采用检验。以<0.05表示差异具有统计学意义。
2 结果
2.1 各组大鼠骨密度测定
A组大鼠的骨密度值为(0.22±0.06)g/cm2,B组大鼠的骨密度值为(0.12±0.05)g/cm2,C组大鼠的骨密度值为(0.16±0.06))g/cm2,3组大鼠骨密度值比较差异有统计学意义(=11.603,=0.000),其中A组骨密度明显高于B组及C组(=6.811、3.406,均<0.05),C组明显高于B组(=3.406,<0.05)。
2.2 各组大鼠血清对成骨细胞ALP活性的影响
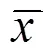
表1 各组大鼠成骨细胞ALP活性比较 (±s,U/gprot)
注:与B组比较1)<0.05
3组成骨细胞ALP活性比较,差异具有统计学意义(=476.75,<0.01)。其中A组、C组大鼠成骨细胞ALP的活性均明显高于B组(=39.127,<0.05;=36.359,<0.05)。详见表1、图1。
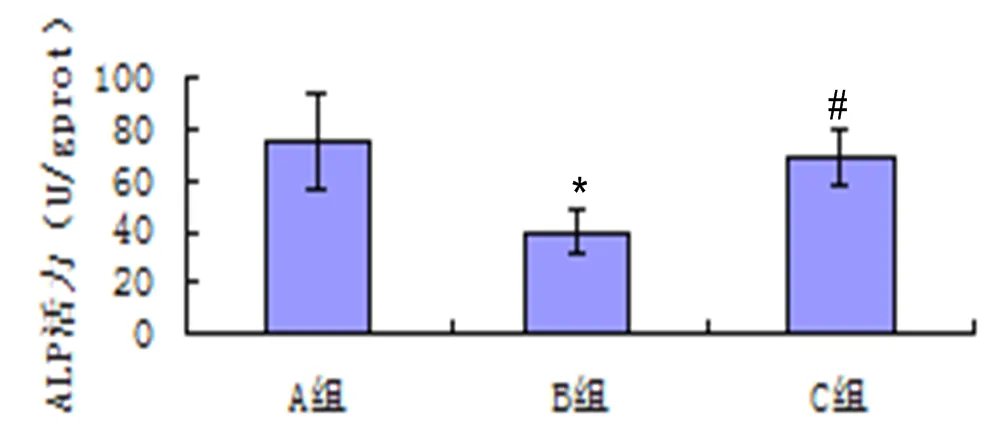
注:与A组比较*P<0.05;与B组比较#P<0.05
2.3 各组大鼠血清OPG、RANKL mRNA表达比较
与B组比较,A组及C组OPG mRNA表达明显降低(=55.578、34.064,<0.05),与A组比较,C组OPG mRNA表达明显降低(=21.514,<0.05)。与B组比较,A组及C组RANKL mRNA表达明显升高(=47.881、52.234,<0.05),与A组比较,C组RANKL mRNA表达显著升高(=4.353,<0.05)。与B组比较,A组及C组OPG/RANKL比值明显升高(=18.006、7.982,<0.05),与A组比较, C组OPG/RANKL比值明显降低(=10.024,<0.05)。详见表2。
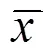
表2 各组大鼠成骨细胞OPG、RANKL mRNA表达比较 (±s)
注:与A组比较1)<0.05;与B组比较2)<0.05
2.4 各组大鼠血清OPG、RANKL蛋白浓度比较
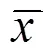
表3 各组大鼠成骨细胞OPG、RANKL蛋白浓度表达比较 (±s)
注:与A组比较1)<0.05;与B组比较2)<0.05
相较于B组,A组及C组RANKL蛋白浓度均明显升高(=70.048、57.418,均<0.05);与A组比较,C组RANKL蛋白浓度显著降低(=12.630,<0.05)。与B组比较,A组及C组OPG蛋白浓度明显降低(=30.168,<0.05;= 21.589,<0.05);与A组比较,C组OPG蛋白浓度显著降低(=8.580,<0.05)。与B组比较,A组及C组OPG/ RANKL比值均明显升高(=24.186,<0.05;=9.315,<0.05);与A组比较,C组OPG/RANKL比值明显降低(=14.871,<0.05)。详见表3。
3 讨论
有研究报道,通过探究生化、骨密度、生物力学、蛋白和基因等一些指标,表明针灸、电针刺激可以治疗骨质疏松症[6-9]。电刺激对成骨细胞有增殖的作用,可以影响骨的重建,而治疗骨质疏松症[10]。电刺激治疗骨质疏松症的机制可能是,调节破骨细胞骨破坏,促进成骨细胞的增殖与分化,影响骨的代谢,从而起到促进骨形成、抑制骨吸收,达到预防和治疗骨质疏松症的效果[11]。成骨细胞在骨组织的生长、发展过程中发挥着重要作用,可以合成、分泌骨基质,因此促进成骨细胞的成骨功能是防治骨质疏松症的主要疗法之一。本实验通过电针刺激血清学的方法,在蛋白及基因水平上进一步探究其对成骨细胞的骨形成及骨吸收的影响。
ALP是成骨细胞分化的一种酶蛋白,是成骨细胞分化的早期指标,成骨细胞分化越多ALP的表达就越多,ALP活性越高成骨细胞的形成越好,是骨形成指标。本实验结果显示,B组大鼠血清作用于体外培养的成骨细胞时相较于A组,ALP的活性明显下降,电针刺激后可以增加ALP的活性,提示电针刺激疗法能促进成骨细胞的分化,促进骨形成。
OPG、RANKL属于肿瘤坏死因子(TNF)家族,由成骨细胞表达,是破骨细胞分化、调节的信号因子,通过调控OPG、RANKL的表达可以调控骨吸收,是骨吸收、骨重建的重要因素[12-15]。成骨细胞可以通过分泌OPG、RANKL, OPG可与RANKL竞争RANK受体抑制破骨的形成及活性[16-19]。OPG是一种可溶性分泌型糖蛋白在成骨细胞中高表达[20],是RANKL的受体,可以与破骨细胞表面的RANK竞争性结合RANKL,阻断骨吸收信号传递以及破骨细胞的分化,抑制破骨细胞吸收活性。本研究结果显示,电针刺激后大鼠血清可以上调成骨细胞OPG mRNA的表达及蛋白浓度,提示电针刺激疗法可能通过促进成骨细胞OPG的表达,从而增加OPG与RANKL的结合,抑制破骨细胞的活性,以此来达到治疗骨质疏松症的效果。RANKL是影响骨吸收的关键因子,与破骨细胞表面的RANK结合,促进破骨细胞的分化,抑制其凋亡[21]。本实验结果显示,与A组血清相比,B组血清成骨细胞RANKL mRNA的表达及蛋白浓度明显升高,电针刺激后RANKL蛋白、mRNA显著下调,提示电针刺激疗法后的大鼠血清可能通过抑制RANKL的表达,来抑制破骨细胞的功能,从而治疗骨质疏松症。OPG/RANKL在机体中处于动态平衡,当比值下降时,会引起一些骨代谢疾病,而当比值升高时,会减弱破骨细胞的分化成熟[22]。在本实验中,电针刺激后大鼠血清作用于体外培养的成骨细胞可以使OPG/RANKL的比值增加,抑制破骨细胞分化,增加骨形成。对大鼠骨密度测试显示,电针刺激对大鼠的骨密度下降程度有所抑制。
目前,治疗骨质疏松症的方法主要是以药物为主,患者又大部分是老年人,由于年龄及身体因素的影响,对药物吸收较差,受副作用影响较大。OPG/RANKL/RANK信号系统是骨代谢的重要信号通路,是骨代谢疾病治疗的新靶点。
综上所述,骨质疏松症模型大鼠血清使成骨细胞ALP、OPG水平明显下降,RANKL水平增高,且OPG/RANKL显著下降,电刺激后的大鼠血清可以提升ALP、OPG水平,降低RANKL水平,调节OPG/RANKL的比值,在成骨细胞重建上,电针刺激后大鼠血清能影响OPG与RANKL的蛋白、mRNA水平表达,是治疗骨质疏松症的一种治疗方法,因此电针刺激疗法的应用将具有重要意义。
[1] 杨进廉,艾双春,刘江,等.针灸对骨质疏松症椎体压缩骨折患者生存质量的影响[J].上海针灸杂志,2016,35 (10):1229-1232.
[2] Nazrum AS, Tzar MN, Mokhtar SA,. A systematic review of the outcomes of osteoporotic fracture patients after hospital discharge: morbidity, subsequent fractures, and mortality[J]., 2014,10(18): 937-948.
[3] 宋亚文,浪万英,王亚军.针灸治疗绝经后骨质疏松症临床研究进展[J].中华中医药学刊,2016,34(6):1323 -1326.
[4] Cao H, Zhang Y, Qian W,. Effect of icariin on fracture healing in an ovariectomized rat model of osteoporosis[J]., 2017,13(5):2399- 2404.
[5] 丁岩,陈允震,刘海春,等.指数曲线电刺激治疗原发性骨质疏松[J].山东大学学报(医学版),2010,48(3): 70-73.
[6] Fan H, Ji F, Lin Y,Electroacupuncture stimulation at CV4 prevents ovariectomy-induced osteoporosis in rats via Wnt-b-catenin signaling[J]., 2016,13(3):2485-2491.
[7] Kim BH, Kim K, Nam HJ. A comparative study on the effects of systemic manual acupuncture, periauricular electroacupuncture, and digital electroacupuncture to treat tinnitus: A randomized, paralleled, open-labeled exploratory trial[J]., 2017,17(1):85.
[8] de Oliveira RF, Goldman RS, Mendes FM,. Influe- nce of electroacupuncture and laser-acupuncture on treating paresthesia in patients submitted to combined orthognathic surgery and genioplasty[J]., 2017,29(5):290-299.
[9] Kim MJ, Lee JH, Jang JU,. The efficacy of combination treatment of gabapentin and electro- acupuncture on paclitaxel-induced neuropathic pain[J]., 2017,21(6):657-666.
[10] Liu H, Peng F, Liu Z,. CYR61/CCN1 stimulates proliferation and differentiation of osteoblasts in vitro and contributes to bone remodeling in vivo in myeloma bone disease[J]., 2017,50(2):631-639.
[11] Langdahl B, Ferrari S, Dempster DW. Bone modeling and remodeling: potential as therapeutic targets for the treatment of osteoporosis[J]., 2016,8(6):225-235.
[12] Kang J, Choi YJ, Seo BY,.A Selective FGFR inhibitor AZD4547 suppresses RANKL/M-CSF/OPG- dependent ostoclastogenesis and breast cancer growth in the metastatic bone microenvironment[J]., 2019, 9(1):8726.
[13] Akbar IZ, Dewi FRP, Setiawan B.In Silico Interaction of the Active Compounds of Scurrula Atropurpurea with the RANK/RANKL/OPG System in Diabetoporosis[J]., 2019,27(1):8-11.
[14] Suthanthiran T, Annamalai S, Chellapandi S,.Gingival Crevicular Fluid Levels of RANKL and OPG After Placement of Collagen Membrane With Sim- vastatin in the Treatment of Intrabony Defects in Chronic Periodontitis[J]., 2019,11(Suppl 2):S301-S304.
[15] Ozer FF, Dagdelen S, Erbas T. Relation of RANKL and OPG levels with bone resorption in patients with acromegaly and prolactinoma[J]., 2018, 50(7):562-567.
[16] Chen Y, Yang K, Zhou Z,.Mechanical Stress Modulates the RANKL/OPG System of Periodontal Ligament Stem Cells via α7 nAChR in Human Deciduous Teeth: An In Vitro Study[J]., 2019,2019:5326341.
[17] El-Baz FK, Saleh DO, Abdel Jaleel GA,.Heamato- coccus pluvialis ameliorates bone loss in experimentally- induced osteoporosis in rats via the regulation of OPG/RANKL pathway[J]., 2019,116:109017.
[18] Chen B, Du Z, Dong X,.Association of Variant Interactions in RANK, RANKL, OPG, TRAF6, and NFATC1 Genes with the Development of Osteonecrosis of the Femoral Head[J]., 2019,38(7): 734-746.
[19] Ozaki Y, Koide M, Furuya Y,. Treatment of OPG- deficient mice with WP9QY, a RANKL-binding peptide, recovers alveolar bone loss by suppressing osteoclastoge- nesis and enhancing osteoblastogenesis[J]., 2017,12(9):e0184904.
[20] Choudhary S, Goetjen A, Estus T,. Serum amyloid A3 secreted by preosteoclasts inhibits parathyroid hormone-stimulated cAMP signaling in murine osteoblasts[J]., 2016,291(8):3882-3894.
[21] Hur J, Ghosh A, Kim K,. Design of a RANK- Mimetic peptide inhibitor of osteoclastogenesis with enhanced RANKL-binding affinity[J]., 2016, 39(4):316-321.
[22] Gong S, Han X, Li X,. Development of a high- throughput screening strategy for upregulators of the OPG/RANKL ratio with the potential for antiosteo- porosis effects[J]., 2016,21(7):738- 748.
Effect of Rat Serum after Electroacupuncture Stimulation on the Expressions of Osteoblastic OPG and RANKL mRNAs and Their Proteins
-.
317016,
To investigate the effect of ovariectomized osteoporosis rat serum after electroacupuncture stimulation on the expressions of in vitro cultured osteoblastic bone formation factor osteoprotegerin (OPG) and bone resorption factor receptor activator of nuclear factor-kB ligand (RANKL) mRNAs and the concentrations of their proteins.Forty-five female SD rats were randomized to a blank group (group A), a model group (group B) and an electroacupuncture stimulation group (group C), 15 rats each. Bilateral ovaries were excised in groups B and C except group A. After successful model making, group C was given electroacupuncture stimulation and group B, fed regularly. Group A was fed regularly without any treatment. After 12 weeks, each group of rats was anesthetized with chloral hydrate and blood was taken from the heart. The blood was processed and put in culture fluid for in vitro cultured rat osteoblasts. Osteoblast activity was measured using alkaline phosphatase (ALP). The effect of rat serum on the expressions of osteoblastic OPG and RANKL mRNAs was assessed using RT-qPCR. The effect of rat serum on the concentrations of OPG and RANKL proteins was determined using ELISA.After osteoblasts were treated with rat serumin in each group of rats, ALP activity decreased significantly in group B (<0.05), and osteoblastic ALP activity increased significantly in group C after electroacupuncture stimulation (<0.05), in comparison with group A. OPG mRNA expression and its protein concentration decreased significantly in groups A and C compared with group B (<0.05) and in group C compared with group A (<0.05). RANKL mRNA expression and its protein concentration decreased significantly in groups C and A compared with group B (<0.05) and in group C compared with group A (<0.05). Bone mineral density was significantly higher in group C of rats than in group B (<0.05).Rat serum after electroacupuncture stimulation can increase ALP and OPG levels and decrease RANKL levels, which may be related to the mechanism by which electroacupuncture treats osteoporosis.
Acupuncture therapy; Electroacupuncture; Osteoporosis; Osteoblast; Osteoprotegerin; Bone resorption factor; Rats
R2-03
A
10.13460/j.issn.1005-0957.2019.07.0798
1005-0957(2019)07-0798-05
2019-01-10
金俊健(1976—),男,主治医师

