NaCl对保加利亚乳杆菌抗氧化活性的影响
王婧莹 张国芳 杜 鹏 刘丽波 李晓东 李 春
(东北农业大学食品学院 乳品科学教育部重点实验室 哈尔滨150030)
氧化损伤是导致机体衰老的根本原因, 同时也是诱发多类疾病的一个重要原因[1-2]。 抗氧化食品的研制成为食品科学研究的重要课题之一。 发酵乳是目前公认的具有抗衰老作用的食品[3-5]。 保加利亚乳杆菌是乳制品工业生产中最常用的发酵剂之一, 环境中存在的和菌株自身代谢过程中产生的活性氧严重威胁到菌株的生长和生存[6-8]。 提高乳酸菌的抗氧化能力, 使乳酸菌具有较强的抗氧化活性, 对发酵乳制品生产和保健功能具有重要意义[9]。 NaCl 是生物体中重要的无机盐成分,维持着整个细胞的功能和结构的完整, 参与多种生理生化反应。Prasad 等[10]发现经过氯化钠刺激后的乳酸菌对冷冻干燥等环境抗胁迫性增加。 那么,NaCl 对保加利亚乳杆菌的抗氧化能力是否同样有提高作用,值得研究。
本文初步研究氯化钠对保加利亚乳杆菌抗氧化的影响, 对比氯化钠不同添加量孵育的菌株的抗氧化活性的差别, 为研制优良发酵剂提供理论支持。
1 材料与仪器
供试菌株为德式乳杆菌保加利亚亚种ATCC 11842,由东北农业大学乳品科学教育部重点实验室提供。 MRS 培养基,天津天力化学试剂公司;所有抗氧化试剂均为国产分析纯。
GL-21M 高速冷冻离心机, 上海市离心机械研究所; 紫外-可见分光光度计DU 800, 美国Beckman;超声细胞破碎机,宁波新芝生物科技股份有限公司。
2 试验方法
2.1 菌株活化
将菌株于-20 ℃冷冻保存,使用前将冻存菌按2%(V/V)的接种量接种到100 mL 的MRS 培养基中,振匀,37 ℃恒温培养12 h,传代活化2 次,保证菌数大于108CFU/mL,备用。
2.2 保加利亚乳杆菌生长曲线的测定
活化2 次的菌液接种在100 mL 的MRS 培养基在37 ℃培养,每2 h 取5 mL,测定培养液在600 nm 处的吸光值(OD600nm),分别以时间(t)为横坐标,吸光值(OD600nm)为纵坐标作图,得出生长曲线。
2.3 NaCl 对保加利亚乳杆菌生长代谢的影响
活化2 次的菌液按2%(V/V)接种量分别接入10 mL 氯化钠含量不同的MRS 培养基中,37 ℃恒温12 h 后, 测定培养液在600 nm 处的吸光值(OD600nm),分别以时间(t)为横坐标,吸光值(OD600nm)为纵坐标作图,得出曲线。
2.4 保加利亚乳杆菌耐H2O2 能力的测定
将活化两次的菌液,平均分为4 份,每份10 mL,离心收集菌体(4 000 r/min,15 min,4 ℃)。 将菌体沉淀分别重悬于10 mL MRS 培养基中 (使H2O2终浓度分别为0,0.5,1,2 mmol/L)。37 ℃恒温培养, 在0,2,4 h 时取样以不同稀释度涂布在MRS 固体培养基中,37 ℃恒温培养48 h, 进行菌落计数,根据不同浓度的菌落数,确定其H2O2致死浓度及亚致死浓度。
2.5 NaCl 对保加利亚乳杆菌耐H2O2 能力的影响
将活化后菌液接种在氯化钠添加量为0.1%~1%的10 mL MRS 培养基中,37 ℃恒温培养12 h后收集菌体,接种在H2O2浓度为1 mmol/L 培养基中,37 ℃恒温培养12 h,以不同稀释度涂布,计算存活率,重复试验3 次。

式中,AX——各浓度NaCl 胁迫时计数结果;APBS——PBS 计数结果;A0——各浓度NaCl 未胁迫时计数结果。
2.6 保加利亚乳杆菌体外抗氧化活性指标的测定
2.6.1 样品的处理 活化的菌液接种在氯化钠含量不同的100 mL MRS 培养基中, 培养12 h 后,收集菌体,重悬于100 mL 无菌去离子水中调整菌液浓度为109CFU/mL,所得菌悬液平均分为两组,一组作为完整细胞菌悬液组(Intact cell,IC),另一组用于细胞破碎物的制备。
菌悬液在冰浴中超声粉碎时间为10 min (超声10 s, 间隔15 s), 离心(6 000 r/min,10 min,4℃)得到的上清液即为乳酸菌无细胞提取物(Cellfree Extract,CFE)备用。
2.6.2 DPPH 自由基清除能力的测定 参考田丰伟[11]和Ianniello R G[12]的方法并加以改进:样品组为样品2 mL 和0.2 mmol/L DPPH-无水乙醇溶液1 mL,空白组为样品加无水乙醇溶液,对照组为蒸馏水代替样品,混匀后在室温下避光反应30 min,反应液离心(6 000 r/min,10 min,4 ℃),取上清液于517 nm 测吸光度。

式中:Ai——样品组测得的吸光度;Aj——空白组测得的吸光度;A0——对照组测得的吸光度。
2.6.3 羟自由基清除能力的测定 参考Yan S[13]和Herraiz T[14]的方法并加以改进:取样品1mL 分别加入5 mmol/L 硫酸亚铁溶液、5 mmol/L 水杨酸-乙醇溶液、3 mmol/L 双氧水溶液各1 mL,空白组则用等体积的蒸馏水代替样品,混匀后37 ℃水浴恒温反应15 min, 反应液6 000 r/min 离心10 min, 取上清液于510 nm 测吸光度, 用蒸馏水调零。
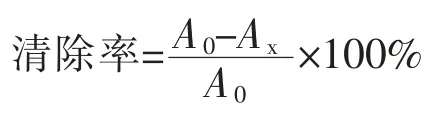
式中Ax——样品组测得的吸光度,A0——空白组测得的吸光度。
2.6.4 样品还原能力的测定 取样品0.5 mL 分别加入1%铁氰化钾溶液、0.2 mol/L PBS 溶液(pH=6.6)各0.5 mL,混匀后50 ℃水浴恒温反应20 min, 反应液降至室温后加入0.5 mL 三氯乙酸(10%),混匀后反应液4 500 r/min 离心10 min,取1 mL 上清液加入0.1%三氯化铁、蒸馏水各1 mL,于700 nm 处测吸光度,用蒸馏水调零,其中以L-半胱氨酸为标品[15-17]。
2.7 数据处理
本研究中所有数据均为3 次独立重复试验的结果,均采用平均数±标准差表示,利用Excel 和SPSS 对试验数据进行分析, 绘图借助Excel 软件完成,相关性分析采用相关系数法,以P<0.05 有显著统计学意义。
3 结果与分析
3.1 保加利亚乳杆菌生长曲线的测定
本试验研究保加利亚乳杆菌稳定期时的生长情况,因此测定了保加利亚乳杆菌在MRS 培养基中的吸光值(OD600nm),并绘制生长曲线,结果如图1 所示。 由图可知保加利亚乳杆菌在12 h 进入稳定期,OD 值在2.3~2.4。 因此,将菌株孵育12 h 以此研究保加利亚乳杆菌稳定期时的抗氧化情况。
3.2 NaCl 对保加利亚乳杆菌生长代谢的影响
NaCl 在一定浓度范围内可以维持微生物细胞内渗透压的平衡, 超过一定量则会使细胞死亡[18-20]。 所以研究培养基中的NaCl 浓度范围是首要任务。 本试验测定了活化后的菌株在添加不同浓度NaCl 的MRS 培养基中的吸光值(OD600nm),并绘制生长曲线,如图2 所示。

图1 保加利亚乳杆菌生长曲线Fig.1 Growth of Lactobacillus bulgaricus in medium

图2 不同质量分数NaCl 对菌体生长的影响Fig.2 Growth of Lactobacillus bulgaricus in different concentrations of NaCl
如图2 可知,NaCl 质量分数在0.1%~0.5%之间时菌体浓度变化较小,而随着培养基中NaCl 质量分数的升高,菌体浓度不断降低,当NaCl 质量分数大于1%时OD600nm小于2 当NaCl 质量分数大于2%时菌株的生长完全受到延滞。 因此,研究NaCl 对保加利亚乳杆菌抗氧化影响时NaCl 的添加量在0%~1%为宜。
3.3 过氧化氢胁迫亚致死值与致死值
亚致死水平的定义为胁迫作用后不限制菌体生长的最低胁迫水平, 致死水平为胁迫作用后活菌数显著下降的胁迫水平[21]。 本试验在确定保加利亚乳杆菌具有抗氧化的基础上, 研究保加利亚乳杆菌过氧化氢胁迫亚致死值与致死值, 在其亚致死值基础上作为氧化胁迫条件,研究NaCl 对保加利亚乳杆菌耐受性的影响。
由图3 可知, 保加利亚乳杆菌的过氧化氢耐受能力较低,H2O2浓度为1 mmol/L 时, 菌体的生长受到明显的抑制,菌体进入停滞的状态,在4 h期间菌落没有生长,但此时的菌体没有死亡,一旦去掉胁迫,又可以进入正常的生长状态。当浓度为2 mmol/L 时活菌数明显下降。 因此可以认为亚致死值为1 mmol/L,致死值为2 mmol/L。
3.4 不同质量分数NaCl 对保加利亚乳杆菌抗H2O2 能力的影响
本试验利用平板菌落计数法研究不同质量分数NaCl 对菌株耐H2O2的影响,确定最适NaCl 添加量。 由图4 可知,1 mmol/L H2O2胁迫下0.1%~0.3%范围内的NaCl 均能提高菌的存活率, 其中NaCl 质量分数为0.2%时可得到较高的抗氧化菌株,存活率为54.76%约是对照组的3 倍。

图3 保加利亚乳杆菌在不同H2O2 浓度条件下的活菌数Fig.3 Growth of Lactobacillus bulgaricus in MRS adjusted to different H2O2 concentrations

图4 不同质量分数NaCl 对菌体抗氧化的影响Fig.4 The antioxidant capacity of Lactobacillus bulgaricus in different concentrations of NaCl
3.5 保加利亚乳杆菌体外抗氧化能力的测定
3.5.1 DPPH 自由基清除能力的测定 DPPH 在517 nm 波长处有最大吸收,向其中加入自由基清除剂时,可以结合或替代DPPH 自由基,使自由基数量减少,吸光度变小,借此可评价清除自由基的能力[11]。 即通过在517 nm 波长处检测样品清除DPPH 的效果,来计算抗氧化能力。
按试验方法测得的完整细胞悬液(IC)和无细胞提取物(CFE)对DPPH 自由基清除结果如图5所示。
如图5 可知, 保加利亚乳杆菌对DPPH 有清除作用,加入不同浓度的NaCl 对清除作用有不同程度的影响。 NaCl 添加量为0.1%~0.2%时,完整细胞菌悬液组和无细胞提取物组对DPPH 自由基清除率明显提高,其中在0.2%时达到最大值分别为45.53%,35.29%, 明显高于对照组的39.67%,19.12%。 之后随着NaCl 浓度的增加,清除率相差不大。将两组数据对比发现,IC 组DPPH 自由基清除率明显高于CFE 组, 即无细胞提取物对DPPH清除能力较弱, 从图中发现添加0.2% NaCl 的无细胞提取物组清除率提高程度明显大于完整细胞悬液,这可能说明NaCl 主要促进胞内抗氧化物质的生成从而进一步提高清除DPPH 自由基能力。

图5 不同样品清除DPPH 自由基的能力Fig.5 Different samples of DPPH scavenging ability
3.5.2 羟自由基清除能力的测定 按试验方法测得的羟自由基清除结果如图6 所示。如图可知,保加利亚乳杆菌对羟自由基有一定的清除能力,无细胞提取物组的清除率远远大于完整细胞悬液组, 可推测保加利亚乳杆菌对羟自由基的清除能力主要是胞内物质决定的。 当添加不同量的NaCl时,清除能力不同,但同对照组12.44%,98.27%相比,均略有提高。 同样在0.2%时取得最大值分别为18.45%,98.72%。 从数据上分析NaCl 对无细胞提取物清除羟自由基的影响不大, 对完整细胞悬液略有提高,推测NaCl 主要通过促进胞外抗氧化物质的生成从而进一步提高清除羟自由基能力。

图6 保加利亚乳杆菌悬液(a)和无细胞提取物(b)对羟自由基清除能力Fig.6 Scavenging of hydroxyl free radicals by intact cells (a)and free-cell extracts (b)of Lactobacillus bulgaricus
3.5.3 样品还原能力的测定 有机化合物的还原活性与抗氧化性之间存在着一定的相关性。 还原电位越高的有机化合物给出电子的能力越强,这样其可能的抗氧化性能也有可能比较强, 因此测定样品的还原能力也常作为测定氧化活性的指标之一[22-23]。按试验方法测得的样品还原能力结果如表1 所示。
由表1 可知, 所有菌体还原能力在0.91~21.86 μmol/L 之间, 完整细胞悬液总体还原性大于无细胞提取物, 即保加利亚乳杆菌具有一定还原性。不同质量分数的NaCl 处理的菌株还原性均不同,0.1%~0.3% NaCl 能增强保加利亚乳杆菌还原性,其中0.2% NaCl 组还原性最强。
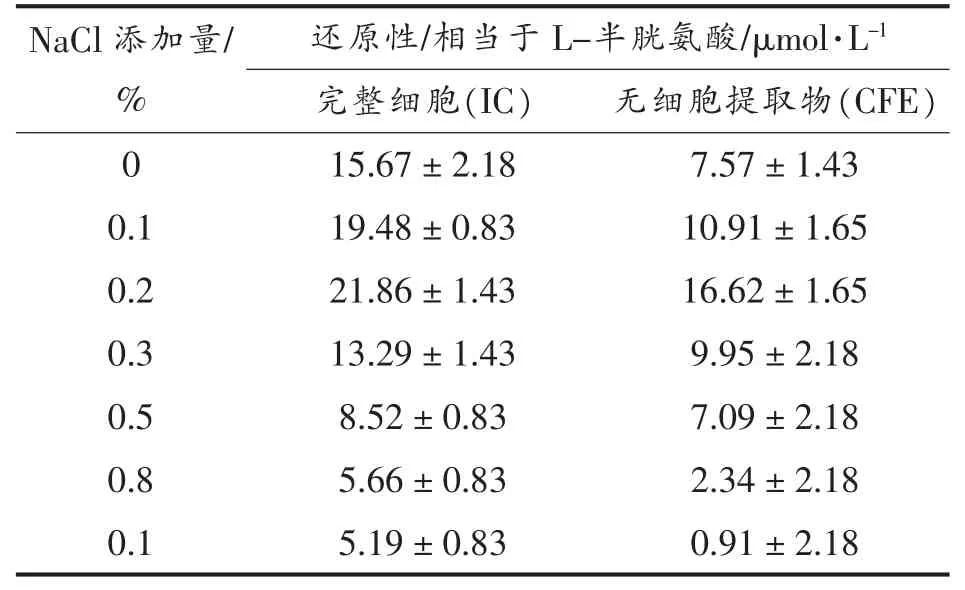
表1 不同NaCl 处理的乳酸菌分离物还原性Table 1 Reducing activities of different concentrations of NaCl
4 讨论与分析
乳酸菌是一类不属于抗氧化剂但存在抗氧化活性的食品级微生物[24-25]。 由于菌株的浓度,生长时期对抗氧化性有不同程度的影响, 因此本试验选取对象菌株保加利亚乳杆菌稳定时期进行抗氧化试验。 试验结果确定保加利亚乳杆菌在12 h 进入稳定期。
毕洁等[29]研究发现一定范围内的NaCl 与细胞的生长量和多糖产量呈正相关关系。 NaCl 是生命活动中必不可少的无机盐,适量浓度的NaCl 不仅能够增加生物量[20]、影响微生物群落结构[30]还能提高乳酸菌冻干存活率[31],但过量的NaCl 会使细胞膜破裂,细胞死亡。因此本试验通过OD600nm值在不影响菌的正常生长情况下初步确定研究NaCl质量分数范围为0.1%~1%。
很多研究学者利用评价抗氧化剂体外抗氧化能力的指标和方法来评价乳酸菌的抗氧化活性[6,17,26]。 这些评价指标包括体外氧化胁迫耐受(过氧化氢、超氧阴离子等)、脂质过氧化抑制、自由基清除(DPPH 自由基和羟自由基)、螯合金属离子、抗氧化酶活力等。本试验根据预试验结果最终选择通过H2O2耐受、清除DPPH 自由基和羟自由基能力以及还原性4 种指标确定NaCl 对保加利亚乳杆菌抗氧化的影响, 并确定最优添加量的值。
试验结果表明在H2O2亚致死值为1 mmol/L胁迫下0.2% NaCl 处理后的保加利亚乳杆菌存活率提升最高是对照组的3 倍。 对完整细胞悬液和无细胞提取物的抗氧化活性研究发现, 在每个指标下其抗氧化活性优势各不相同, 完整细胞悬液对DPPH 自由基清除能力及还原性强于无细胞提取物, 而在羟自由基清除方面无细胞提取物的优势尤为明显, 是否表明保加利亚乳杆菌引起抗氧化活性的物质各不相同, 无细胞提取物对羟自由基清除率高达90%以上, 分析一方面可能跟样品量有关, 另一方面可能说明保加利亚乳杆菌抗氧化活性主要表现在羟自由基的清除能力上。 虽然当前有许多对乳酸菌抗氧化机理的研究报道,但对于乳酸菌抗氧化胁迫作用的具体物质是什么还没有定论。 目前最被认可的一种说法就是乳酸菌胞内外抗氧化物质和氧化还原调控系统共同组成了活性氧和自由基清除系统, 进而达到抗氧化胁迫的作用[27,32]。 从数据来看,0.2% NaCl 将无细胞提取物DPPH 清除率从19.12%提高到35.29%,而完整细胞悬液的清除能力提升较小, 羟自由基清除率略有提高,从12.44%提高到18.45%,无细胞提取物还原能力提高了一倍多,因此,从统计学分析P<0.05 及数据结果来看,NaCl 对保加利亚乳杆菌的抗氧化性主要体现在耐H2O2能力、DPPH 自由基清除能力以及还原能力。 那么,NaCl 提高保加利亚乳杆菌的抗氧化机制是否是NaCl 能促进抗氧化物质的产生, 而这种抗氧化物质是否存在细胞内且更易与DPPH 结合替代还需要进一步研究,也为研究乳酸菌氧化机制提供一些参考。
5 结论
本试验通过H2O2耐受性、利用DPPH 自由基清除能力、羟自由基清除能力、还原活性作为体外抗氧化能力评价指标初步研究NaCl 对保加利亚乳杆菌抗氧化活性的影响, 本试验取得研究结论如下。
1)保加利亚乳杆菌在12 h 时进入稳定期,0.1%~0.5%的NaCl 能提高菌株的生物量, 大于2%菌株生长明显受到抑制。NaCl 能够不同程度地影响保加利亚乳杆菌生物量。
2)NaCl 在0.1%~0.3%范围内能不同程度地减弱H2O2对保加利亚乳杆菌的氧化损伤,提高菌体抗氧化能力,降低氧化应激反应,增强乳酸菌对H2O2胁迫的耐受性,提高活菌率,总体比较0.2%NaCl 抗氧活性最好且NaCl 对保加利亚乳杆菌的抗氧化性主要体现在耐H2O2能力、DPPH 自由基清除能力以及还原能力。
3)完整细胞悬液对DPPH 自由基清除及还原性有较高的活性, 无细胞提取液对羟自由基的清除能力远远大于完整细胞悬液。

