皮蛋蛋白水提物在肠道系统中的抗炎作用研究
赵 燕 徐明生 姚 瑶 李建科 王淑珍 汪 雄 王小强 涂勇刚*
(1 南昌大学生物质转化教育部工程研究中心 南昌330047 2 江西农业大学江西省天然产物与功能食品重点实验室 南昌330045 3 南开大学药物化学生物学国家重点实验室 天津300350)
肠道系统长期受到外来抗原、 微生物和有害物质的干扰或侵害, 是保护并维持机体内免疫平衡的一个重要屏障。 肠道上皮细胞(Intestinal epithelial cells,IECs)是肠道系统中的第一道防线,帮助机体抵御外来各种损害, 是黏膜表面天然和获得性免疫调节系统中的重要角色。 肠上皮细胞如长期受到干扰或侵害, 会上调一系列炎性细胞因子、化学趋化因子及前列腺素的表达,分泌过多的促炎细胞因子, 促使免疫细胞产生更多的炎性介质,导致机体不可控的慢性炎症[1]。 而长期的慢性炎症会使肠道黏膜通透性增加,肠道组织损伤,黏膜免疫内稳态异常,严重危害机体健康[2]。
炎症性肠病 (Inflammatory bowel disease,IBD)是一类独特的慢性复发性肠道炎性疾病,为消化系统常见疾病, 包括克罗恩病 (Crohn’s dis ease,CD)和溃疡性结肠炎(Ulcerative colitis,UC)[3]。在过去的30年,IBD 发病率在全球均呈上升趋势,在发达国家尤其明显[4-5]。一般认为IBD 由遗传易感性、外部环境因素、肠道微生物菌群、免疫反应、 破坏黏膜屏障以及炎症介质增多等多因素导致[6-7]。对IBD 的治疗,目前治疗策略包括免疫抑制剂、皮质类固醇和抗-TNF-α 抗体的使用。然而,这些传统医学治疗方法,虽有疗效,但有一定的副作用[8]。研发新型安全具有抗肠炎作用的食源性生物活性物质已成为生命科学领域的研究热点之一。溶菌酶[9]、大豆肽[10-11]、氨基酸[12-13]、植物提取物[14-15]等食源性组分均被证明具有抗肠道炎症作用。
皮蛋是我国独创的大宗传统蛋制品, 加工历史已有600 余年,因其风味独特、营养丰富、色泽美观而深受消费者喜爱, 是目前市场上主要的蛋制品品种。中医古籍《医林纂要探源》记载皮蛋“泻肺热、醒酒、去大肠火、治泻痢。 能散、能敛”。 生活中, 人们也一直把皮蛋作为一种良好的清热去火食品, 在咽喉疼痛、 便秘等上火时常选择食用皮蛋。 目前对其“清热去火”功效的相关研究却未见学术报道。以“去大肠火”为导向,运用现代试验模型和技术手段研究皮蛋蛋白水提物的体内、 外抗肠炎活性, 以期为皮蛋的进一步推广和高值化利用提供理论基础。
1 材料和方法
1.1 材料与试剂
新鲜鸭蛋,南昌县塘南镇蛋鸭养殖场;红茶,江西云林茶业有限公司;食盐,江西省盐业集团公司;氢氧化钠(食用级),天津市津华化工厂;硫酸铜(分析纯),国药集团化学试剂有限公司;牛血清(FBS)、 盘尼西林-链霉素,Gibco 公司;TNF-α、Mouse anti -human IL -8 antibody、Biotinylated mouse anti-human IL-8 antibody、IL-8 标准品、过氧化物酶标记(Av-HRP)、3,3′,5,5′-四甲基联苯胺(TMB)、TNF-α 检测试剂盒、IL-6 检测试剂盒,BD Bioscience 公司;吐温-20,Fisher 公司;水溶性四唑盐 (WST-1),Roche 公司;Bio-Rad DC、Aurum Total RNA Mini Kit、iQ SYBR Green Supermix、iScript cDNA 合成试剂盒,Bio-Rad 公司;葡聚糖硫酸钠(DSS),MP Biomedicals 公司;人的肠道细胞Caco-2,中科院细胞库;雌性Balb/c 小鼠,湖南斯莱克景达实验动物有限公司。
1.2 仪器与设备
CO2细胞培养箱, 美国Thermo 公司;NanoDrop ND-1000,Thermo Scientific 公司;RT-PCR仪(MyiQ series),Bio-Rad 公司;细胞培养瓶及培养板,Corning Costar 公司。
1.3 试验方法
1.3.1 皮蛋的腌制 将3%茶叶水煮沸,倒入配料缸中冷却, 然后缓慢加入0.4%硫酸铜、4%食盐与4.5%氢氧化钠,并不断搅拌,冷却至常温备用。 将直接购于养殖场的新鲜鸭蛋洗净晾干, 验收后将其依次码放在洗净的腌制缸中, 加入配制好的料液,然后用塑料膜封盖,并在上面添置一定量水压好,25℃恒温腌制约35d 后取出,常温保存。
1.3.2 皮蛋蛋白水提物的制备 取皮蛋蛋白,按1∶2 加入超纯水, 高速匀浆处理后振荡30 min,然后用纱布过滤, 过滤液在4 ℃条件下8 000 r/min离心10 min,收集上清液,0.22 μm 膜过滤,然后采用美国Spectra100 Da 透析膜除盐与氨基酸,半天换水一次,连续透析2 d,冷冻干燥获得皮蛋蛋白水溶性提取物。
1.3.3 细胞培养 将Caco-2 培养于DMEM 培养液中, 加入20% FBS 和50 units/mL 盘尼西林-链霉素,并在5% CO2和37 ℃环境中培养,本试验中使用细胞代数为20~50 代。 细胞接种后培养6~7 d 直到达到细胞融合,每隔2~3 d 换一次新鲜的培养液。
1.3.4 样品抑制TNF-α 诱导Caco-2 细胞炎症反应 将培养好的Caco-2 细胞接种到48 孔板(1×105细胞/孔)上培养5~7 d,待细胞融合80%~90%时吸除培养基,并采用HBSS 清洗1 次,然后加入采用含有不同浓度样品的细胞培养基 (含5%FBS)进行培养,2 h 后加入2 ng/mL TNF-α 诱导细胞炎性反应,4 h 后收集上清液测定IL-8。
1.3.5 样品细胞毒性研究 采用水溶性四唑盐试剂(WST-1)测定。处理完的细胞将上清液(即培养基)去除,每孔加入200 μL 与培养基体积比为1∶30 的WST-1 溶液,置于5% CO2细胞培养箱中培养5~15 min,每隔5 min 查看颜色变化,待颜色变为浅橙色在450 nm 处测定吸光度值。
1.3.6 IL-8 的测定 采用酶联免疫法测定。 将Purified mouse anti-human IL-8 monoclonal antibody 用pH 9.0 0.1 mol/L 磷酸钠缓冲液稀释(1∶1 000,V/V),后分别加入100 μL 至96 孔板中,置于4 ℃过夜。 用磷酸盐缓冲液 (PBS)-0.05%Tween-20(PBST)洗涤4 次,加入200 μL/孔的1%牛血清白蛋白(BSA)的PBS 溶液,在37 ℃条件下孵育1 h,用PBST 溶液洗涤4 次。 标准品和样品采用1%的PBST 溶液稀释5 倍, 向96 孔板中加入100 μL/孔的稀释后的标准品和样品,然后置于37 ℃条件下孵育2 h,用PBST 溶液洗涤4 次。 将Biotinylated mouse anti-human IL-8 antibody 稀释2 000 倍,加入100 μL/孔,然后于37 ℃条件下孵育1 h, 洗涤4 次后, 加入稀释2 000 倍的Av-HRP 酶100 μL/孔,37 ℃条件下孵育30 min,洗涤4 次,最后加25 μL/孔TMB 酶作用溶液,于常温或37 ℃黑暗处显色, 直到颜色变为浅蓝色, 用1 N H2SO4终止反应,并于450 nm 测定吸光度值。样品中IL-8 的浓度通过标准曲线进行换算。
1.3.7 细胞因子mRNA 表达的测定 将细胞置于24 孔板中培养后加入样品抑制炎性反应,抽提细胞培养体系总RNA 逆转录后使用RT-PCR 检测。 采用Fast 200 试剂盒抽提细胞总RNA,测定浓度后取RNA 200~300 ng 在逆转录酶作用下用OligdT 引物合成待测细胞因子cDNA。 在含有1 mmol/L MgCl2和1U Taq DNA 聚合酶的RT-PCR SYBR Green 反应体系中反应。内参选用GAPDH,引物序列见表1。 PCR 循环参数为:95 ℃15s 变性,56 ℃15s 退火,72 ℃30 s 延伸。 PCR 扩增曲线由RT-PCR 仪获得各目的分子CT 值,由2-△△CT法计算出RQ 值, 代表细胞因子的相对表达水平[16]。

表1 RT-PCR 引物序列Table 1 Sequence of primers in RT-PCR
1.3.8 动物实验设计 选取BALB/c 雌性小鼠,6~8 周左右,体重 (20.0±2.0)g。 所有小鼠饲养于塑料鼠笼中,可以自由饮用水和基本膳食。保持温度(25±0.5)℃,相对湿度50%±5%,并执行12 h/12 h的灯光/黑暗循环。小鼠在购买饲养7 d 后,随机分为6 组,每组10 只,并给所有组小鼠提供相同的基本膳食。 饲养第7 天开始,小鼠连续7 d 经饮用水服用5% DSS 致急性结肠炎, 结束后致死小鼠[17]。将小鼠的结肠移除并测定结肠的长度。移除大约10%远端结肠并保存于福尔马林溶液中,用于组织学观察;部分小鼠结肠组织放入离心管中,快速冷冻,用于细胞因子的测定;部分小鼠结肠组织放入RNAlater 中,用于基因表达分析。 试验分组如下:空白组,全程饮用不含DSS 灭菌水+灌胃0.2 mL 生理盐水; 阳性对照组,1~7 d 饮用不含DSS 灭菌水,8~14 d 饮用含5% DSS 灭菌水,全程灌胃0.2 mL 生理盐水;低浓度组,1~7 d 饮用不含DSS 灭菌水,8~14 d 饮用含5% DSS 灭菌水,全程灌胃0.2 mL 皮蛋蛋白水提物溶液(150 mg/kg);高浓度组,1~7 d 饮用不含DSS 灭菌水,8~14 d 饮用含5% DSS 灭菌水,全程灌胃0.2 mL 皮蛋蛋白水提物溶液(300 mg/kg)。
1.3.9 体重变化与结肠损伤评价 确定和评价小鼠的3 个主要结肠炎表征:体重变化、粪便黏稠度(包括腹泻记录)和粪便便血。 结肠损伤通过粪便黏稠度和粪便便血进行评估。 对粪便黏稠度,0 分表示正常并状态良好的粪便,1.5 分是呈糊状的粪便,而3 分表示的是粪便液化并黏在肛门上。 对粪便便血,0 分表示没有粪便便血,1.5 分是有粪便便血,3 分是便血严重[18]。
1.3.10 结肠组织学分析 对组织进行固定,石蜡切片和苏木精伊红染色。 同时按以下指标进行评分,严重程度越高,评分越高:炎症(0~3),隐窝损伤(0~3)和渗透程度(0~3)。 三项相加,总分在0~9范围内[18]。
1.3.11 结肠炎性细胞因子的测定 将100 μg 的样品组织, 加入4 倍体积的含有0.5% Triton X-100 和蛋白酶抑制剂 (10 μg/mL aprotinin、leupeptin、pepstatin 和 1 mmol/L phenylmethanesulfonylfluoride)的PBS 缓冲液,高速匀浆,4 ℃条件下12 000 r/min 离心10 min,DC Protein Assay 法测定上清液蛋白质含量, 采用ELISA 试剂盒测定TNF-α、IL-6 浓度。
1.4 数据统计分析
数据结果均以平均值±标准差表示, 采用SPSS13.0 软件进行数据方差分析(Duncan 新复极差多重比较法),P<0.05 表示差异显著。
2 结果与分析
2.1 皮蛋蛋白水提物体外抗肠炎作用
Caco-2 细胞是肠上皮细胞的一种,已成为研究肠道炎症的稳定体外模型系统,其在TNF-α 诱导下会分泌大量的促炎细胞因子IL-8[19-20]。如图1所示,正常Caco-2 细胞中IL-8 的含量极低,但在TNF-α 刺激4 h 后IL-8 的分泌量从(204.66±8.88)pg/mL 上升到(2 450.38±105.52)pg/mL,说明建立体外炎症模型成功。 以此模型考察了浓度分别为0.1,0.5,1,5,10 mg/mL 的皮蛋蛋白水提物抑制炎症作用, 结果表明各添加浓度均未对Ca co-2 细胞产生毒性,在高浓度的情况下(5 和10 mg/mL)皮蛋蛋白水提物呈现出一定的体外抗肠炎作用(P<0.05)。
在该细胞模型条件下, 进一步考查了皮蛋蛋白水提物对细胞抑炎细胞因子和促炎细胞因子mRNA 表达的影响。 结果表明添加皮蛋蛋白水提物(10 mg/mL)处理后可明显下调Caco-2 细胞IL-8、TNF-α、IL-6 和IL-1β 等促炎细胞炎症的基因表达量。 同时,皮蛋蛋白水提物可上调Caco-2 细胞抑炎细胞因子IL-10 的基因表达量。
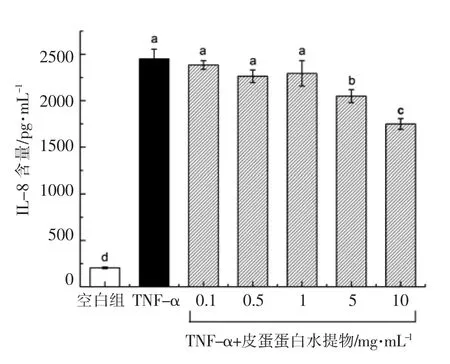
图1 皮蛋蛋白水提物在TNF-α 诱导的Caco-2细胞炎症模型中的抗炎作用Fig.1 Anti-inflammatory effect of water extract of preserved egg white in TNF-α induced Caco-2 cell inflammation model
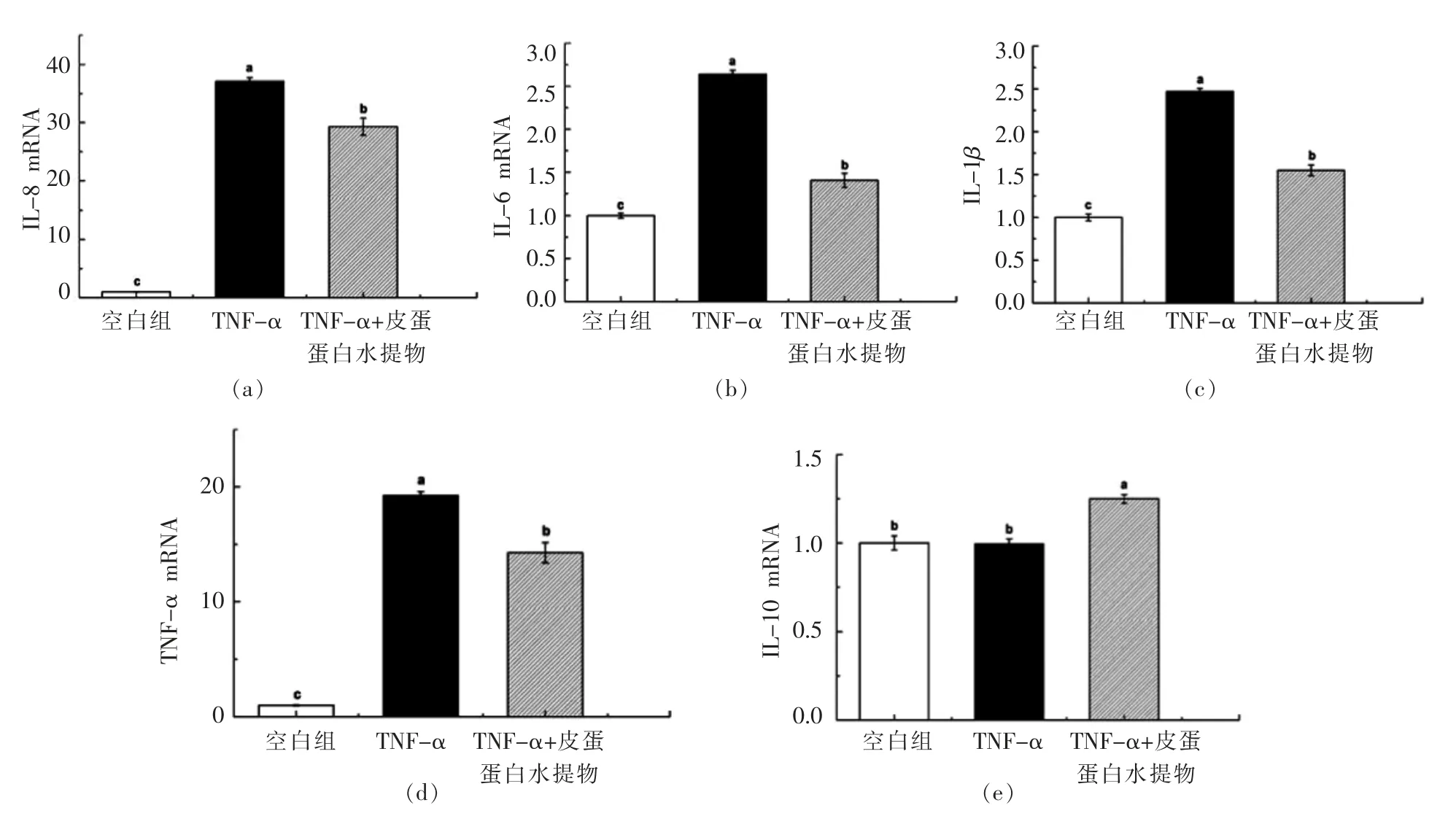
图2 皮蛋蛋白水提物在TNF-α 诱导的Caco-2 细胞炎症模型中调节mRNA 表达的作用Fig.2 Effects of water extract of preserved egg white on the mRNA expressions in TNF-α induced Caco-2 cell inflammation model
2.2 皮蛋蛋白水提物体内抗肠炎作用
2.2.1 皮蛋蛋白水提物对DSS 诱导结肠炎小鼠临床症状的影响 DSS 可损伤小鼠结肠上皮细胞,破坏肠屏障完整性, 并激活促炎细胞因子的分泌和基因表达,导致严重的结肠炎,是典型可靠的体内结肠炎模型[21-22]。本研究采用此模型考察了皮蛋蛋白水提物在体内的抗炎活性。对比空白对照组,从DSS 处理后第6 天始阳性对照组小鼠的体重开始显著降低(P<0.05)。 然而在第7 天,皮蛋蛋白水提物低剂量和高剂量试验组小鼠体重降低的程度与阳性对照组均有了显著性差异(P<0.05),表明皮蛋蛋白水提物可以缓解DSS 诱导的结肠炎造成的小鼠体重下降(图3a)。
DSS 诱导5d 后小鼠出现明显的结肠炎临床症状,如腹泻、直肠出血和嗜睡,灌胃皮蛋蛋白水提物后,与阳性对照组相比,第5 天后高浓度组和低浓度组腹泻和出血等临床症状均明显减轻(P<0.05)(图3b)。
本试验中, 采用DSS 诱导的结肠炎组其结肠长度为(5.34±0.24)cm,而未经诱导的空白组为(7.01±0.31)cm,可见DSS 诱导后可明显导致小鼠结肠受损,使其长度变短。在经过皮蛋蛋白水提物干预后, 高浓度和低浓度组均可有效缩短结肠的缩短程度(P<0.05)(图3c)。

图3 皮蛋蛋白水提物对DSS 诱导小鼠结肠炎临床症状的影响Fig.3 Effects of water extract of preserved egg white on clinical signs in DSS-induced colitic mice
2.2.2 皮蛋蛋白水提物对DSS 诱导结肠炎小鼠结肠组织学形态的影响 图4 是通过苏木精-伊红染色后的结肠组织学观察结果。 由图可以看出空白组小鼠结肠组织学正常并拥有正常的隐窝结构。 然而,DSS 结肠炎组小鼠固有层和黏膜下层的细胞出现浸润。 高浓度和低浓度样品组均能减少结肠黏膜,黏膜下层和固有肌层的破坏。组织学形态评分结果表明DSS 结肠炎组其组织学分数为14.78±1.55,而经过皮蛋蛋白水提物干预后的结肠炎小鼠的组织学分数显著低于DSS 组, 分别为10.89±1.06 和7.31±0.36, 浓度越高减缓结肠炎小鼠的组织学变化效果越好。

图4 皮蛋蛋白水提物对结肠组织学的影响Fig.4 Effects of water extract of preserved egg white on colon histology
2.2.3 皮蛋蛋白水提物对DSS 诱导结肠炎小鼠促炎细胞因子分泌量的影响 各组小鼠结肠组织中促炎细胞因子TNF-α 和IL-6 浓度分析结果如图4 所示。 由图可知,DSS 诱导后小鼠结肠组中分泌了大量的促炎细胞因子TNF-α 和IL-6, 分别由(18.65±2.99)pg/mg 蛋白质、(8.03±1.38)pg/mg 蛋白质上升到 (42.31±5.76)pg/mg 蛋白质、(22.46±1.67)pg/mg 蛋白质, 但在高浓度和低浓度皮蛋蛋白水提物干预后其分泌量均显著下降(P<0.05)。

图5 皮蛋蛋白水提物对结肠组织TNF-α (a)和IL-6 (b)含量的影响Fig.5 Effects of water extract of preserved egg white on the concentration of TNF-α (a)and IL-6 (b)in colon
2.2.4 皮蛋蛋白水提物对DSS 诱导结肠炎小鼠促炎和抑炎细胞因子基因表达的影响 皮蛋蛋白水提物对小鼠结肠促炎细胞因子和抑炎细胞因子mRNA 表达的影响结果见图5。 如图所示,与阳性对照组小鼠比较,灌胃150 mg/kg 和300 mg/kg 皮蛋蛋白水提物均能不同程度降低促炎细胞因子IL-6、MCP-1、INF-γ、TNF-α、IL-1β、IL-17A 等基因的表达(P<0.05), 同时对抑炎细胞因子IL-10的基因表达有一定的促进作用(P<0.05)。
3 讨论
禽蛋蛋清中90%以上固形物为蛋白质, 且种类达一百余种,其中富含卵白蛋白、卵转铁蛋白、卵黏蛋白、卵类黏蛋白和溶菌酶等多种蛋白质[23]。皮蛋由氢氧化钠、氯化钠、茶叶、硫酸铜或硫酸锌等作用下腌制而成, 其中起主要作用的为氢氧化钠[24]。 在强碱的诱导下,禽蛋蛋清形成了主要由离子键和二硫键作用的高弹性低硬度凝胶体。 本实验室研究已证实在皮蛋腌制过程中, 除了溶菌酶较为稳定以外,卵白蛋白、卵转铁蛋白、卵黏蛋白、卵类黏蛋白等其它高含量蛋白质在强碱的作用下均发生了明显的降解, 多肽和游离氨基酸含量逐渐升高,因此水溶性组分增多[25-26]。 本研究首次证明皮蛋蛋白水溶性提取物在体内和体外均有一定抗肠道炎症作用。 已有多种蛋源性肽被证实具有一定抗炎活性, 如从鸡蛋卵转铁蛋白酶解物中分离出的三肽IRW 和IQW 能够有效地降低促炎细胞因子的释放、调节NF-κB 炎症信号通路中相关基因表达[27];Shi 等[28]研究发现鸡蛋膜蛋白酶解物可在肠道细胞炎症模型中通过抑制NF-κB 的激活,下调促炎细胞因子和上调抗炎细胞因子,减少促炎细胞因子的分泌,起到抗炎作用;卵黄高磷蛋白肽PPPs 在TNF-α/LPS 诱导的HT-29/Caco-2/RAW 264.7 等细胞炎症反应模型中均能显著抑制一些主要促炎症因子的基因表达, 从而起到抗炎症作用[20]。 因此,我们推测肽可能是皮蛋蛋白水溶性提取物具有抗炎作用的主要物质基础, 我们运用超滤技术获得了皮蛋蛋白水溶性提取物、仿生酶解产物≤5ku 的肽段, 并通过细胞炎症模型证实其具有较好的抗炎作用。

图6 皮蛋蛋白水提物对结肠组织促炎和抑炎细胞因子基因表达的影响Fig.6 Effects of water extract of preserved egg white on gene expression of pro-inflammatory and anti-inflammatory cytokines in colon
由巨噬细胞和单核细胞产生的促炎细胞因子TNF-α 在急性炎症反应和介导其它促炎细胞因子的分泌中起着重要的作用。本研究中发现5 和10 mg/mL 的皮蛋蛋白水溶性提取物均可以降低TNF-α 诱导的Caco-2 细胞炎症反应模型中促炎细胞因子IL-8 的分泌量,同时可下调促炎细胞因子IL-8、TNF-α、IL-6 和IL-1β 基因的表达, 说明皮蛋水溶性提取物在炎症的早期具有一定干预作用。 在TNF-α 诱导的Caco-2 细胞炎症反应模型中,IL-8 促炎细胞因子基因表达的下调与NF-κB炎症通路受到抑制有关, 此机制与小鼠体内抗炎作用类似[29]。 因此,我们进一步研究了皮蛋水溶性提取物对DSS 诱导的小鼠结肠炎的抗炎作用。DSS 的摄入可导致小鼠体重下降、 肠上皮细胞炎症反应、黏膜溃疡、嗜中性粒细胞浸润、结肠缩短、腹泻、便血等溃疡性结肠炎症状。 但是,我们发现在本试验的浓度条件下, 皮蛋水溶性提取物均能减缓DSS 诱导的各种结肠炎临床症状[21-22],并能抑制促炎细胞因子的分泌和基因的表达。 皮蛋水溶性提取物减缓结肠炎的临床症状作用与大豆肽、蛋源性肽和蛋白质等较为类似[10,28,30],但对细胞因子的抑制作用有一定差别, 提示各种活性组分的抑制结肠炎的通路可能不一样。
细胞因子在IBD 的发生和发展中发挥着至关重要的作用[7]。 细胞因子可以激活巨噬细胞、中性粒细胞和T 细胞, 导致免疫特异表达反应和慢性炎症[31]。 在DSS 诱导的小鼠结肠模型和IBD 患者中,TNF-α、IL-6、IL-1β、IFN-γ、MCP-1 等促炎细胞因子基因的表达均有所上调[8,18]。TNF-α 和IL-6是参与黏膜炎症发展的关键细胞因子, 包括激活IBD 患者的巨噬细胞、 中性粒细胞和T 细胞[32]。IFN-γ 参与肠道炎症的持续, 从而增加炎性肠病的严重程度[33]。 IL-1β 由ROS 激活的巨噬细胞产生,在IBD 发病中起着关键作用[34]。MCP-1 在IBD慢性炎症中参与免疫细胞从血液中到黏膜和黏膜下层的渗透[35]。 IL-17A 是由T 淋巴细胞中Th17所产生,Th17 细胞与其分泌的细胞因子的增加和IBD 的严重程度有关[36]。 各细胞因子之间相互影响,IL-1β 和IL-6 涉及Th17 细胞的诱导分化,进而加速IL-17A 的分泌与中性粒细胞浸润[37]。 本研究表明, 皮蛋蛋白水提物可显著下调DSS 诱导的结肠炎组织TNF-α、IL-6、IL-1β、IFN-γ、MCP-1等促炎细胞因子基因的表达, 说明皮蛋蛋白水提物可通过抑制促炎细胞因子的表达对DSS 诱导的结肠炎小鼠模型中发挥抗炎作用。
总之, 本研究表明皮蛋蛋白水提物可抑制肠道细胞或组织促炎细胞因子的产生, 并可通过下调促炎细胞因子的表达减缓DSS 诱导的小鼠结肠炎炎症程度。 下一步研究的重点将是快速筛选得到皮蛋蛋白水提物中的单体抗肠炎肽, 并从体内外阐明其分子作用机制。 肠道慢性炎症严重影响人体健康,而传统治疗炎症药物均有一定副作用,皮蛋蛋白源性抗炎肽有望为机体炎性反应提供新的抗炎策略。

