乳杆菌胞外多糖抗氧化活性研究
刘煜珺 张雨晴 高 原,2 李唤宇 牟光庆 妥彦峰*
(1 大连工业大学食品学院 辽宁大连116034 2 大连市益生菌功能特性研究重点实验室 辽宁大连116034)
自由基是含有单独的没有配对电子的分子或分子碎片[1]。 当自由基夺取机体细胞大分子、电子时,会导致蛋白质、细胞、DNA、RNA 等结构受损。由于疾病、感染、辐射等不利环境造成机体本身防御体系不能发挥有效的清除活性氧作用, 或有外源性自由基入侵导致活性氧水平超出正常范围,便会出现活性氧损伤。
在稳定的条件下机体会有特定的防御和清除系统,包括抗氧化酶系统和非抗氧化酶系统,抗氧化物酶可与由氧化应激引起的自由基发生反应,从而阻止细胞的损伤, 常见的防御抗氧化酶系包括:超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)等[2-3]。
一些乳酸菌胞外多糖(LAB EPS)具有清除自由基、抗氧化等重要的生理功能[4]。BJ Seo 等[7]发现植物乳杆菌YML009 胞外多糖中部分纯化的EPS(5~40mg/mL)具有清除DPPH 自由基的抗氧化功效,DPPH 自由基清除率达到44.73%,且清除率越大,抗氧化能力越强。Xin Wang 等[5]报道随着植物乳杆菌KX041(L. plantarum KX041)的EPS 作用浓度增加,对ABTS 自由基的清除率也随之增高。李景艳[6]通过DPPH 自由基、羟自由基、超氧阴离子清除能力从15 株乳酸菌中筛选出一株产高抗氧化活性胞外多糖的菌株植物乳杆菌LP6, 该菌株胞外多糖可以提高H2O2氧化损伤PC12 细胞的存活率。
本试验中从8 株乳杆菌所产胞外多糖中筛选出具有较高抗氧化活性的胞外多糖, 评价其对ABAP 损伤的人结肠癌腺细胞系HT-29 细胞存活及抗氧化酶系表达的影响, 旨在探究乳杆菌胞外多糖抗氧化的机理。
1 试验方法
1.1 试验试剂
RPMI-1640 培养液、青霉素和链霉素,美国Gibco 公司;水溶性维生素E(Trolox)、荧光素钠(Fluorescein sodium,FL)、2,2-偶氮二(2-甲基丙基咪)二盐酸盐(2,2′-Azobis(2-amidinopropane)dihydrochloride,ABAP)、TPTZ(2,4,6-tripyridyl-striazine)、ABTS(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid))、邻二氮菲,均购自于美国Sigma 公司;硫酸亚铁,天津市大茂试剂厂;单糖标准品, 购于大连美仑生物技术有限公司;β-actin抗体、SOD1 抗体、CAT 抗体, 均购于上海碧云天生物技术有限公司; 辣根过氧化物酶标记山羊抗鼠IgG(HRP)、辣根过氧化物酶标记山羊抗兔IgG(HRP)、谷胱甘肽过氧化物酶试剂盒,均购于南京建成生物工程研究所。
1.2 菌株及细胞来源
组织细胞: 本试验所用人结肠癌腺细胞HT-29,购自中国科学院上海典藏细胞库。
试验菌株:本试验所采用的菌株干酪乳杆菌-Y3 (Lactobacillus casei-Y3), 干酪乳杆菌-Y4(L.casei-Y4),干酪乳杆菌-Y16(L.casei-Y16),植物乳杆菌-Y41(Lactobacillus planterum-Y41),植物乳杆菌-Y42(L.planterum-Y42),植物乳杆菌-Y44(L.planterum-Y44), 干酪乳杆菌-Y (L.casei-Y35)为大连工业大学大连市益生菌功能研究重点实验室所保藏菌株,分离自大连传统晾晒鱼制品。
1.3 多糖含量及蛋白浓度的测定
胞外多糖的提取: 乳杆菌胞外多糖的提取参照Di 等[7]方法稍加修改测定,主要包括菌体扩大培养、除菌、浓缩、除蛋白、乙醇沉淀、透析和冻干7 个步骤。
利用苯酚硫酸法测定多糖的含量, 称取冻干的8 株菌株的胞外多糖1 mg 溶于1 mL 超纯水,具体按照参考文献[8]的方法稍加修改进行操作。
采用考马斯亮蓝方法测定蛋白含量,将1 mg/mL 的多糖溶液稀释10 倍,以1∶5(V/V)体积加入考马斯亮蓝溶液,具体按照Wang 等[9]的方法稍加修改进行操作。
1.4 胞外多糖体外抗氧化能力测定方法
1.4.1 DPPH 自由基清除能力测定 将8 株菌所产胞外多糖质量浓度配制成为0.5 mg/mL 溶液,DPPH 自由基清除能力的测定具体按照Zhang 等[10]的方法稍加修改进行操作,DPPH 自由基清除率按照如下公式进行计算:

式中:Ai——1 mL DPPH-无水乙醇+1 mL 多糖溶液吸光度;Aj——1 mL 超纯水+1 mL 多糖溶液吸光度;Ac——1 mL DPPH-无水乙醇+1 mL 超纯水吸光度。
1.4.2 ABTS 自由基清除能力测定 8 株菌所产胞外多糖的ABTS 自由基清除能力的测定方法参考Li 等[11]的方法稍加修改进行操作。 首先将上述冻干粗多糖配制成质量浓度为1 mg/mL 的多糖溶液,之后配制ABTS 溶液:将ABTS 和过硫酸钾分别配制成7 mmol/L 和2.45 mmol/L 的水溶液,按1∶1 体积比混合均匀后避光静置16 h。 在测定之前, 将ABTS 自由基溶液用pH 7.4 的0.2 mol/L PBS 稀释,测定波长为734 nm,使得最后的吸光值为0.70±0.02。 将0.4 mL 的多糖溶液加入到3 mL稀释后的ABTS 溶液中,摇晃1 min 混合均匀使反应完全,黑暗中静置6 min。在波长为734 nm 处最终溶液吸光度。 空白组: 等体积的超纯水代替样品。 计算ABTS 清除能力的公式如下:

式中:As——含有样品组的吸光度;Ac——只含ABTS+溶液的空白吸光度。
1.4.3 羟自由基清除能力的测定 采用Li 等[12]报道的Fenton 方法,稍加修改测定8 株菌所产胞外多糖羟自由基清除能力。 称量干燥器中的8 种乳杆菌胞外粗多糖,配制成4 mg/mL 的多糖溶液。样品组:1 mL 0.02 mol/L PBS (pH 7.4)溶液依次加入0.5 mL 2.5 mmol/L 邻二氮菲溶液、0.5 mL 2.5 mmol/L FeSO4溶液和0.5 mL 20 mmol/L H2O2溶液,充分混匀后再加入0.5 mL 样品,作为样品组As;用0.5 mL 蒸馏水取代0.5 mL 样品,作为对照组Ac;1 mL 蒸馏水取代样品和H2O2, 作为空白组Ab。 37 ℃恒温水浴1 h,于536 nm 处测定吸光值。使用以下公式计算羟自由基清除率:

式中:As——含有样品和H2O2组的吸光值;Ac——不含样品但含H2O2的吸光值;Ab——不含有样品和H2O2组的吸光值。
1.4.4 铁离子还原力(FRAP)的测定 根据Benzie 和Strain 的方法[13]稍作修改,进行对8 株菌所产胞外多糖铁离子还原能力的测定。首先是FRAP溶液的配制: 将pH 3.6 的0.3 mol/L 乙酸缓冲液100 mL、10 mmol/L TPTZ 溶液10 mL(含40 mmol/L HCl)以及20 mmol/L FeCl3·6H2O 10 mL 溶液混合,配制成FRAP 溶液,现用现配。 将8 种乳杆菌EPS 配制成5 mg/mL 的多糖溶液,取150 μL 多糖溶液加入到3 mL FRAP 溶液中, 室温静置6 min后在593 nm 处测定其吸光值。
标准曲线的绘制: 配制浓度梯度为20,50,100,200,400,600,800 和1 000 μmol/mL 的Trolox溶液作为标准曲线的横坐标,吸光值为纵坐标。经换算试验结果以Trolox 当量 (μmol Trolox/mg)表示。
1.4.5 氧自由基吸收能力 (ORAC)测定 根据Huang 等[14]所述ORAC 方法稍加修改测定对8 株菌所产胞外多糖的ORAC 值,ORAC 计算公式为[15]:

式中:f0--初始荧光强度;fn——第n 个测定点的相对荧光强度;△t——相邻两个检点之间的时间间隔(4.5 min)。
对照组:40 μL PBS+200 μL FL
空白组:20 μL PBS+20 μL ABAP+200 μL FL
试验组:20 μL PBS+20 μL 样品+200 μL FL
以Trolox 的浓度为横坐标, 配制浓度梯度为6.25,12.5,25,37.5,50,62.5 μmol/L 的Trolox 溶液, 以其相对ORAC 值为纵坐标。 该测定在黑壁96 孔微孔板的内孔中进行。 经换算,试验结果以Trolox 当量(μmol Trolox/mg)表示。
1.4.6 细胞的培养 人结肠癌腺细胞HT-29 细胞培养方法参照Zhang[10],并稍有改动。
1)培养基: 改良型RPMI-1640 培养基:含20%FBS 和1%双抗。
2)细胞培养:HT-29 细胞加入RPMI-1640培养液,在CO2培养箱于37 ℃培养,每隔24 h 换培养液一次;当HT-29 细胞单层覆盖细胞培养瓶80%~90%, 即用培养基体积的0.25%胰蛋白酶-EDTA 消化并吹打均匀,离心(3 000 r/min,2 min),吸出上清培养液, 加入适当培养液, 继续分瓶培养。
1.4.7 亚甲蓝检测细胞存活率 首先将生长到对数期的HT-29 细胞消化后接种于无菌96 孔板当中,细胞浓度为4×104cells/mL,每孔加入100 μL。培养24 h 后显微镜下观察细胞生长良好,即可进行下一步试验。
取冻干粗多糖,用无胎牛血清RPMI-1640 培养液配制成0.1,0.25,0.50,1.00,2.00,4.00 mg/mL的粗多糖溶液。 将培养好细胞的96 孔板取出,吸取原液, 用10 mmol/L pH 7.4 的无菌PBS 清洗2次,在每孔中依次加入100 μL 样品,对照组加入100 μL 无血清培养液,培养24 h 后,用10 mmol/L pH 7.4 的无菌PBS 清洗2 次,采用亚甲蓝染色法测定HT-29 细胞存活率。
亚甲蓝染色法参照Wolfe[16],稍加修改进行测定,计算存活率公式为:
存活率/%=样品组吸光值/对照组吸光值×100
1.4.8 ABAP 半致死浓度确定 首先将生长到对数期的细胞消化后接种于无菌96 孔板当中,细胞浓度为2×104cells/孔,每孔100 μL,将上述96 孔板放入CO2培养箱中培养24 h。
将培养好细胞的96 孔板取出, 无菌PBS(pH 7.4)清洗2 次,向每孔中加入无胎牛血清RPMI-1640 培养基和ABAP 溶液, 使ABAP 终浓度为70,80,90,100,110,120,130,140 及150 mmol/L,未加入ABAP 组作为对照组, 置于CO2培养箱中培养2 h 后, 采用亚甲蓝染色法测定HT-29 细胞存活率。
1.4.9 胞外多糖对ABAP 氧化损伤HT-29 细胞的保护作用 首先将生长到对数期的细胞消化后接种于无菌96 孔板当中,细胞浓度为2×104cells/孔,每孔100 μL,将上述96 孔板放入CO2培养箱中培养24 h。
将培养好细胞的96 孔板取出, 无菌PBS(pH 7.4)清洗2 次,取8 株菌的冻干粗多糖,用无胎牛血清RPMI-1640 培养液配制成质量浓度为0.50 mg/mL 的多糖溶液加入到各孔中, 置于CO2培养箱中24 h 后,用10 mmol/L pH 7.4 的无菌PBS 清洗2 次,去除多糖溶液,再将ABAP 调至半致死浓度后加入各孔, 加入ABAP 未加入多糖溶液的为对照组, 无ABAP 和多糖溶液的为空白组, 置于CO2培养箱中培养2 h 后,采用亚甲蓝染色法测定HT-29 细胞存活率。
1.5 HT-29 细胞内抗氧化酶的表达及活性测定
1.5.1 不同浓度Y42 菌株胞外多糖对氧化损伤HT-29 细胞的保护作用 用无胎牛血清RPMI-1640 培养液配制成质量浓度为500,250,100,50 μg/mL 的胞外多糖溶液, 其它具体操作步骤同1.4.9节。
1.5.2 HT-29 细胞过氧化氢酶(CAT)表达量测定
本试验采用蛋白免疫印迹法(Western Blot)[17]对Y42 的胞外多糖作用的HT-29 细胞进行CAT 表达量的测定,具体步骤如下:
1)细胞培养:细胞培养方法同1.4.6 节。
2)蛋白质提取: 当HT-29 细胞长至80%~90%的程度时进行消化, 接种3 mL 于直径为60 mm 的无菌培养皿中,培养2~3 d,空白组和氧化组都加入3 mL 无血清RPMI-1640, 试验组加入500 μg/mL 和50 μg/mL EPS 溶液, 继续培养18h后,吸去培养液,用无菌PBS 润洗两次,空白组加入RPMI-1640, 氧化组和样品组加入70 mmol/L ABAP 溶液,避光培养2 h 后,PBS 洗3 次,再用细胞刮将细胞刮掉, 将含有细胞的PBS 溶液用移液枪转移到EP 管中并迅速放入冰块中后, 离心(4℃,5 min,11 000 r/min)得到沉淀。 向2 mL 离心管中加入200 μL 左右的裂解液。 吹匀后,迅速放入冰水中进行超声破碎(200 W,3 s/次,20 min)使细胞裂解完全, 然后离心 (4 ℃,15 000 r/min,10 min),取上清液作为待测样品迅速放置在-80 ℃冰箱中备用。
3)根据BCA 蛋白浓度测定试剂盒的说明测定蛋白浓度, 再采用蛋白质免疫印迹法(Western Blot)对Y42 的EPS 作用的HT-29 细胞进行CAT表达量的测定。
1.5.3 HT-29 细胞中超氧化物歧化酶(SOD)表达量测定 测定Y42 的胞外多糖作用后HT-29 细胞内SOD 相对表达量,方法同1.5.2 节。
1.5.4 HT-29 细胞中谷胱甘肽过氧化物酶(GSHPx)活性测定 对Y42 的胞外多糖作用的HT-29细胞进行GSH-Px 活性的测定。 当HT-29 细胞长至80%~90%的程度时进行消化, 接种3 mL 于直径为60 mm 的无菌培养皿中, 当细胞完全用贴壁且生长状态良好时,用无血清RPMI-1640 润洗两次后,空白组和氧化组都加入3 mL 无血清RPMI-1640,试验组加入500 μg/mL 和50 μg/mL 胞外多糖溶液,继续培养18 h 后,吸去培养液,用无菌PBS 润洗两次,空白组加入RPMI-1640,氧化组和样品组加入70 mmol/L ABAP 溶液, 避光培养2 h,将含有细胞的PBS 溶液用移液枪转移到EP 管中并迅速放入冰块中,离心(4 ℃,5 min,11 000 r/min)得到沉淀。 加入1 mL pH 7.4 的PBS 形成细胞悬液,超声破碎(300 W,3 s/次,3~5 个间隔),得到细胞悬液作为待测样备用。 根据南京建成生物工程研究所提供的谷胱甘肽过氧化物酶检测试剂盒, 进行被处理HT-29 细胞GSH-Px 活性的测定。
1.6 Y42 胞外多糖的分离纯化及结构的测定
1.6.1 Y42 胞外多糖DEAE-Sepharose Fast Flow离子柱纯化 将10 mL 的10 mg/mL 的粗多糖溶液进行纯化。 纯化前检查柱子的气泡情况或者是否有断层,若有则需要重新填装柱子。检查柱子正常后用超纯水冲洗SepHarose Fast Flow 离子柱,对柱子进行平衡,流速2 mL/min,压力为0.4,平衡约2 个柱体积后开始上样, 上样之前为了去除杂质, 样品溶液要过0.45 μm 的滤膜后离子柱进行纯化,流动相为超纯水,流速2 mL/min,15 mL 的试管每管收集5 mL。 收集48 管后,换流动相为0.5 mol/L 的NaCl 溶液,使用蛋白纯化仪进行梯度洗脱,流速压力不变,每管收集5 mL。 收集完毕后,采用苯酚硫酸法检测每管是否含有多糖,作出洗脱曲线图,根据洗脱曲线将单一峰收集起来,透析48 h 后冷冻干燥。
1.6.2 单糖组成分析
1)样品的水解: 称取5 mg Y42 胞外粗多糖放入带有盖子的试管中, 加入2 mL 2 mol/L TFA后,120 ℃的烘箱中水解4 h,旋蒸,待有固体挂在蒸馏瓶壁上时加入1 mL 甲醇继续旋蒸, 反复3次,彻底除掉TFA 当瓶壁几乎没有液体且瓶底为可见固体时即为蒸发完毕。
2)多糖的PMP 衍生化:粗糖水解后,向含有水解产物的蒸馏瓶中加入1 mL 超纯水, 配成5 mg/mL 的多糖溶液,取200 μL 该多糖溶液于离心管中加入0.6 mol/L NaOH, 再取200 μL 混合液,200 μL 0.5 mol/L PMP 甲醇溶液1∶1(V/V)混合均匀,70 ℃水浴70 min。
水浴结束后冷却至室温, 向离心管中加入200 μL 0.3 mol/L HCL 中和反应液,50 ℃旋蒸至瓶底出现固体且壁上没有液体,向瓶中加入2 mL超纯水,吸出加入2 mL 氯仿,摇匀,静置5 min,吸出下层水相,重复3 次萃取,用0.45 μm 微孔滤膜过滤最后萃后的溶液,备用于HPLC 分析。

表1 高效液相色谱条件Table 1 High performance liquid chromatography conditions
1.6.3 高效液相色谱条件 本试验高效液相色谱条件如表2~表7 所示:
1.6.4 红外光谱分析 采用KBr 压片法, 称取2 mg 左右冻干的Y42 胞外多糖样品与KBr 混合,沿着一个方向研磨至细粉末后用压片机压片, 红外扫描频率范围在4 000 cm-1~400 cm-1。
1.7 统计分析
所有试验均进行3 次重复试验, 数据采用SPSS 20.0 软件进行统计和单因素方差分析(ANOVE,LSD)。 所有数据均表示为平均值±标准差,P<0.05 表示差异显著。
2 试验结果
2.1 乳杆菌菌株粗多糖的糖含量及蛋白含量
在乳杆菌胞外多糖的糖含量的测定中, 葡萄糖标准曲线回归方程为Y=0.7422X-0.003,R2=0.9954,8 株菌株胞外多糖的糖含量如表2 所示。8株菌株胞外多糖浓度各不相同,但培养、发酵和提取条件都一致, 这可能与菌株的自身产胞外多糖的能力有关。
本试验采用TCA 的方法进行除蛋白,通过考马斯亮蓝法测定了8 株菌株胞外多糖的蛋白浓度。在乳杆菌胞外多糖的蛋白浓度测定中,蛋白的标准曲线回归方程为Y=4.0515X+0.0157,R2=0.9950。 各菌株所产胞外多糖中蛋白含量如表2所示,蛋白含量均少于0.03 mg/mL。
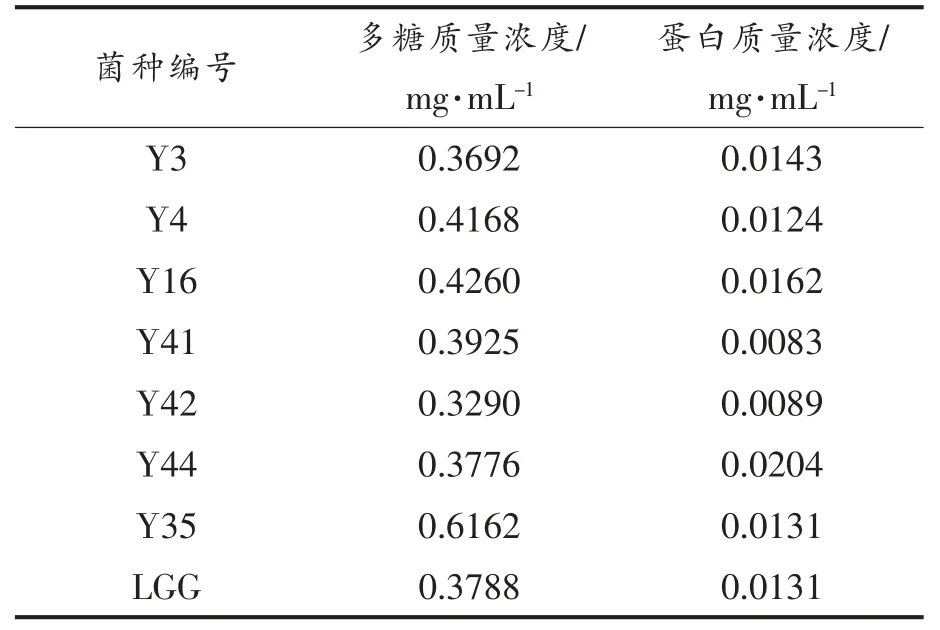
表2 8 株乳酸杆菌胞外多糖浓度和蛋白浓度Table 2 EPS concentration and protein concentration of 8 strains of Lactobacillus
2.2 体外抗氧化能力评价结果
2.2.1 DPPH·清除能力测定结果 由图1 可以看出,当8 株菌的胞外多糖质量浓度均为0.5 mg/mL时,8 株乳杆菌胞外多糖对DPPH 自由基清除能力存在显著差异(P<0.05),DPPH 自由基清除率最高的是植物乳杆菌Y3 产的胞外多糖,清除率达到了22.81%±1.89%, 显著高于LGG 菌株胞外多糖的DPPH 自由基清除率(17.76%±2.26%)(P<0.05),总体来看,Y3、Y4、Y42、Y44 菌株胞外多糖对DPPH 自由基的清除能力显著高于LGG 胞外多糖的DPPH 自由基清除能力。
2.2.2 ABTS 自由基清除能力测定结果 由图2可以看出,当多糖质量浓度为1 mg/mL 时,8 株乳杆菌胞外多糖的ABTS 自由基清除能力存在差异,清除范围在(26.84%±3.70%)~(39.13%±1.74%)。 其中LGG、Y3、Y42 胞外多糖的ABTS 自由基清除率差异不显著,但均显著高于(P<0.05)其他5 株菌株胞外多糖ABTS 自由基清除能力;而Y35 胞外多糖清除率为26.84%±3.70%,显著低于除Y3 以外其他受试菌株胞外多糖清除率。
2.2.3 羟自由基清除能力的测定结果 由图3 可知,当多糖质量浓度为4 mg/mL 时,8 株菌株胞外多糖羟自由基清除能力存在差异, 清除范围为(53.17%±2.21%)~(45.28%±5.14%)。 其中Y44 菌株胞外多糖羟自由基清除率为53.17%±2.21%,显著高于(P<0.05)Y41、Y42 菌株胞外多糖的羟自由基清除能力,同LGG 胞外多糖清除率没有显著差异(P>0.05)。 其中Y41 胞外多糖羟自由基清除率为45.28%,显著低于(P<0.05)LGG 胞外多糖羟自由基清除率。
2.2.4 FRAP 试验结果 在本试验中,以Trolox 浓度为横坐标,FRAP 值为纵坐标,制作回归方程Y=0.0017X+0.0102,R2=0.997。由图4 可以看出,当多糖质量浓度为5 mg/mL 时,8 株菌株胞外多糖的铁离子还原力存在差异,Y4 菌株胞外多糖FRAP值为(38.90±1.63)μmol Trolox/mg,显著高于(P<0.05)LGG 菌株胞外多糖铁离子还原力。 Y44 FRAP 值为(12.44±2.83)μmol Trolox/mg,显著低于(P<0.05)其余7 株菌胞外多糖FRAP 值。

图1 8 株乳酸杆菌胞外多糖DPPH 自由基清除能力Fig.1 Scavenging DPPH radicals activity of EPS from 8 strains Lactobacillus

图2 8 株乳酸杆菌胞外多糖ABTS 自由基清除率Fig.2 Scavenging ABTS free radicals activity of EPS from 8 strains Lactobacillus

图3 8 株乳酸杆菌胞外多糖羟由基清除率Fig.3 Scavenging hydroxyl free radicals activity of EPS from 8 strains Lactobacillus
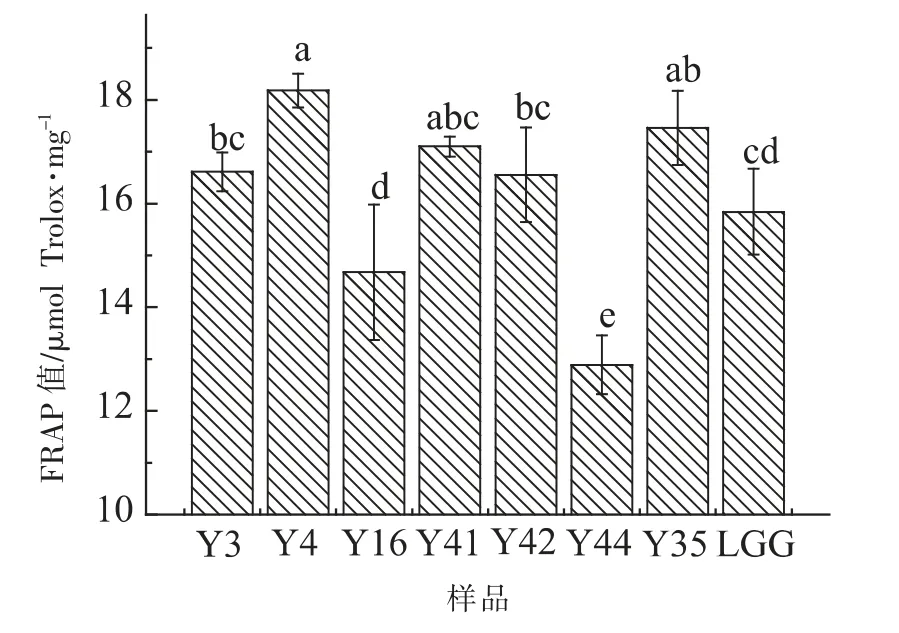
图4 8 株乳酸杆菌胞外多糖铁离子还原能力测定Fig.4 The Fe3+ reduction ability determination of EPS from 8 strains Lactobacillus
2.2.5 ORAC 抗氧化试验结果 ORAC 试验被广泛应用于分析测量物质的总抗氧化能力。 在本试验中,以Trolox 为标准品,得到ORAC 试验标准曲线,回归方程为Y=0.4448X+1.0488,R2=0.980。8 株乳杆菌株胞外多糖的ORAC 值见图5 所示,8 株菌株胞外多糖相对ORAC 值存在差异, 其中菌株Y42 和Y4 胞外多糖ORAC 值显著高于 (P<0.05)其它菌株胞外多糖的ORAC 值(P<0.05)。
2.2.6 ABAP 半致死浓度确定 进行细胞试验首先要保证胞外多糖样品对细胞无毒性, 经检验8株菌株胞外多糖对HT-29 细胞均无毒性。 ABAP是一种常用的促进产生活性氧的诱导剂, 因此本次试验选择ABAP 作为HT-29 细胞氧化损伤模型的氧化剂。 由图6 可知, 当ABAP 浓度范围在20~110 mmol/L 之间上升时,HT-29 细胞存活率逐渐下降,当ABAP 浓度为70 mmol/L 时,HT-29 细胞存活率为53.87%,接近50%,因此细胞抗氧化试验中,ABAP 半致死浓度确定为70 mmol/L。
2.2.7 EPS 对ABAP 氧化损伤HT-29 细胞的保护作用 当ABAP 浓度为70 mmol/L 时,经过8 株菌株胞外多糖处理的HT-29 细胞的存活率与未经多糖处理的对照组相比显著提高(P<0.05),表现出对HT-29 细胞的保护作用,如图7 所示。8 株菌株胞外多糖均有抑制ABAP 氧化损伤HT-29 细胞的作用,其中Y42、Y41 和Y44 菌株胞外多糖对HT-29 细胞的保护作用显著高于其它菌株胞外多糖的保护作用。

图5 8 株乳酸杆菌EPS 相对ORAC 值Fig.5 The value of ORAC of EPS from 8 strains Lactobacillus
2.3 乳杆菌菌株胞外多糖体外抗氧化活性主成分分析
本试验选择主成分分析法综合评价菌株体外抗氧化活性。 参考王鹏等[18]的研究方法依据SPSS20.0 软件中的主成分分析方法,通过对所选取的6 个抗氧化试验指标进行主成分分析, 从而可以在这些指标中间选用几个重要且相对独立的综合指标来进行产高抗氧化性多糖菌株的筛选。各指标及数据见表3。
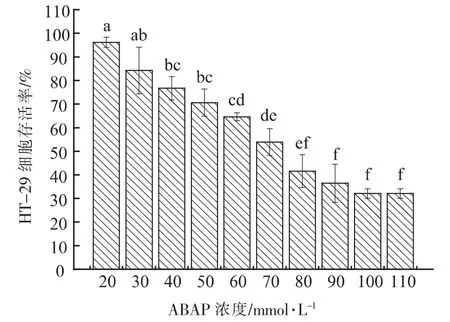
图6 不同ABAP 浓度HT-29 细胞存活率Fig.6 Different ABAP concentrations of HT-29 cell survival rate
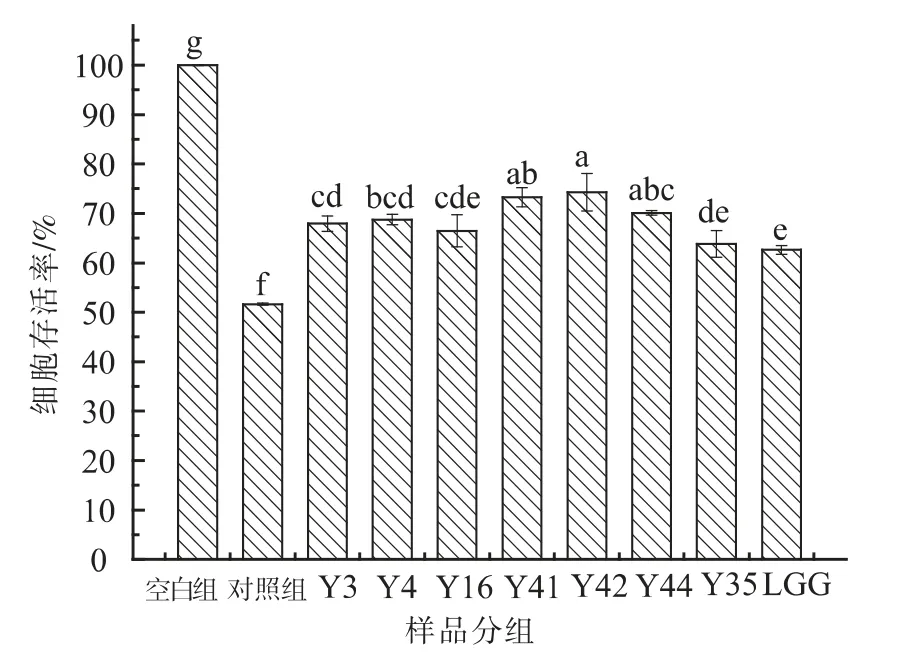
图7 8 株乳杆菌胞外多糖作用下氧化损伤HT-29 细胞存活率Fig.7 Survival rate of oxidative loss of HT-29 cells by EPS from 8 strains Lactobacillus

表3 8 株菌株胞外多糖抗氧化原始指标及数据Table 3 Antioxidant raw indicators and data of EPS from 8 strains Lactobacillus
因为每个指标单位不同, 需要标准化表3 中数据。根据各指标特征值的特征向量、标准化数据以及综合得分计算公式可以计算8 株菌株胞外多糖抗氧化性的综合得分并排名,综合得分越高,说明该菌株胞外多糖具有更高的抗氧化性。 综合得分及排名如表4。 由表4 可知,8 株菌株的胞外多糖的抗氧化性综合得分排名顺序依次为Y42、Y4、Y3、Y41、Y44、Y35、Y16、LGG,其中Y42 排名第一位, 说明Y42 产生的胞外多糖具有最强的抗氧化活性。

表4 8 株菌株胞外多糖抗氧化性综合得分及排名Table 4 Antioxidant comprehensive score and ranking of EPS from 8 strains Lactobacillus
2.4 HT-29 细胞内抗氧化酶的表达及活性测定
2.4.1 不同浓度Y42 菌株胞外多糖对氧化损伤HT-29 细胞的保护作用 如图8 所示, 当ABAP浓度为70 mmol/L 时, 经过不同浓度Y42 菌株胞外多糖处理的HT-29 细胞的存活率与未经多糖处理的对照组相比显著提高 (P<0.05), 表现出Y42 菌株胞外多糖对HT-29 细胞的保护作用。 随着胞外多糖浓度的不断降低,HT-29 细胞的存活率也逐渐降低。 胞外多糖作用质量浓度为500 μg/mL,HT-29 细胞存活率为77.01%±5.01%,胞外多糖作用质量浓度为50 μg/mL EPS 的试验组细胞存活率最低(63.81%±2.00%)。 为了对比不同浓度的Y42 菌株胞外多糖的抗氧化效果, 选择胞外多糖作用质量浓度为500 μg/mL 和50 μg/mL 作为后续试验的作用浓度。
2.4.2 HT-29 细胞过氧化氢酶(CAT)活性 Y42菌株EPS 作用于HT-29 后产生的CAT 相对表达量如图9 所示,通过与空白组相比,CAT 相对表达量由小到大依次为氧化组<50 μg/mL EPS<500 μg/mL EPS, 其中500 μg/mL EPS 作用的HT-29细胞中CAT 的表达量与其它两组具有显著差异(P<0.05),达到145.01%±3.98%,说明胞外多糖作用浓度越高,细胞中的CAT 表达量越高,并且高于空白组约45%。

图8 不同浓度菌株Y42 胞外多糖作用下氧化损伤的HT-29 细胞存活率Fig.8 Survival rate of oxidative loss of HT-29 cells by EPS from different concentrations of Y42 strain

图9 菌株Y42 胞外多糖作用HT-29 细胞后CAT 相对表达量Fig.9 CAT relative expression of Y42 EPS in HT-29 cells
2.4.3 HT-29 细胞超氧化物歧化酶 (SOD)活性Y42 菌株胞外多糖作用于HT-29 后产生的SOD相对表达量如图10 所示: 通过与空白组相比,SOD 相对表达量由小到大依次为氧化组<50 μg/mL EPS<500 μg/mL EPS, 加入多糖作用的两组SOD 相对表达量分别为206.80%±10.66%和194.45%±34.3%, 均显著高于氧化组SOD 表达量(P<0.05), 说明Y42 菌株胞外多糖上调了HT-29细胞内SOD 的表达。
2.4.4 HT-29 细胞GSH-Px 酶活 不同浓度Y42菌株胞外多糖作用于HT-29 后产生的GSH-Px的活性如图11 所示:GSH-Px 的活性由小到大依次为氧化组<空白组<ABAP+50<ABAP+500,经过ABAP 刺激后的氧化组酶活明显下降(P<0.05);当多糖质量浓度为500 μg/mL 时,GSH-Px 活性分别为(116.23±8.92)U/mgprot,显著高于(P<0.05)多糖浓度为50 μg/mL 时GSH-Px 活性(81.36±2.00)U/mgprot,并且500 μg/mL 的多糖作用后GSH-Px 酶活性显著高于空白组 (67.27±12.53)(P<0.05),酶活增强了42.20%。
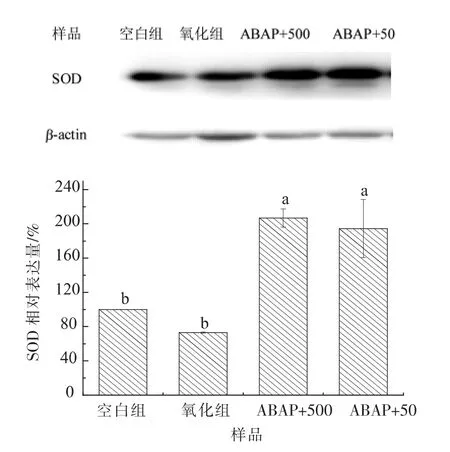
图10 菌株Y42 胞外多糖作用HT-29 细胞后SOD 相对表达量Fig.10 SOD relative expression of Y42 EPS in HT-29 cells

图11 菌株Y42 胞外多糖作用HT-29 细胞后GSH-Px 酶活性Fig.11 GSH-Px enzyme activity in HT-29 cells treated with Y42 EPS
2.5 Y42 胞外多糖的分离纯化及结构的测定
2.5.1 Y42 胞外多糖DEAE-Sepharose Fast Flow离子柱纯化 虽然在提取多糖的过程中已经采用TCA 方法将蛋白除去, 乙醇沉淀将部分杂质除去得到粗多糖, 但粗多糖通常由不同电荷的胞外多糖组分组成, 因此采用柱层板进行进一步的分离纯化。 Y42 胞外多糖DEAE-Sepharose Fast Flow离子柱纯化结果如图12 所示, 分离出两个组分EPS 42-1 和EPS 42-2。 在48 号管之前采用的流动相为超纯水,洗脱出来的糖为中性多糖[24],说明EPS42-1 组分为中性多糖。 48 管之后流动相为NaCl, 浓度为1 mol/L, 洗脱出来的糖为酸性多糖[19],说明组分EPS 42-2 为酸性多糖。
2.5.2 单糖组成分析 将单糖标准品和Y42 胞外多糖分别衍生化后,得到了如图13、图14 的色谱图。并获得单糖标准品浓度与峰面积的标准曲线,如表5 所示。
将Y42 菌株EPS 水解物衍生化后的高效液相色谱图(图14)与标准图谱(图13)比较,确定Y42 菌株胞外多糖主要由5 种单糖组成, 结合各标准糖的峰面积,采用外标法计算出菌株Y42 胞外多糖中各单糖的物质的量比及含量, 如表6 所示,其中甘露糖含量最多,葡萄糖醛酸含量最少。

图12 菌株Y42 胞外多糖DEAE-Sepharose Fast Flow 洗脱层析Fig.12 Chromatography of eluted of Y42 strain EPS on DEAE-Sepharose Fast Flow ion column

图13 混合标准品单糖高效液相色谱图Fig.13 HPLC chromatogram of mixed standard monosaccharides

图14 菌株Y42 胞外多糖高效液相色谱图Fig.14 HPLC chromatogram of EPS of Y42 strain
2.5.3 红外光谱分析 Y42 菌株EPS 的红外光谱如图15 所示,在3 396.94 cm-1处显示出的宽而强的吸收峰是由于羟基O-H 键的伸缩振动造成的,这说明在Y42 菌株EPS 中存在大量的羟基;在2 937.86 cm-1处所对应的位置是烷基C-H 键的伸缩振动;在1 640 cm-1~1 645 cm-1范围内的1 644.21cm-1处所对应的位置是是C-O 伸缩振动; 在1 450 ~1 200 cm-1范围内,1 407.52 cm-1和1 233.43cm-1所对应的位置是C-H 的变角振动,这种振动和C-H 的伸缩振动可以形成糖环的特征吸收;950~1 200 cm-1处所对应的位置是C-O-C和C-O-H 连接的位置[20],在814.53 cm-1处的吸收峰存在α-葡萄糖苷键[7],在350~600 cm-1处的条带属于吡喃糖环的骨架模式[21]。

表5 单糖标准品标准曲线Table 5 Standard curve of monosaccharide standard substance

表6 菌株Y42 胞外多糖中单糖含量及物质的量比Table 6 Content and molar ratio of monosaccharide in exopolysaccharide of strain Y42

图15 菌株Y42 胞外多糖红外光谱图Fig.15 FT-IR spectrum of EPS of Y42 strain
3 讨论
3.1 乳杆菌胞外多糖抗氧化活性的评价
本研究通过DPPH 自由基清除、ABTS 自由基清除、羟自由基清除、铁离子还原、氧自由基吸收及对ABAP 氧化损伤HT-29 细胞的保护试验,评价8 株乳杆菌胞外多糖抗氧化活性。 不同抗氧化试验获得的结果具有一定差异性。 采用主成分分析法综合评价不同抗氧化试验的结果, 确定菌株Y42 所产胞外多糖具有较好的抗氧化活性。
Liu 等[22]研究发现当副干酪乳杆菌胞外多糖101EP 和植物乳杆菌胞外多糖102EP 在10 mg/mL 时,DPPH 清除自由基活性分别为91.82%和81.15%。 MSR Rajoka 等[23]从人乳汁中分离得到的乳酸菌EPSs 在DPPH 试验中使用的浓度范围在0.2~4 mg/mL,当质量浓度为0.4 mg/mL 时,自由基清除率最高在30%左右。 本研究中的结果与此相似,略有偏差原因可能是菌株不同。
ABTS 自由基清除能力试验也是评价抗氧化特性常见的方法, 样品的ABTS 自由基清除值越高,代表抗氧化性越强。 Luo 等[24]采用ABTS 方法评价了纯化后的石斛茎中提取粗水溶性多糖DNP4-2 的抗氧化性,发现该多糖对ABTS 自由基清除能力良好;Ayesha 等[25]采用骆驼奶分离出的乳酸菌的EPS 制备低脂肪奶酪, 发现最终CEPS+干酪的ABTS 自由基清除率增加超过60%。Yang等[26]从山楂中提取了一种新的多糖组分(CCPP-1), 随着CCPP-1 的浓度增加,ABTS 的清除能力逐渐增强,最强达到99%,接近Vc 的ABTS 清除能力。
羟基自由基对敏感的生物分子可造成严重的损伤[27]。 Li 等[28]研究发现双歧杆菌WBIN03(BEPS)和植物乳杆菌R315(L-EPS)的胞外多糖具有一定的羟自由基清除能力。 Wang 等[29]纯化植物乳杆菌70810 胞外多糖(r-EPS1 和r-EPS2),具有一定的羟自由基清除能力。 与本试验各菌株胞外多糖也体现一定羟自由基清除能力, 说明本试验中8 株菌株的胞外多糖具有抗氧化性。
体外理化试验虽然能体现胞外多糖的抗氧化性, 但是这些抗氧化指标并不一定能准确反映细胞生理条件,也忽略了生物有效性和代谢问题。而动物试验耗时长成本高, 因此细胞抗氧化试验是一种较好的抗氧化活性评价方法, 可以体现活性氧、抗氧化剂与细胞之间的相互关系。细胞抗氧化试验反映了抗氧化物质在细胞内的吸收、 代谢和分布等方面, 比化学抗氧化方法更具有生物相关性, 能更好地预测物质在体内的抗氧化活性。Seth A[30]的试验结果表明,鼠李糖乳杆菌LGG 产生的可溶性蛋白能够通过加强Caco-2 单层细胞中紧密连接蛋白和屏障功能从而减轻过氧化氢对细胞的损伤,从而提高细胞的存活率。 Mu 等[31]的试验发现H2O2损伤的HT-29 细胞模型可以较好地评价植物乳杆菌Y44 抗氧化活性。 本试验发现不同菌株胞外多糖预处理HT-29 细胞,会不同程度保护细胞免受ABAP 损伤。
任何评估抗氧化能力的方法都与其相应的抗氧化机制密切相关。 通常很难在单一测定系统中评估其抗氧化活性, 必须使用某种分析方法对不同方法获得的数据进行综合评价[36]。 主成分分析是一种采用少量综合指标来代替原来多个指标大部分信息的一种降维的分析方法, 除去一些不相关的指标,保留重要信息,具有减少计算工作量、减少原始数据信息损失、 简化数据结构以及避免主观随意性等优点[32]。 本研究采用主成分分析方法综合分析不同菌株胞外多糖抗氧化活性, 确定菌株Y42 胞外多糖具有较强的抗氧化活性。 仍需进一步对不同化学抗氧化方法与细胞抗氧化方法的相关性展开研究, 找到几种不同方法相结合的快速有效的抗氧化研究方法。
3.2 菌株Y42 胞外多糖对HT-29 细胞抗氧化相关酶系活性的影响
本研究发现菌株Y42 胞外多糖可以上调HT-29 细胞中抗氧化酶系CAT、SOD、GSH-Px 和表达量和活性。 因此认为菌株Y42 胞外多糖可能是通过激活HT-29 细胞抗氧化酶系活性,以及清除细胞外存在的活性氧,从而保护HT-29 细胞免受ABAP 自由基的损伤。
MU 研究发现[36]植物乳杆菌 Y44 可以激活Caco-2 细胞Nrf2-Keap1-ARE 信号通路并调控抗氧化酶的表达,显著提高细胞CAT 活性(P<0.05),增强Caco-2 细胞抗氧化活性。本课题组将继续研究菌株Y42 胞外多糖对HT-29 细胞Nrf2-Keap1-ARE 信号通路及抗氧化相关蛋白表达影响,阐明胞外多糖对HT-29 细胞自身抗氧化功能的影响。
3.3 菌株Y42 EPS 结构分析
胞外多糖(EPS)是由单糖或糖衍生物的支链重复单元组成的长链多糖,其单糖组成、分子质量和分支结构决定了其功能和应用[33]。 多糖跟蛋白质类似,具有一、二、三、四级结构,且单糖组成的种类繁多、糖单体间也存在着多种连接方式,所以解析多糖类结构的难度大大超过了核酸和蛋白质等其它的生物大分子[34]。 对于产胞外多糖抗氧化性最低的菌株LGG 的胞外多糖的单糖组成,通过查阅文献发现张娟[31]通过HPLC 得到LGG 的EPS主要含有甘露糖、鼠李糖、半乳糖、核糖、半乳糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖,其中甘露糖、鼠李糖、半乳糖占主要成分;张震[33]通过水解LGG胞外多糖后采用薄层层析TLC 和HPLC 进行检测, 得到LGG 胞外多糖单糖组成为鼠李糖、N-乙酰氨基葡萄糖和半乳糖。 张娟[35]发现LGG 胞外多糖红外光谱在3 400 cm-1,2 939 cm-1和990~1 200 cm-1这些位置检测到出峰, 这些峰是多糖类物质的常见峰,分别代表O-H 键,-CH2基团中的C-H键和多糖特征峰。 本研究发现菌株Y42 胞外多糖单糖组成为甘露糖、葡萄糖醛酸、氨基葡萄糖、氨基半乳糖、半乳糖,物质的量比为11.30 ∶3.51 ∶10.64∶7.53∶7.19。 还需要对其高级结构展开研究,以确定菌株Y42 胞外多糖发挥抗氧化功能的功能基因。
4 结论
本研究通过对比分析8 株乳杆菌菌株胞外多糖的DPPH 自由基清除率、ABTS 自由基清除率、羟自由基清除率、铁离子还原力、氧自由基吸收能力及对ABAP 氧化损伤HT-29 细胞的保护作用,表明菌株Y42 胞外多糖具有较强的抗氧化活性。菌株Y42 胞外多糖对HT-29 细胞内的CAT、SOD及GSH-Px 的表达都有显著的上调作用。 菌株Y42 胞外多糖可能是通过清除活性氧、 以及促进HT-29 细胞抗氧化酶系的表达, 起到保护HT-29细胞免受ABAP 自由基损伤。 菌株Y42 胞外多糖由中性多糖和酸性多糖2 个组分构成, 其单糖组成为甘露糖、葡萄糖醛酸、氨基葡萄糖、氨基半乳糖、半乳糖,属于吡喃糖环的骨架模式。 将进一步研究菌株Y42 胞外多糖结构与抗氧化功能的关系。

