羊全脂乳粉对小鼠肠道菌群的影响
刘 翠 逄晓阳 张 维 刘 鹭 张书文 安 颖* 吕加平*
(1 黑龙江飞鹤乳业有限公司 北京100015 2 中国农业科学院农产品加工研究所 北京100193)
中医普遍认为羊乳有益肠道健康, 例如,《本草纲目》记载羊乳“和小肠”、“利大肠”等,而对牛乳则无相关记载。现代科学证明,羊乳中低聚半乳糖(GOS)的含量约是牛乳的10 倍[1]。 由于GOS 是一种益生元,所以羊乳中GOS 含量较高可能是其有益肠道健康的原因之一。
低聚半乳糖是一种水溶性膳食纤维, 能够被双歧杆菌等肠道益生菌利用, 从而促进肠道益生菌的生长。 GOS 被肠道益生菌发酵后产生的短链脂肪酸(short-chain fatty acids,SCFAs), 包括乙酸、丙酸、丁酸等[2],能够降低直肠内容物的pH,从而抑制有害菌的生长。此外,SCFAs 还被证明能够直接被肠道上皮细胞利用, 促进肠道上皮细胞的生长,并且能维持肠道屏障的完整性,降低病原体穿过肠道屏障进入人体[3-4]。 GOS 不仅能够促进肠道益生菌的生长,还能维持肠道结构的完整。事实上,这一观点被诸多临床试验结果所证实。 例如,服用GOS 后,肠道菌群中双歧杆菌、乳杆菌等益生菌的丰度增高[5-6],肠易激综合征、炎症性肠炎等肠道疾病症状被缓解或者改善[7]。虽然羊乳中GOS含量约为牛乳的10 倍, 并且GOS 能够促进肠道益生菌的生长, 但是目前服用羊乳对肠道菌群的影响,尚缺乏直接的证据。由于肠道菌群失调与多种代谢综合征及慢性病有关,如肥胖[8-9]、糖尿病[10-12]、炎症性肠病(IBD)[13-14]等,所以维持正常的肠道菌群正越来越受重视。研究羊乳对肠道菌群的影响,有助于将羊乳开发成促进肠道健康的营养产品。
本研究选取肠道菌群刚建立阶段的4 周龄BAL B/c 小鼠作为研究载体, 通过为期30d 的羊全脂粉、牛全脂粉饮食干预,采取Illumina 高通量测序法分析小鼠盲肠内容物中的菌群, 观察饲喂不同乳粉的小鼠肠道细菌丰度的差异, 并研究羊全脂乳粉和牛全脂乳粉对小鼠血液生理生化指标的影响。
1 材料与方法
1.1 试验材料
4 周龄BAL B/c 小鼠30 只(雄性),初始平均体重为23 g±1.28 g(北京维通利华实验动物技术有限公司, 小鼠合格证书编号:SCXK 京2014-0001), 饲养于SPF 级动物房 (许可证号:SYXK(京)2013-0023), 室温22 ℃± 2 ℃, 相对湿度60%,饲喂实验动物大(小)鼠生长饲料(A 级)(北京华阜康生物科技股份有限公司, 饲料许可证编号:SCXK(京)2014-0008),光照12 h/12 h 昼夜循环。
羊全脂乳粉来自陕西关山陇州乳业有限责任公司,牛全脂乳粉来自黑龙江飞鹤乳业有限公司。
1.2 试验方法
选取肠道菌群刚建立阶段的4 周龄BAL B/c小鼠, 预饲喂一周后将小鼠随机分成3 组, 每组10 只。 试验组包括羊全脂乳粉组(A)、牛全脂乳粉组(B)和对照组(C),分别采取如下试验处理:
A 羊全脂乳粉组:普通饲料自由采食、饮水+羊全脂乳粉冲调乳灌胃;
B 牛全脂乳粉组:普通饲料自由采食、饮水+牛全脂乳粉冲调乳灌胃;
C 对照组:普通饲料自由采食、饮水。
灌胃剂量: 每次0.2 g 乳粉溶于0.5 mL 蒸馏水后灌胃,每天灌胃1 次。
每周监测采食量、 饮水量和体重, 试验周期30 d。 试验最后一天小鼠眼底采血,分析血液指标(血红蛋白、红细胞计数、白细胞计数、中性粒细胞(%)、淋巴细胞L(%)、谷丙转氨酶、谷草转氨酶、尿素氮、肌酐、胆固醇、血糖、总蛋白、白蛋白、甘油三酯),最后解剖小鼠,收集盲肠内容物进行菌群分析。
1.2.1 基因组DNA 的提取 采用十六烷基三甲基溴化铵(CTAB)方法对肠道内容物样本的基因组DNA 进行提取,具体步骤如下[15-16]:
1)取盲肠内容物0.5 g 加入无菌生理盐水2 mL,匀浆后12 000 r/min 高速离心5 min,彻底去除上清液;
2)加入50 μL TE 缓冲液,充分悬浮细菌;
3)加入60 μL 10% SDS 溶液,10 μL 20 mg/mL 蛋白酶K,温和混匀,37 ℃温育1 h;
4)加入100 μL 5 mol/L 的NaCl 溶液, 上下颠倒离心管十多次,充分混匀;
5)加入80 μL CTAB/NaCl 溶液, 温和混匀,65 ℃下温育10 min;
6)加入700 μL 氯仿/异戊醇,温和混匀,12 000 r/min 高速离心2 min;
7)吸取上清至另一干净离心管,加入等体积的酚/氯仿/异戊醇,上下颠倒混匀,12 000 r/min 高速离心2 min;
8)吸取上清至另一干净离心管,加入2 倍体积冰冷的无水乙醇沉淀DNA,温和混匀;

表1 PCR 反应体系及反应条件Table 1 The reaction system and conditions of PCR
9)离心(12 000 r/min,30 min,4 ℃),彻底去除上清;
10)用300 μL 70%预冷的乙醇洗涤沉淀,离心(12 000 r/min,15 min,4 ℃),弃上清,再离心几秒,用移液器彻底除去酒精,风干;
11)沉淀溶于100 μL TE 溶液中,-20 ℃保存;
12)以紫外分光光度法检测DNA 浓度, 并使用无菌水稀释样品至1 ng/μL。
1.2.2 PCR 扩增 稀释后的基因组DNA 为模板;根据测序区域的选择, 使用带Barcode 的特异引物;使用PhusionRHigh-Fidelity PCR Master Mix with GC Buffer(New England Biolabs)。 使用高效和高保真的酶进行PCR,确保扩增效率和准确性。16S rDNA,V4 区,大概长度200 bp(包括引物序列), 正向引物 F (5’ -GATCCTACGGGAGGCAGCA-3’), 反向引物R (5’-GCTTACCGCGGCTGCTGGC-3’),引物浓度0.5 μmol/L。 PCR 反应体系及反应条件[17-18]见表1。
1.2.3 PCR 产物的混样和纯化 PCR 产物使用2%质量分数琼脂糖凝胶进行电泳检测;根据PCR产物浓度进行等浓度混样,充分混匀后使用2%的琼脂糖凝胶电泳检测PCR 产物,使用GeneJET 胶回收试剂盒(Thermo Scientific)回收产物。
1.2.4 文库构建和上机测序 使用NEB NextRUltraTMDNA Library Prep Kit for Illumina 建库试剂盒(New England Biolabs)进行文库的构建,构建好的文库经过Qubit 定量和文库检测, 合格后,使用Hiseq2500,每个样品单独建库测序。
1.2.5 血液指标检测 血液生理生化指标主要分两类:一类是用全自动血细胞分析仪(日本SYSMEX 希森美康2100)测定的,包括血红蛋白、红细胞计数、白细胞计数、中性粒细胞、淋巴细胞;其余血清指标用全自动生化仪 (德国BECKMAN AU480)分析检测。
血液学参数能反应饲喂乳粉后的小鼠各组织器官的功能状态, 血液生理生化指标可反映出受试小鼠的营养满足程度和新陈代谢状况, 对监测受试小鼠的健康状况具有参考价值。 血红蛋白对各种贫血的鉴别具有重要意义, 是分析贫血不可缺少的指标; 红细胞总数的增减辅助监测受试小鼠脱水或贫血症状;通过白细胞总数的测定,可判断机体抵抗疾病的能力。 中性粒细胞具有吞噬外源入侵细菌的作用, 和淋巴细胞一样参与机体的免疫反应,是评估机体免疫力的指标。
总蛋白是评估受试小鼠营养吸收、 判定营养不良的指标, 跟白蛋白指标共同指征肝脏功能状况;血糖指标可以评估受试小鼠肠道对糖、碳水化合物的吸收利用程度。谷丙转氨酶、谷草转氨酶是评估受试小鼠肝脏功能的指标,尿素氮、肌酐是评估受试小鼠肾脏功能的指标,胆固醇、甘油三酯是评估受试小鼠心血管健康程度的指标。
2 结果与分析
2.1 饲喂不同乳粉对小鼠采食、饮水以及增重的影响
灌胃乳粉的两组小鼠采食量较正常对照组稍低(图1a),可能是由于灌胃乳粉的小鼠其机体中一部分能量需求由乳粉提供, 从而减少了对小鼠饲料的摄入。 灌胃乳粉的两组小鼠饮水量较正常对照组稍低(图1b),可能是由于灌胃乳粉的过程中,已经给小鼠机体补充了部分水,从而减少了小鼠对饮用水的摄入。
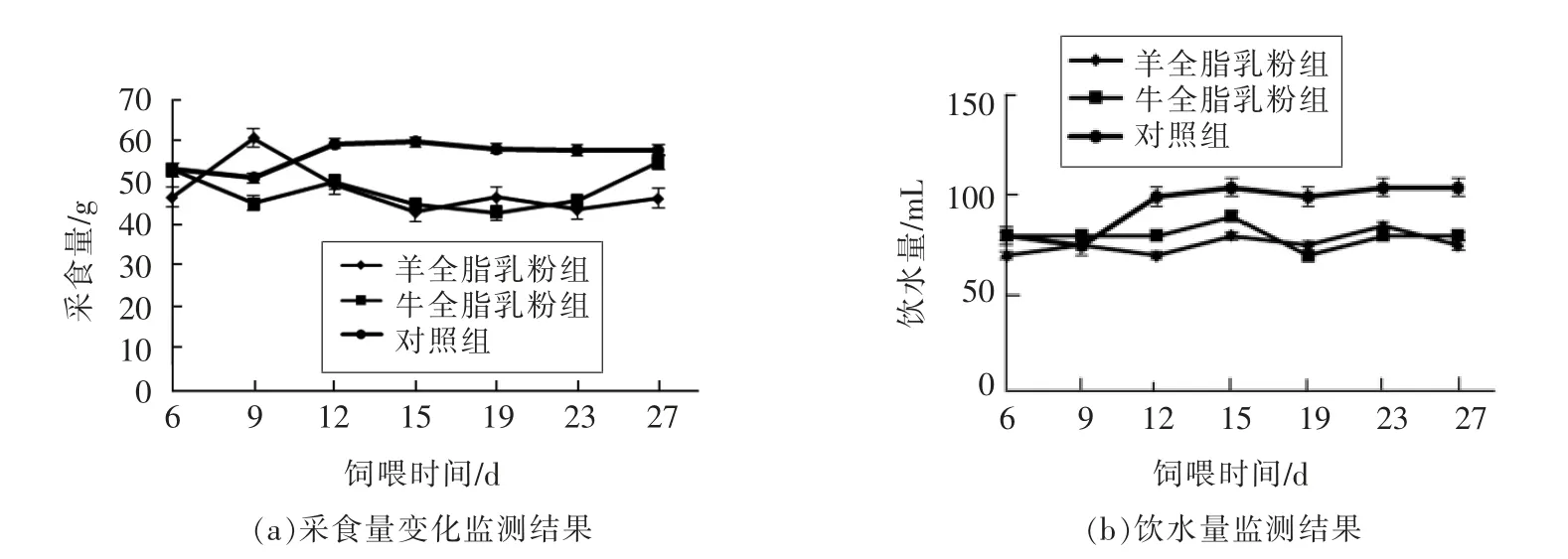
图1 采食量和饮水量监测结果Fig.1 The result of feed intake and water drinking amount
对不同组小鼠的体重变动情况进行了统计监测分析(表2)发现,饲喂羊全脂乳粉小鼠体重显著低于对照组(P<0.05)。 有研究通过动物模型研究指出, 乳中的乳清蛋白和钙的摄入可以有效控制体重。 Belobrajdic D P 等[19]通过向大鼠膳食中添加乳清蛋白考察其对大鼠体重的影响, 研究发现,32%乳清蛋白摄入量可以减少10%的体重;Zemel M B 等[20]则指出,钙的摄入可能抑制脂肪的生成、促进脂肪分解和氧化以及热量的生成,从而抑制由饮食引起的体重增加。 羊乳中乳清蛋白和钙的含量均高于牛乳,因此,可能导致摄入羊全脂乳粉的小鼠体重较牛全脂乳粉组低, 并显著低于对照组。

表2 小鼠体重差异的比较Table 2 The comparison of weight difference in mice
2.2 饲喂不同乳粉对小鼠肠道菌群的影响结果
2.2.1 各组样品中微生物种类和丰度比较(Heatmap 图)为了直观展示不同处理组间OTUs 情况, 对各处理组和OTUs 进行双向二维聚类,绘制Heatmap(图2),即可反映不同处理组小鼠肠道中各种菌群的整体情况, 显示样品菌群多样性。由图2 可以看出,羊全脂乳粉组较牛全脂乳粉组的梭状菌属和拟杆菌属的数量低。
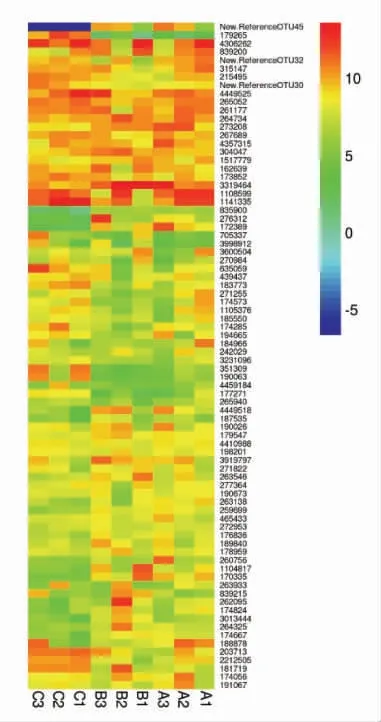
图2 菌群分布热图Fig.2 The heatmap of the flora distribution
2.2.2 4 种菌群的丰度分析 对3 组小鼠肠道中乳杆菌属、双歧杆菌属、拟杆菌属、梭菌属4 种菌群进行了相对丰度分析,结果见图3。
虽然羊乳GOS 的含量约为牛乳的10 倍,而且GOS 能够促进双歧杆菌和乳杆菌的生长,但本研究并没有发现羊全脂乳粉组与牛全脂乳粉组肠道双歧杆菌和乳杆菌丰度的显著性差异, 甚至羊全脂乳粉组和牛全脂乳粉组小鼠肠道双歧杆菌属的丰度显著性低于对照组(表3)。 其原因可能有多种:(1)本研究中羊乳的灌喂量不足以改变小鼠肠道菌群;(2)研究的对象为4 周龄非无菌小鼠,可能不是研究羊乳对小鼠肠道菌群影响的合适模型;(3)虽然高通量测序法能够同时分析大量肠道菌群的丰度, 但其准确性很大程度上依赖提取后肠道菌群总DNA 的完整性,本研究中也确实存在部分小鼠肠道总DNA 提取后完整性较差,无法进行PCR 扩增的现象。
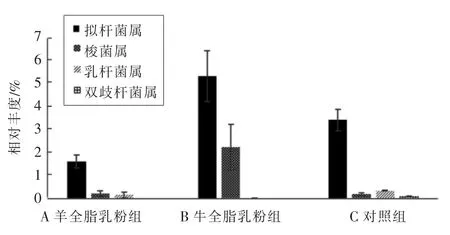
图3 各组优势菌群的相对丰度分布图Fig.3 The relative abundance of the dominant microflora
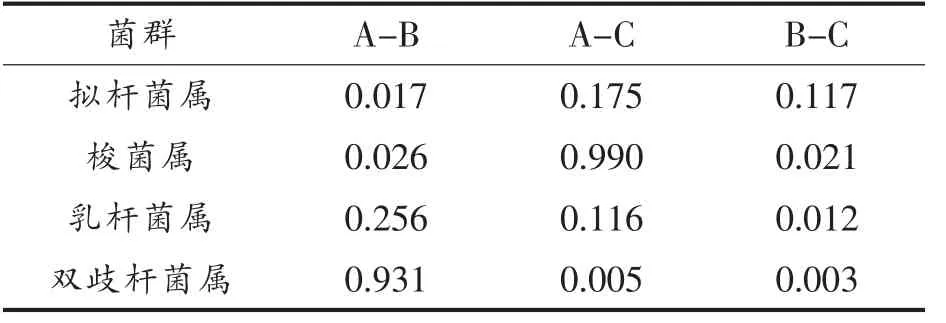
表3 不同组间菌群差异的比较(P 值)Table 3 The comparison of flora differences among different treatments (P value)
2.3 饲喂不同乳粉对小鼠常规血液指标的影响
本研究中各组小鼠血液常规指标除中性粒细胞数之外没有显著差异(表4),这表明各组小鼠营养状况、免疫力基本没有明显差异。饲喂牛全脂乳粉的小鼠血液中中性粒细胞数显著高于饲喂羊全脂乳粉组小鼠,与对照组相似,其原因还待深入研究。
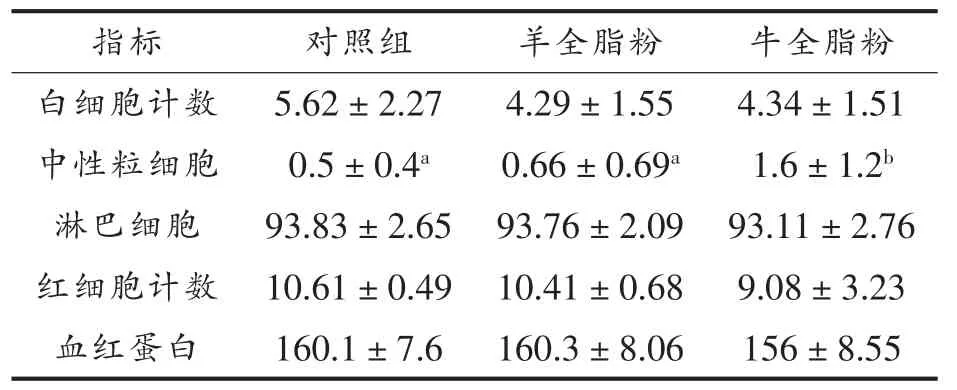
表4 饲喂不同乳粉小鼠血液常规指标分析结果Table 4 The results of blood routine indexes of mice fed with different milk powder
本试验对不同乳粉组小鼠血清指标进行了统计分析(表5),不同组小鼠血清中总蛋白、白蛋白、肌酐、尿素氮指标均没有显著性差异,但饲喂羊全脂乳粉的小鼠血糖水平显著低于其他组。 明代的《本草纲目》即指出羊乳具有“治消渴(糖尿病)”的功效,现代科学研究对羊乳降血糖功效的直接研究较少,但是,有学者研究指出牛乳中的钙可以调节胰岛β 细胞内外钙池中钙离子的平衡,乳清蛋白富含亮氨酸可以直接调节胰岛素的释放, 共轭亚油酸通过增加骨骼肌的葡萄糖转运蛋白活力等作用预防2 型糖尿病的发生[21],羊乳中的钙和乳清蛋白含量均高于牛乳。因此,羊全脂乳粉组小鼠血糖显著低于其他组, 可能是由于羊乳对血糖有一定的影响。
通过血清胆固醇指标的分析(表5),发现所有饲喂乳粉的小鼠, 血清中胆固醇的水平均显著低于对照组, 说明乳粉可能具有辅助降机体胆固醇的作用。 有报道称[22],乳中的乳清酸可以制止胆脏制造胆固醇, 从而降低血液中的总胆固醇量。Alférez M J 等[23]和López-Aliaga I 等[24]研究发现,与牛乳相比, 羊乳可以降低小鼠血浆中的胆固醇水平。 Díaz-Castro J 等[25]研究表明饲喂羊乳的小鼠血浆中胆固醇和甘油三酯水平较饲喂牛乳的低。 这可能是由于羊乳中链甘油三酯(MCT)含量高于牛乳,MCT 可以减少内源性胆固醇的合成,并促进其在肠道内的吸收; 羊乳中单不饱和脂肪酸含量高于牛乳, 单不饱和脂肪酸可以使膳食中胆固醇通过胆汁更快的排除, 从而产生降胆固醇效果。
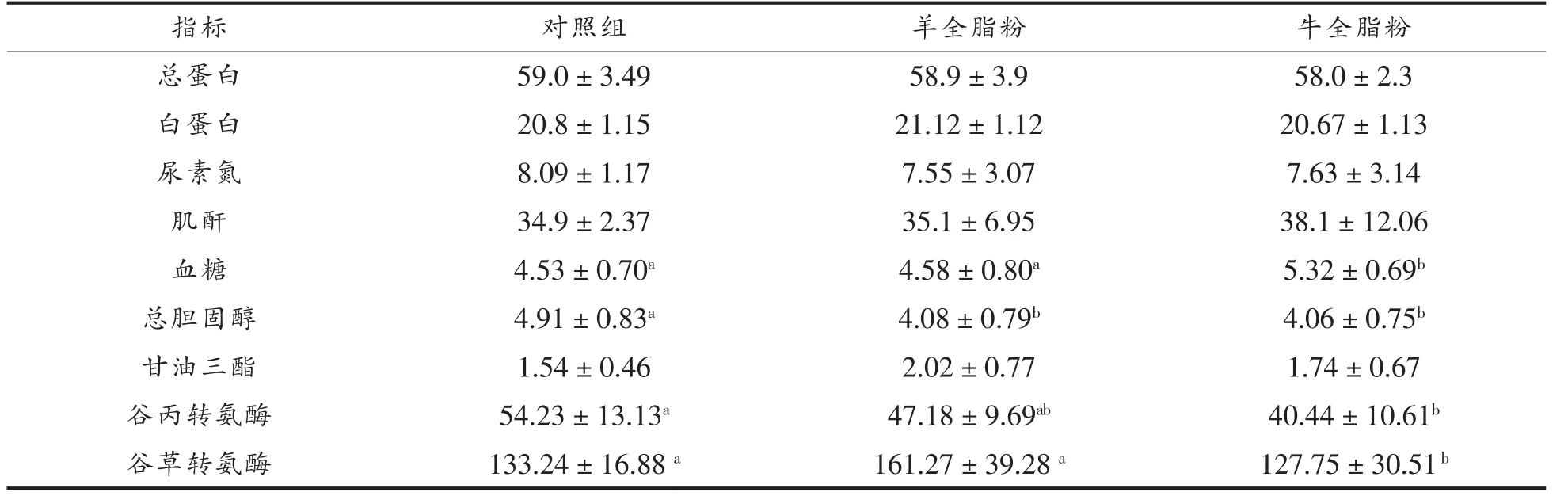
表5 饲喂不同乳粉小鼠血清指标统计分析结果Table 5 The statistical analysis results of serum indexes in mice fed with different milk powder
3 结论
在小鼠饲喂过程中发现, 两全脂乳粉组小鼠的采食量和饮水量较对照组均稍有下降, 可能是由于乳粉灌胃时带入了部分能量和水分。此外,羊全脂乳粉组体重稍低于牛全脂乳粉组小鼠, 并显著低于对照组。
肠道菌群方面,饲喂牛全脂乳粉的小鼠,肠道中拟杆菌的丰度显著高于饲喂羊全脂乳粉的小鼠; 饲喂羊全脂乳粉和牛全脂乳粉的小鼠肠道中乳杆菌属和双歧杆菌属的相对丰度没有显著差异;饲喂羊全脂乳粉的小鼠,肠道中梭状菌属的相对丰度显著低于饲喂牛全脂乳粉的小鼠。
血液生理生化指标方面, 各试验组仅在血糖和血清胆固醇方面存在差异,其中,饲喂羊全脂乳粉的小鼠, 血清中血糖含量显著低于饲喂牛全脂乳粉组。两组试验组与对照组相比,血清中胆固醇的水平均显著低于对照组, 说明乳粉可能具有辅助降机体胆固醇的作用。 羊乳降血糖和降胆固醇的作用机制尚需要进一步试验证实。

