大肠杆菌鞭毛研究进展
田 延,丁雪燕,岑 雪,周明旭,羊 扬*,朱国强*
(1.扬州大学兽医学院,江苏扬州225009;2.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏扬州225009)
鞭毛是位于细菌表面的长螺旋形可旋转附属物,长约10 μm,主要与细菌的运动有关。鞭毛的驱动力是许多细菌病原体的重要毒力特征,并且是建立感染所必需的。感染发生后,鞭毛有利于细菌到达侵入部位。大肠杆菌(Escherichia coli,E.coli)一般周身鞭毛,具有运动性。鞭毛蛋白,又称为H抗原,是大肠杆菌分类的重要表面抗原。本文对大肠杆菌鞭毛的结构、功能和H抗原分型作一简要综述,旨在为本领域的相关研究提供一定的理论基础和依据。
1 鞭毛的结构
细菌鞭毛蛋白的结构分析表明,蛋白质折叠成不同的形态结构域,即D0-D3。不同细菌种类鞭毛蛋白的N-和C-末端的D0和D1结构域(分别由FliC的N端和C端保守序列组成)具有很多共同的特征。D0和D1结构域对于鞭毛蛋白的聚合至关重要,通过α螺旋形成鞭毛丝的中心,并且主要隐藏在完整鞭毛的结构内部[1]。在许多细菌中,D1结构域含有被先天性免疫Toll样受体5(Toll-like receptors 5,TLR5)识别的区域[2]。D2和D3结构域在细菌中具有更高的可变性,并且大部分暴露在鞭毛丝的外层[3]。在很多细菌种类中,这些结构域被糖部分修饰,这就进一步促进了菌株之间的多样性变化[4]。
2 鞭毛的生物合成和装配
鞭毛的生物合成和装配过程非常复杂,需要鞭毛基因亚群的及时转录和鞭毛蛋白合成、细胞内加工、折叠和输出的协调一致,以及功能性鞭毛纤维的形成[5]。鞭毛伴侣蛋白对于鞭毛的生物合成至关重要,这些蛋白质与不同的鞭毛组分相互作用,其中鞭毛组分包括钩-丝连接蛋白FlgK/FlgL、丝-帽蛋白FliD和鞭毛蛋白亚基[6]。大部分的鞭毛伴侣蛋白不支持蛋白质折叠,而是在防止鞭毛蛋白过早折叠和聚合方面起着重要的作用,它们靶向作用鞭毛III型分泌系统(Flagellar type III secretion system,T3FSS)[7],从而帮助细菌正确组装和输出鞭毛蛋白。通常,大肠杆菌的FlgN、FliS和FliT伴侣蛋白分别防止鞭毛的FlgK/FlgL、FliC和FliD蛋白的自我聚合[6]。细菌鞭毛的组装和功能主要依赖于通过保守的T3FSS进行的蛋白质输出,因此T3FSS对于鞭毛的生物合成和装配至关重要。
3 鞭毛的基因调节
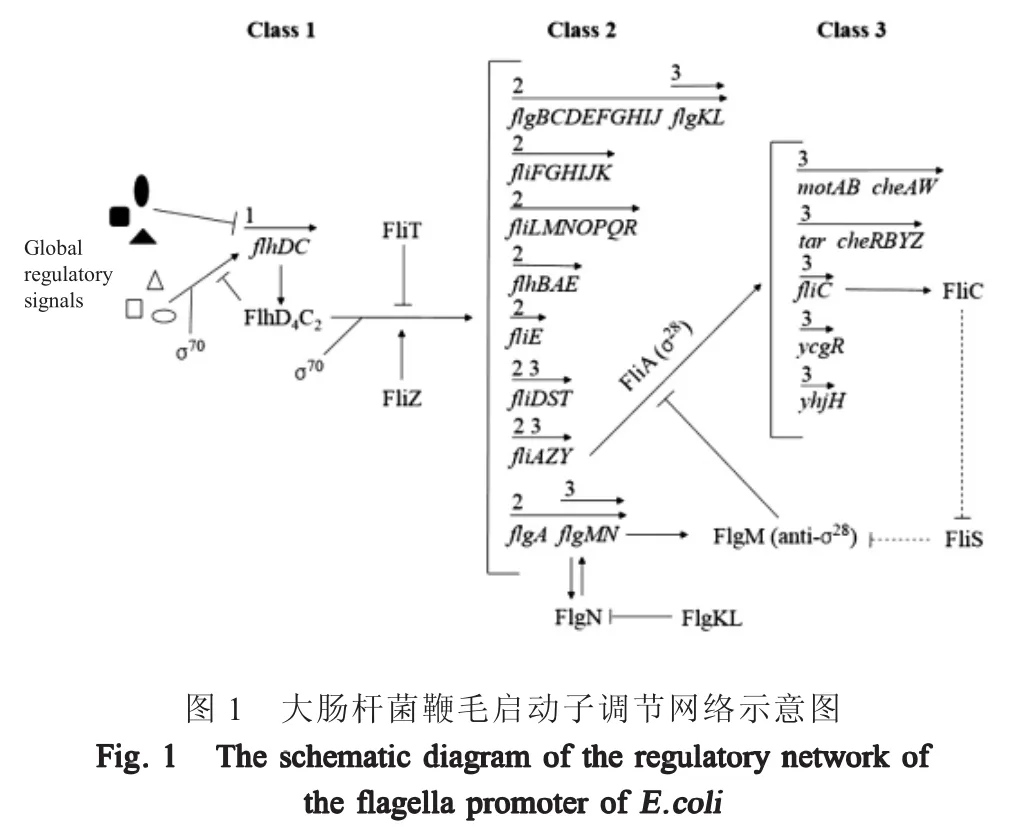
控制鞭毛基因表达的启动子根据基因在其控制下的表达时机分为3类(图1)[7]。单个 1类启动子(PflhDC启动子)编码两种蛋白(FlhD和FlhC),它们一起形成转录激活物复合物FlhD4C2。该启动子整合了大量来自全局调控因子的输入信号,并决定细胞是运动还是非运动[8]。FlhD4C2转录因子对于激活2类启动子是必需的,还与大肠杆菌内其它毒力因子的共调节相关[9]。2类启动子控制所有构成钩-基体(Hook-basal body,HBB)、丝帽蛋白(FliD)和调节子(FliA、FlgM、FliZ和FliT)的蛋白的表达[10]。Fli-A是鞭毛特异性转录σ因子(σ28),负责所有3类启动子的激活,而3类启动子控制形成细丝、运动蛋白以及趋化蛋白的蛋白表达[11]。此外,FliA正向调节其自身表达,以及编码FlgM、FliZ、FliD和FliT的基因的表达。因此,编码这5种蛋白质的基因受到2类和3类启动子的控制。除了对转录的直接控制外,几种翻译后调控的相互作用在调节鞭毛装配过程中也起着重要作用。首先,FlgM(FliA的抗σ因子)与FliA结合形成FliA-FlgM蛋白复合物。FlgM对FliA的螯合不会在细胞中留下任何游离的FliA来激活3类启动子[12]。然而,在完成功能性HBB后,Fli-A-FlgM复合物与鞭毛输出装置相互作用,从而使FlgM从细胞分泌出来。FlgM的分泌导致FliA释放以激活3类启动子。第二个相互作用涉及帽蛋白FliD及其伴侣蛋白FliT。FliD从HBB中分泌出来并在鞭毛顶部组装。在完成HBB之前,FliT结合FliD并在细胞内形成FliD-FliT复合物。在HBB完成后,FliD通过HBB结构分泌。细胞内游离的FliT与FlhD4C2复合物相互作用并阻止FlhD4C2依赖性的2类基因的激活[13]。该反馈回路负调控鞭毛基因的表达以响应细胞中FliD分泌的增加[14]。
此外,与fliD和fliT在相同操纵子中表达的FliS被认为是长丝蛋白FliC的伴侣蛋白。已知fliS的缺乏导致鞭毛丝的长度变短[15]。FlgN(在具有抗σ因子FlgM的操纵子中表达)是钩相关蛋白(Hook-associated proteins,HAPs)FlgK和FlgL的伴侣蛋白,FlgK和FlgL形成柔性钩子和刚性长丝之间的连接点[16]。大量的实验研究已经促进了对大肠杆菌中控制鞭毛组装的调节网络的详细理解。
4 大肠杆菌鞭毛H抗原分型
根据鞭毛蛋白超微结构的差异,将大肠杆菌的H抗原分为53种,包括A、B、C、D、E和F共6种形态[17-18](表1)。尽管大部分H抗原是由fliC基因编码的,但也有例外,如H17抗原型由flnA基因编码,H44和H55抗原型由fllA基因编码等[19-20]。同时还有一些大肠杆菌表现出两种不同的H抗原型相态,其鞭毛蛋白由两种基因编码。这种现象表明大肠杆菌在进化过程中既具有保守性,又具有多样性和丰富性。

表1 大肠杆菌H抗原分类和特征
5 鞭毛的相关功能
5.1 趋化性和运动性 为了更好地生存,细菌每时每刻都需要适应环境的变化,其中最简单的方法就是运动。而趋化行为是运动生物体的一般属性,能够使生物朝向或远离化学物质和各种刺激。细菌的趋化系统能够识别和传导多种化学信号,如pH值、营养和渗透压等,继而引发细菌的运动,且其运动方向由鞭毛的转动方向所控制。很多具有致病性的细菌就是利用运动性和趋化性来实现对宿主细胞的定植和侵袭,而运动性本身也与细菌的毒力相关[21]。产志贺毒素大肠杆菌O113:H21无运动性突变株在体外黏附试验中虽然与野生菌株具有相似的黏附能力,但其毒力明显减弱[22-23]。为了更好地了解细菌的致病机理,细菌趋化性、运动性和致病性之间复杂的关系还有待进一步的挖掘研究。
5.2 鞭毛参与细菌的黏附和侵袭 细菌的表面结构(如定植因子和菌毛[24])可以介导其对宿主细胞的粘附和定植,而鞭毛因其显著的运动性一直被认为不参与细菌的黏附和侵袭等毒力过程。然而,越来越多的研究表明多种大肠杆菌致病型菌株可以通过鞭毛直接黏附于宿主细胞。新生儿脑膜炎大肠杆菌鞭毛基因缺失后,其对人脑微血管内皮细胞的粘附能力明显低于其相应的野生菌株[25]。猪源产肠毒素大肠杆菌可借助鞭毛黏附于仔猪上皮细胞,同时纯化得到的鞭毛蛋白可直接粘附于细胞[26]。产肠毒素大肠杆菌F107/86菌株对仔猪空肠上皮细胞的黏附和侵袭试验中发现,motA(鞭毛马达蛋白编码基因)基因缺失株与野生菌株相比其侵袭能力显著上升[27]。此外,鞭毛还参与禽致病大肠杆菌、产肠毒素大肠杆菌和肠出血性大肠杆菌等致病菌对宿主细胞的侵袭过程[27]。但以上过程涉及到的更加精确的分子机制还有待深入探究。
此外,鞭毛在大肠杆菌与非生物表面粘附中也发挥作用。研究野生型和鞭毛敲除菌株的粘附性试验证实鞭毛增强了对疏水性底物的粘附,而缺乏鞭毛的细菌未显示出对疏水性底物的优选亲和力,这一性质使得具有鞭毛的细胞可以稳定水性培养物和十二烷的乳液[28]。这项工作有助于我们对非特异性细菌粘附的整体理解,并证实鞭毛除了运动性以外,可能在表面粘附中起重要作用。
5.3 鞭毛介导生物被膜的形成 生物被膜是由细菌粘附于接触表面后分泌纤维蛋白等将其自身包绕其中而形成的大量细菌聚集膜样物,可以增强致病菌对抗生素的耐药性并帮助细菌躲避宿主免疫系统的清除。生物被膜形成过程中可能涉及到多种表面结构蛋白,如菌毛、自转运蛋白和鞭毛[24]。在对产肠毒素大肠杆菌菌株的研究中发现fliC基因缺失株无法形成微菌落结构,同时其形成生物被膜的能力显著低于野生菌株[29]。尿道致病性大肠杆菌的鞭毛基因缺失菌株因为只能形成小而稀疏的菌落而导致生物被膜不能进一步成熟[30]。另外,运动性也是影响生物被膜形成的重要因素之一。与K12大肠杆菌的野生菌株相比,其有鞭毛但无运动性的motA缺失株和无鞭毛的fliA缺失株的生物被膜形成能力均明显下降[26]。
5.4 鞭毛的免疫调节作用 鞭毛蛋白是鞭毛的亚基蛋白,是一种能够使细菌运动的鞭状附属物。鞭毛蛋白现在已成为一种有效的免疫激活剂,可以在微生物感染期间形成先天和适应性的免疫武器。先天性免疫细胞通过TLR的结构相关受体对各种刺激(包括细菌、病毒、寄生虫或真菌感染)作出反应。TLR能够感应细菌的脂磷壁酸、脂多糖和鞭毛蛋白等多种成分[31]。这种感应启动细胞内信号级联反应,最终导致各种促炎症和免疫反应基因的激活。促炎细胞因子通过上调共刺激分子和粘附分子提供增强的信号,这对于获得性免疫细胞的激活以及随后发生的针对非自身感染性抗原的保护性免疫应答是必不可少的[32]。
关于鞭毛蛋白促炎作用的第一篇报道[33]表明沙门氏菌鞭毛蛋白是亚纳摩尔浓度的前单核细胞系中细胞因子的有效诱导剂。后来,McDermott等人报道单核细胞中促炎症反应的诱导涉及到鞭毛蛋白与存在于先天免疫细胞中的表面受体之间的高亲和力的相互作用[34]。这种表面受体负责鞭毛蛋白的炎症和先天性免疫活性,后来被Hayashi等[35]证明是TLR5,并得到了许多其他研究人员的证实。进一步的研究表明,缺乏高变区的重组蛋白不存在佐剂活性受损现象。因此,D1和D2结构域对于识别TLR5是必不可少的,并足以诱导促炎反应[36]。Arnon等首先报道了鞭毛蛋白的佐剂潜力,并对其与多种细菌、病毒或寄生虫抗原相结合的佐剂活性进行了相应的测试[37]。以鞭毛蛋白作为佐剂的安全有效疫苗已经产生,并且一些疫苗最终进入了人类临床试验[38]。更重要的是,鞭毛蛋白具有抗肿瘤和辐射防护的活性,并已显示出巨大的潜力来对抗肿瘤生长和辐射相关的组织损伤[39]。近年来,许多微生物组分已被用作佐剂来增强免疫原性不良疫苗的免疫应答。尽管迄今为止所研究的佐剂均被证明是有效的,但TLR5激动剂鞭毛蛋白因为没有任何严重的副作用而更有希望成为理想的佐剂。
6 小结和展望
大肠杆菌作为细菌研究的模式生物,其菌体结构和毒力因子等正在被逐步挖掘。鞭毛除了作为细菌的运动器官外,还参与蛋白分泌、黏附侵袭以及生物被膜的形成等多种重要的毒力过程,甚至还参与免疫调节过程。大肠杆菌鞭毛复杂的生物学功能提示我们要想更加全面的了解和认识大肠杆菌,就必须充分重视鞭毛的存在及其与其它毒力因子之间形成的复杂网络,这将会成为日后研究的热点。

