MDCK细胞中IFN-γ诱导的免疫相关GTP酶在弓形虫PVM表面的定位研究
李 琦,张朝霞,谷昊容,曹 亮,贾洪林*,王春仁
(1.黑龙江八一农垦大学动物科技学院,黑龙江大庆163000;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江哈尔滨150069;3.黑龙江省农垦总局动物卫生监督所黑龙江哈尔滨150036)
刚地弓形虫(Toxoplasma gondii)为专性细胞内寄生性原虫,可以感染包括人类在内的所有温血动物,引起重大的人兽共患疾病[1]。全世界约有30%的人口长期感染弓形虫。弓形虫入侵细胞时会产生纳虫空泡(Parasitophorous vacuole,PV),PV膜(PVM)具有一定的通透性,允许宿主细胞内弓形虫生存所需的营养物质及小分子进入,同时隔绝来自宿主细胞内的其它有害因子,为弓形虫提供有效的屏障[2-3]。PVM不与宿主细胞的内涵体或溶酶体融合,在保护弓形虫体免受宿主天然免疫系统的杀伤过程中起到非常重要的作用[4-5]。
抗寄生虫的细胞免疫主要依靠1型T辅助细胞(Th1)反应,涉及到T细胞、树突细胞和自然杀伤(NK)细胞等多种细胞以及干扰素-γ(IFN-γ)、肿瘤坏死因子(TNF)等细胞因子[6]。IFN-γ为CD4+T细胞和NK细胞分泌的关键细胞因子[7-9]。在小鼠抗弓形虫感染的细胞免疫中,IFN-γ可以诱导多种免疫相关GTP酶(IRGs)和鸟苷酸结合蛋白(GBPs)的表达,其中,IRGs在结构和功能上分为GMS蛋白和GKS蛋白[10-12],GMS 类 IRGs(Irgm1、Irgm2、Irgm3)采用missing-self的原理,引导GKS类IRGs(Irga6、Irgb6、Irgb10等)被募集到PVM表面,并引起GBPs的聚集,进而使得PVM发生囊泡化,暴露出其内的弓形虫体,使得虫体被宿主细胞内的天然免疫分子识别、杀伤并清除[13]。
迄今而止,犬细胞中抵抗弓形虫感染的免疫机制仍不清楚,其是否也依赖于IRGs对弓形虫PVM的募集还有待验证。因此,本研究构建了稳定表达Irgb11-GFP的MDCK细胞系,并经体外感染弓形虫,研究在IFN-γ诱导的情况下,Irgb11对弓形虫PVM的影响。本实验为深入研究宿主抗弓形虫感染的天然免疫机制以及研究防治弓形虫感染的措施奠定基础。
1 材料与方法
1.1 主要实验材料 刚地弓形虫PLK虫株、HFF、HEK293T、MDCK细胞由哈尔滨兽医研究所基础免疫实验室保存;E.coliDH5α感受态细胞、BamHⅠ和XbalⅠ、KOD-Plus-Neo高保真 PCR酶、Blasticidin S Hcl抗生素购自TaKaRa公司;RNA提取试剂盒、反转录试剂盒及Vazyme连接试剂盒均购自QIAGEN公司;慢病毒载体LentiCas9-Blast、psPAX2、pCMV-VSV-G、pEGFP质粒均购自Addgene公司;鼠抗 β-actin单克隆抗体(MAb)、山羊抗鼠 IgGHRP、兔抗GFP多克隆抗体、山羊抗兔IgG-HRP、Alexa Fluor 594标记的猴抗鼠IgG(H+L)、Alexa Fluor 488标记的猴抗兔IgG(H+L)均购自Sigma公司;鼠抗GRA7 MAb与PEI转染试剂由哈尔滨兽医研究所基础免疫实验室制备。
1.2 引物的设计与合成 根据GenBank中Irgb11(NM_001313802)和GFP基因(LN515608.1)序列,采用primer5.0软件设计了两对特异性引物,分别于Irgb11上游引物和下游引物的5'端添加XbaⅠ(tctaga)和BamHⅠ(ggatcc)酶切位点及与LentiCas9-Blast连接的同源臂(小写),用以分别扩增Irgb11和GFP的基因序列。引物均由吉林省库美生物科技有限公司合成(表 1)。

表1 引物序列
1.3 pLenti-Irgb11-GFP重组质粒的构建与鉴定收集培养的MDCK细胞,采用RNA提取试剂盒提取细胞总RNA,反转录合成cDNA。以该cDNA为模板,采用引物Lenti-Irgb11-F/Irgb11-GFP-R PCR扩增Irgb11基因;以pEGFP质粒为模板,以Irgb11-GFP-F/Lenti-GFP-R为引物,PCR扩增GFP编码基因,再以GFP、Irgb11的PCR产物经胶回收后的混合产物为模板,以Lenti-Irgb11-F/Lenti-GFP-R为引物,利用KOD酶进行Irgb11-GFP基因的融合PCR扩增。PCR反应参数为:94℃ 2 min;94℃ 30 s、55℃ 30 s、68℃ 2 min,35个循环;68℃ 7 min。将PCR产物采用Vazyme连接试剂盒克隆至经XbaⅠ和BamHⅠ双酶切的Lenti-Cas9-Blast载体中,构建重组质粒pLenti-Irgb11-GFP。
采用引物Lenti-Irgb11-F/Lenti-GFP-R对构建的重组质粒进行PCR鉴定。鉴定正确的重组质粒由吉林省库美生物科技有限公司双向测序并拼接鉴定。
1.4 重组质粒pLenti-Irgb11-GFP的慢病毒包装将 pCMV-VSV-G、psPAX2、pLenti-Irgb11-GFP质粒采用PEI试剂共转染至HEK293T细胞中,6 h后弃去培养液,换用10%FBS的DMEM培养。在转染48 h后观察细胞状态并收集细胞培养液[14],12 000 r/min离心5 min,取上清即为包装Irgb11-GFP的病毒液,保存备用。
1.5 过表达Irgb11-GFP细胞系的构建与稳定传代采用1.4获得的包装的病毒液感染MDCK细胞,37℃培养48 h后利用荧光显微镜观察,如细胞内有绿色荧光,即向细胞培养液内按照5 μg/mL加入Blasticidin S Hcl初步筛选,每隔48 h更换新鲜加药培养液。5 d后将细胞消化经流式细胞仪筛选,分选出具有绿色荧光蛋白表达的细胞,将分选出的MDCK-Irgb11细胞在含5%FBS与2%青霉素和链霉素的DMEM培养皿中培养,每2 d传代一次,共传10代,每代细胞均在荧光显微镜下观察是否出现特异荧光;收集第5代的细胞样品裂解后,以兔抗GFP多克隆抗体(1∶3 000)与鼠抗 β-actin MAb(1∶3 000)为一抗,山羊抗兔 IgG-HRP(1∶5 000)与山羊抗鼠IgG-HRP(1∶5 000)为二抗经 western blot鉴定是否构建了稳定表达Irgb11-GFP的细胞系MDCK-Irgb11。
1.6 Irgb11蛋白在弓形虫PVM表面的定位检测将8×103个 MDCK-Irgb11细胞接种共聚焦培养皿中,16 h后加入2 ng/mL IFN-γ诱导24 h后接种5×105个弓形虫PLK虫株,以未经IFN-γ诱导的MDCK细胞为对照。2 h后弃去培养液,PBS清洗细胞3次,加入组织固定液固定,利用间接免疫荧光试验(IFA),分别以鼠抗 GRA7 MAb(1∶1 000)和兔抗GFP多克隆抗体(1∶3 000)为一抗,以Alexa Fluor 594标记的猴抗鼠IgG(H+L)(1∶3 000)与Alexa Fluor 488标记的猴抗兔IgG(H+L)(1∶3 000)为二抗。利用共聚焦激光扫描显微镜观察PLK虫株与Irgb11-GFP蛋白的定位情况。
2 结果
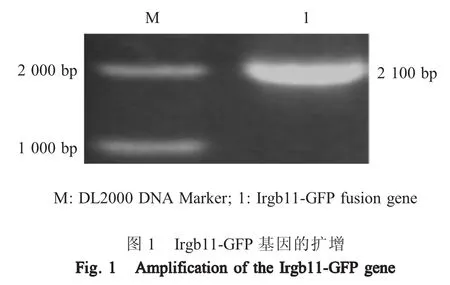
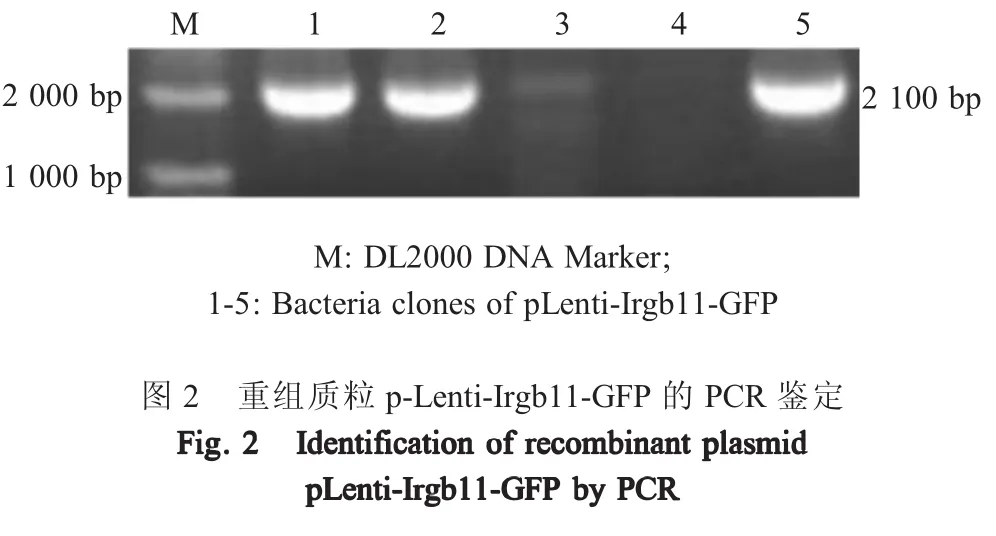
2.1 pLenti-Irgb11-GFP重组质粒构建及鉴定 分别以Lenti-Irgb11-F/Irgb11-GFP-R及Irgb11-GFP-F/Lenti-GFP-R为引物,以MDCK细胞的cDNA与pEGFP质粒为模板分别扩增了Irgb11基因与GFP基因。采用KOD酶将Irgb11与GFP基因经融合PCR扩增后,结果显示Irgb11-GFP融合基因片段约为2 000 bp,与预期片段大小相符(图1),表明扩增获得了Irgb11-GFP基因。将PCR扩增产物与Lenti-Cas9-Blast载体连接后构建的重组质粒pLenti-Irgb11-GFP经菌落PCR鉴定。结果显示,在约2 000 bp处有目的条带,与预期大小相符(图2)。鉴定为阳性的菌液测序结果显示,PCR扩增获得的基因与Irgb11-GFP融合基因大小相符,表明正确构建重组质粒pLenti-Irgb11-GFP。
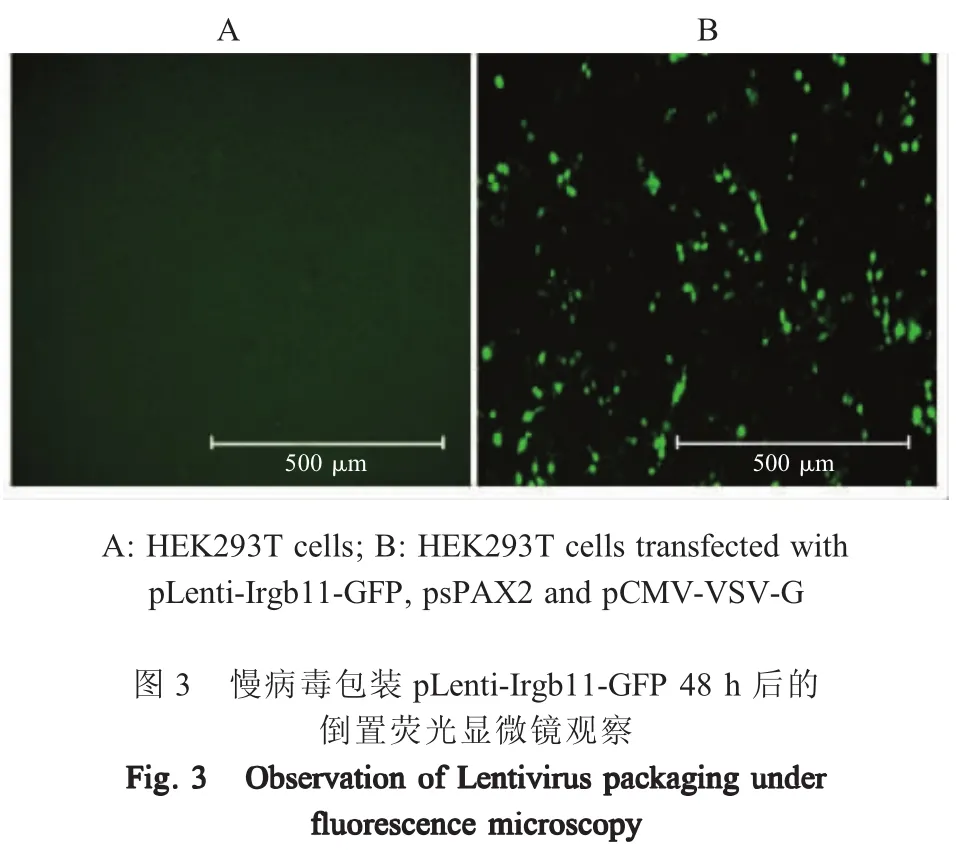
2.2 重组质粒pLenti-Irgb11-GFP的慢病毒包装将构建的重组质粒pLenti-Irgb11-GFP与慢病毒包装质粒psPAX2和pCMV-VSV-G共转染HEK293T细胞,48 h后采用倒置荧光显微镜观察HEK293T细胞有特异的绿色荧光(图3)。表明Irgb11-GFP融合基因在HEK293T细胞中获得表达。
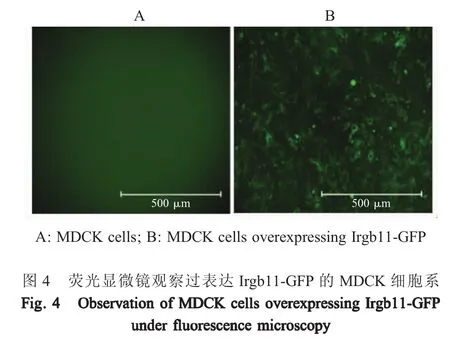
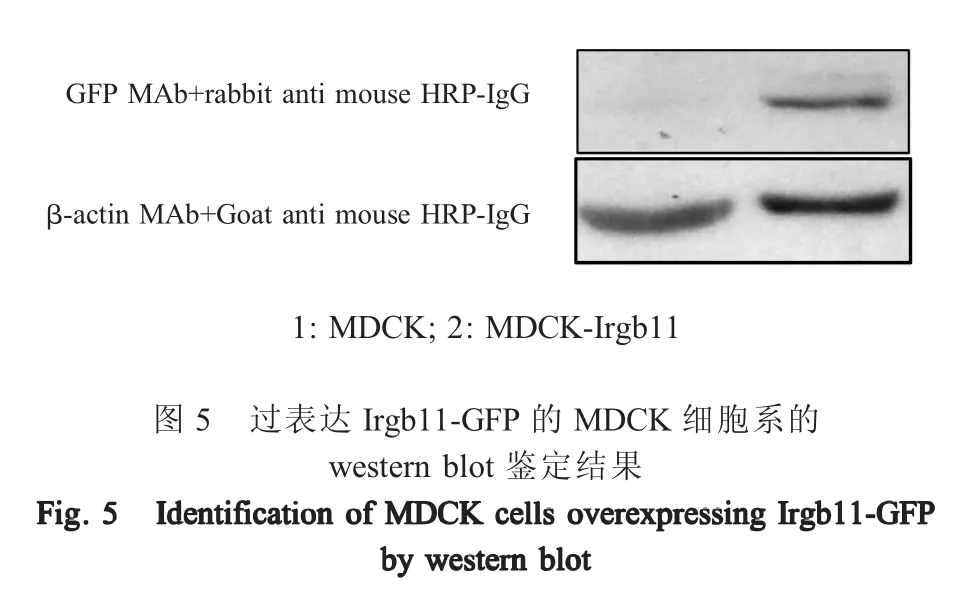
2.3 过表达Irgb11-GFP细胞系的构建与鉴定 采用经HEK293T细胞包装的表达Irgb11-GFP的慢病毒,感染MDCK细胞,48 h后经倒置荧光显微镜观察,可见细胞内有特异性绿色荧光(图4)。将该细胞经药物筛选后,采用流式细胞仪分选出表达绿色荧光蛋白的细胞,即获得Irgb11-GFP蛋白过表达的MDCK细胞,该细胞传10代每代均有特异绿色荧光出现。第5代细胞采用western blot鉴定MDCK-Irgb11细胞系中Irgb11-GFP的表达,结果显示,仅MDCK-Irgb11细胞裂解物中在84 ku处检测到蛋白条带,与预期Irgb11-GFP蛋白大小相符,而MDCK细胞无该特异条带(图5)。表明构建了Irgb11-GFP过表达的细胞系。
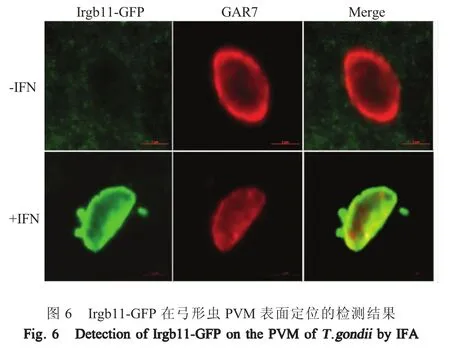
2.4 Irgb11在弓形虫PVM表面的定位检测结果采用IFA方法分别对Irgb11-GFP融合蛋白和弓形虫PLK株染色后,经共聚焦激光扫描显微镜观察显示,未经IFN-γ诱导的MDCK-Irgb11细胞内绿色荧光蛋白散在分布于细胞质中,未发生定位,而经IFN-γ诱导的MDCK-Irgb11细胞内有大量绿色荧光蛋白在弓形虫PLK株的PVM表面发生聚集(图6)。表明,融合蛋白Irgb11-GFP与PVM中的GAR7蛋白发生共定位,由于GAR7蛋白为弓形虫PVM的膜蛋白,由此表明Irgb11-GFP蛋白被募集至PVM上,即经IFN-γ诱导后的Irgb11蛋白能够定位于弓形虫PVM的表面。
3 讨论
本研究采用慢病毒包装载体系统,将Irgb11-GFP基因转入MDCK细胞基因组中,使其在细胞内稳定表达。这种新型的质粒转导技术可以将外源目的基因有效整合到宿主染色体中,转导效率高,表达量较高、表达稳定并且作用的宿主广泛,几乎可以感染任何类型的细胞,对于质粒载体转染效率低的细胞尤为适用[14]。但是,由于经细胞筛选培养后的Irgb11-GFP蛋白在MDCK细胞中表达量较少,在后续试验中检测Irgb11-GFP融合蛋白在弓形虫PVM表面定位时,观察到的荧光强度较弱,因此,本实验采用IFA对细胞内的Irgb11-GFP蛋白再染色,放大荧光信号,以便清晰观查到Irgb11-GFP蛋白在弓形虫PVM表面的定位情况。
Irgb11基因属于IFN-γ诱导的GTP酶基因家族,在鼠源细胞内的研究结果显示,其同源蛋白Irgb6经IFN-γ诱导后可以定位于弓形虫PVM表面,引导GBP、p62等多种蛋白定位于弓形虫PVM表面,进而共同导致弓形虫PVM的囊泡化,暴露出弓形虫体,并被宿主天然免疫机制识别并杀伤[15-16]。本研究通过过表达外源Irgb11蛋白,经IFN-γ诱导后,利用IFA对弓形虫PVM中的GAR7致密颗粒蛋白染色后经激光共聚焦检测Irgb11蛋白在弓形虫PVM的定位情况。结果显示,犬MDCK细胞中表达的Irgb11被募集到弓形虫PVM中与GAR7蛋白发生共定位,表明Irgb11与小鼠Irgb6有着相似的募集能力,可能发挥相似的抗弓形虫功能。据此推测,在犬源细胞内GKS类IRGs可能也被募集到弓形虫PVM的表面,形成“攻膜复合体”结构,但其抑制弓形虫生长的天然免疫机制还需要进一步研究。

