表达NDV HN和IBDV VP2融合蛋白的重组减毒沙门菌的构建及其生物学特性分析
贾艳艳,刘莎莎,丁 轲,何 雷,余祖华,李 静,郁 川,廖成水,程相朝,李银聚,殷月兰,张春杰*
(1.河南科技大学动物疫病与公共卫生重点实验室,河南洛阳471023;2.洛阳市活载体生物材料与动物疫病防控重点实验室,河南洛阳471023;3.江苏省人兽共患病学重点实验室,江苏扬州225009)
鸡新城疫(Newcastle disease,ND)是由ND病毒(ND virus,NDV)引起的一种急性和高度接触性传染病,而传染性法氏囊病(Infectious bursal disease,IBD)是由IBD病毒(IBD virus,IBDV)引起的一种急性传染性免疫抑制病,常常造成感染鸡群大量死亡或发病鸡群产肉、产蛋等生产性能下降[1-2]。在我国,鸡IBD与ND一直是困扰养禽业的重要疫病,针对这两种疾病,传统灭活疫苗和弱毒疫苗的应用仍然是主要的防控措施,但病毒变异株、超强毒株和新毒株的流行,导致传统疫苗免疫效果降低[3-4],因此研发防控ND和IBD的新型疫苗显得尤为迫切。血凝素 -神经氨酸酶(Hemagglutinin-neuraminidase,HN)是重要的囊膜蛋白,在NDV吸附侵入过程中发挥重要作用,VP2蛋白是IBDV的宿主主要保护性抗原。目前研究已证实HN蛋白和VP2蛋白是研制ND和IBD新型基因工程疫苗的靶基因[5-6]。
沙门菌是一类宿主谱广泛的兼性胞内寄生菌,近年来大量研究报道减毒沙门菌活载体递呈禽流感病毒(AIV)HA蛋白、NDV HN蛋白和猪传染性胃肠炎病毒(TGEV)N蛋白等病毒保护性蛋白可以诱导动物机体产生特异性免疫应答,从而抵抗病毒的感染[7-9]。因此,减毒沙门菌活载体疫苗因其可口服、同时递呈多个外源抗原及能够诱导黏膜、体液和细胞免疫应答,已被广泛应用于各种传染性疾病疫苗的研发[10-11]。沙门菌编码腺苷酸环化酶受体蛋白(cAMP receptor protein)的crp基因和编码环化腺苷酸合成酶的cya基因是沙门菌重要的毒力调节基因[12],asd基因编码的天冬氨酸β-半乳糖脱氢酶是沙门菌代谢过程中的一种重要酶[13]。国外大量研究表明缺失了crp和cya的沙门菌株毒力显著降低,但仍具有良好的侵袭力[14]。本实验室前期实验结果也证实了鼠伤寒沙门菌SL1344的crp和cya双突变株的毒力显著降低,可作为良好的口服疫苗载体[15]。因此,本研究以前期构建的沙门菌基因缺失株SL1344ΔcrpΔcyaΔasd为载体,构建了表达 NDV HN和 IBDV VP2融合蛋白的重组减毒鼠伤寒沙门菌(S.Typhimurium),以期为ND-IBD-鼠伤寒沙门菌病的三联口服疫苗研制提供实验数据。
1 材料与方法
1.1 主要实验材料S.typhimurium标准强毒株SL1344、 SL1344ΔcrpΔcyaΔasd、 pMD18-T-VP2 和pMD18-T-HN均由河南科技大学动物疫病与公共卫生重点实验室制备保存。pYA3493(asd+)及其宿主菌χ6097(araΔ(lac-pro)rpslΔasdA4Δ[zhf-2::Tn10]thiф80 d/lacZΔM15)由华中农业大学惠赠。
DNA聚合酶、DNA回收试剂盒、限制性核酸内切酶、DNA Marker、X-Gal、IPTG及T4 DNA连接酶均购自TaKaRa公司;生化鉴定试剂购自杭州-天和微生物试剂有限公司;鸡抗IBDV阳性血清和鸡抗NDV阳性血清购自中国兽医药品监察所;兔抗鸡IgG-HRP购自北京鼎国昌盛生物技术有限公司。1日龄健康三黄小公鸡购自河南省洛阳市第一种鸡场。
1.2 引物设计 根据GenBank中登录的NDV HN(JF343538)和IBDV VP2(AF508177)基因序列,设计相应特异性引物,在引物A2和A3的两端加入柔性氨基酸linker,并在A1和A4的两端分别引入BamHⅠ和HindⅢ酶切位点(表1)。以上引物由北京六合华大基因科技股份有限公司合成。
1.3 重组菌 SL1344ΔcrpΔcyaΔasd(pYA-HN-VP2)的构建及鉴定 以pMD18-T-VP2和pMD18-T-HN为模板,分别扩增HN及VP2基因片段,通过重叠延伸PCR技术(Splicing overlap extension by PCR,简称SOE-PCR)扩增HN-VP2融合基因片段。回收HNVP2片段,由北京华大基因科技股份有限公司测序。将回收纯化后的HN-VP2连接至质粒pYA3493,构建重组质粒pYA-HN-VP2,并对重组质粒进行酶切鉴定。
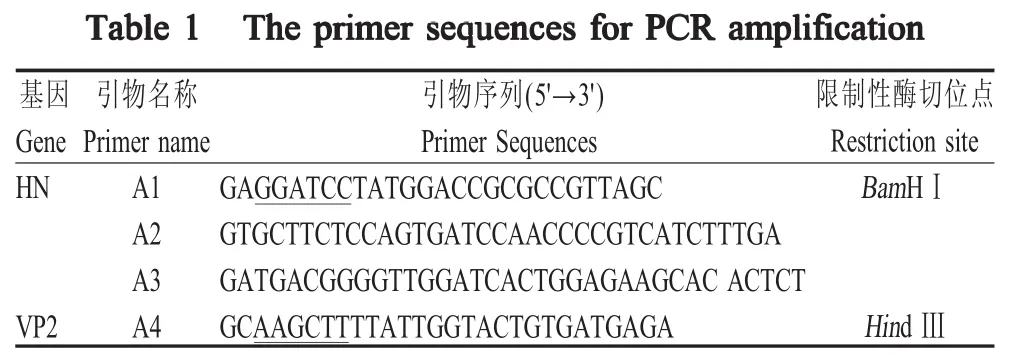
表1 PCR扩增所用的引物序列
将 100 μL SL1344ΔcrpΔcyaΔasd感受态细胞与10 μL pYA-HN-VP2混匀,冰浴30 min后电转化,将转化产物转移至无菌试管,加入1 mL SOC培养基,37℃恒温摇床培养2 h~3 h,取100 μL菌液涂布在LB固体平板上37℃过夜培养,次日挑取单菌落,利用引物A1/A4进行PCR鉴定,阳性菌株即为 重 组 菌 SL1344ΔcrpΔcyaΔasd(pYA-HN-VP2), 以下简称重组菌。
1.4 融合蛋白在减毒沙门菌中的表达 采用三氯乙酸(TCA)方法提取重组菌的分泌蛋白,分别以鸡抗IBDV阳性血清和鸡抗NDV阳性血清(1∶500)为一抗,兔抗鸡IgG-HRP(1∶2 000)为二抗,采用western blot分析融合蛋白的表达,同时设SL1344ΔcrpΔcyaΔasd(pYA)为对照。
1.5 重组菌的表型及生化鉴定 将重组菌分别接种至不含二氨基庚二酸(DAP)的LB培养基、含乳糖(Lac)、蔗糖(Suc)、葡萄糖(Glu)、麦芽糖(Mal)、甘露醇(Man)、鼠李糖(Rha)、山梨醇(Sor)、木糖(Xyl)和阿拉伯糖(Ara)的相应培养基中过夜培养,观察重组菌株的生长情况,并进行欧普氏试验(VP)、甲基红试验(MR)和三糖铁生化试验(H2S),同时设SL1344ΔcrpΔcyaΔasd(pYA)和野 生 株 SL1344 为 对照。
1.6 重组菌生长曲线的测定 将重组菌接种于LB培养基中37℃震摇培养12 h~14 h,取1 mL菌液用PBS洗涤2次后接种至4 mL LB培养基中调整OD600nm值至0.01,37℃振摇培养,分别间隔1 h收集菌液,测定其OD600nm值,绘制其生长曲线,同时设亲本株 SL1344ΔcrpΔcyaΔasd(pYA)和野生菌株SL1344为对照。
1.7 融合基因在重组菌中的遗传稳定性检测 将重组菌连续传70代。每隔10代利用引物A1和A4进行PCR鉴定,分析pYA-HN-VP2在重组菌株中的遗传稳定性。
1.8 重组菌对雏鸡的毒力试验 将重组菌的过夜培养物按1∶20转接LB培养基,37℃培养4 h后测定其OD600nm并调整至所需浓度。选取合适的稀释度,每只200 μL口服感染雏鸡,同时设置PBS组和野生菌SL1344组为对照,连续观察30 d,记录雏鸡的死亡情况,并进行Bliss分析测定重组菌对雏鸡的LD50。
1.9 数据分析 应用SPSS16.0软件对试验数据进行分析,t检验对所得数据进行统计学分析,并应用GraphPad Prism 5.0软件作图。
2 结果
2.1 重组质粒pYA-HN-VP2的构建与鉴定 以pMD18-T-HN及pMD18-T-VP2为模板,PCR扩增HN基因和VP2基因。以回收纯化的HN及VP2基因片段为模板进行SOE-PCR扩增,结果显示得到约2 300 bp的融合片段(图略),测序鉴定结果显示其与预期一致。重组质粒pYA-HN-VP2酶切鉴定结果显示,单酶切结果得到5 500 bp的条带,双酶切分别得到约3 200 bp的载体条带和2 300 bp的目的条带,与预期相符(图1)。表明重组质粒pYA-HNVP2已正确构建。

2.2 重组菌的PCR鉴定 将重组质粒pYA-HNVP2电转化至减毒沙门菌,对重组菌株进行PCR鉴定,结果显示扩增获得了约2 300 bp的目的条带(图2),与预期相符。表明获得了重组菌SL1344ΔcrpΔcyaΔasd(pYA-HN-VP2)。

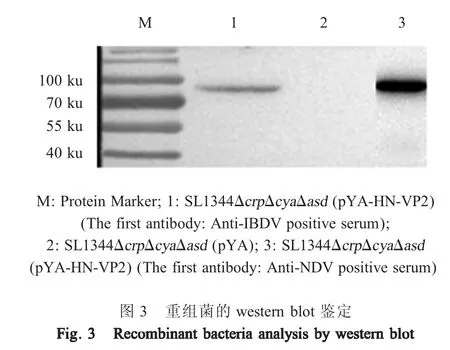
2.3 融合蛋白在重组菌中的表达及鉴定 收取重组菌 株 SL1344ΔcrpΔcyaΔasd(pYA-HN-VP2)和 SL1344 ΔcrpΔcyaΔasd(pYA)的上清,分别进行 western blot鉴 定 , 结 果 显 示 重 组 菌 株 SL1344ΔcrpΔcyaΔasd(pYA-HN-VP2)在84 ku处有明显的目的条带(图3),SL1344ΔcrpΔcyaΔasd(pYA)则无目的条带。表明该重组沙门菌可分泌表达HN-VP2融合蛋白,且表达产物具有反应原性。
2.4 重组菌的表型及生化鉴定 重组菌SL1344 ΔcrpΔcyaΔasd(pYA-HN-VP2)表型检测结果显示,该菌在不含DAP的LB平板上可以正常生长,表明重组质粒pYA-HN-VP2可以产生DAP供给SL1344 ΔcrpΔcyaΔasd生长。糖酵解试验结果显示,该重组菌的生化特性与SL1344ΔcrpΔcyaΔasd基本一致,但与野生菌株SL1344相比,失去了利用麦芽糖、甘露醇、山梨醇、鼠李糖及木糖等的能力,这与CRP在碳源代谢产物抑制过程中起重要作用有密切关系[16]。而H2S、MR和VP实验结果显示重组菌与野生菌株SL1344一致。
2.5 重组菌的生长性能测定 对重组菌、缺失菌SL1344ΔcrpΔcyaΔasd(pYA)及野生菌 SL1344 进行生长性能测定,结果显示重组菌株 SL1344ΔcrpΔcyaΔasd(pYA-HN-VP2)与 SL1344ΔcrpΔcyaΔasd(pYA)株的生长速度基本保持一致,但慢于野生菌株(图4),表明cya和crp基因的缺失可能导致细菌摄取碳源减少[17],从而显著影响了鼠伤寒沙门菌的生长速度。

2.6 重组菌的遗传稳定性检测 将重组菌SL1344 ΔcrpΔcyaΔasd(pYA-HN-VP2)连续传代,利用 PCR检测其遗传稳定性,结果显示其第10、20、30、40、50、60、70代的重组菌株均可以扩增出约2 300 bp的目的条带(图5),表明HN-VP2基因片段可以在重组沙门菌中稳定遗传。

2.7 重组菌对雏鸡的毒力试验 将重组菌口服感染雏鸡后,连续观察30 d,统计雏鸡的死亡情况,结果显示,通过Bliss方法计算野生菌株SL1344对雏鸡的 LD50为 2.28×105cfu,而重组菌株 SL1344ΔcrpΔcyaΔasd(pYA-HN-VP2)口服感染最高剂量(4.57×1010cfu)的雏鸡均未发生死亡,重组菌株的毒力较SL1344下降了至少5个对数单位(表2)。表明利用SL1344ΔcrpΔcyaΔasd构建的重组菌株 SL1344ΔcrpΔcyaΔasd(pYA-HN-VP2)更加安全。
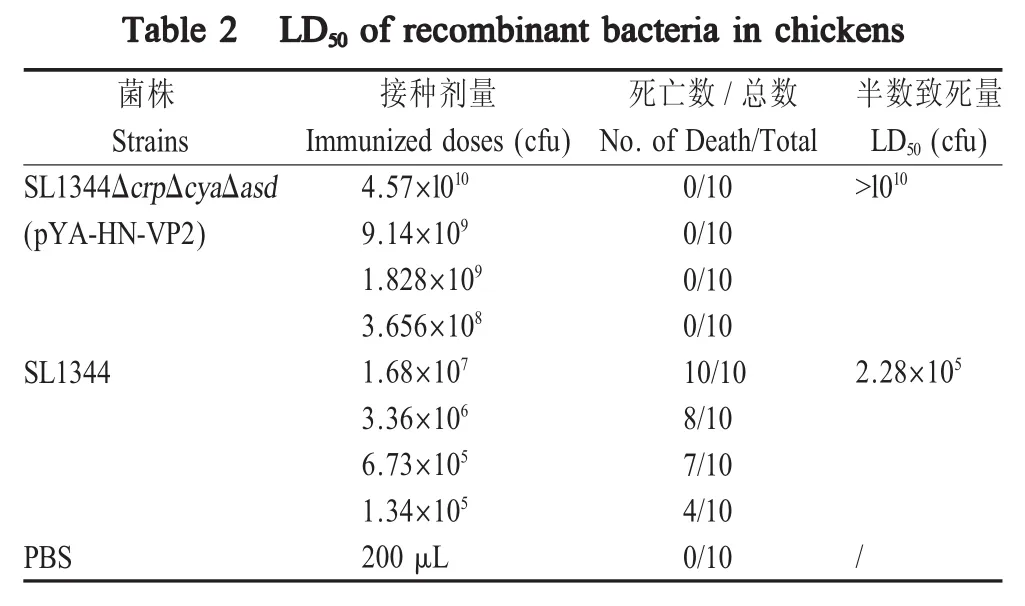
表2 重组菌株对雏鸡的LD50测定结果
3 讨论
研究显示减毒沙门菌经口服免疫后可以定居在肠道相关淋巴组织,刺激抗原提呈细胞活化增殖,从而快速启动机体产生特异性粘膜免疫、体液及细胞免疫应答,因此其在众多候选疫苗载体中具有潜在的应用价值[18]。此外,沙门菌能够同时表达多种外源抗原,可为开发安全、廉价、便于使用的多价口服疫苗提供新思路。
ND和IBD是严重危害养禽业的两大动物疫病。传统疫苗虽然能降低ND的死亡率和发病率,但对目前流行株基因Ⅶ型NDV交叉保护力低,且存在毒力返强的风险,因此亟需研发与当前流行株基因型匹配的NDV疫苗[4]。IBDV具有易变异、毒力返强的特点,大量研究表明传统疫苗已不能阻断IBDV新病毒株的传播[19]。本研究将NDV HN基因和IBDV VP2主要抗原基因片段(99 bp~663 bp)[20]融合后,构建了能够分泌表达NDV HN和IBDV VP2融合 蛋 白 的 重 组 减 毒 沙 门 菌 SL1344ΔcrpΔcyaΔasd(pYA-HN-VP2)。
质粒平衡致死载体系统是解决外源质粒不能稳定遗传的有效途径[21]。asd基因编码的天冬氨酸β-半乳糖脱氢酶是DAP生物合成途径中的必需酶,而DAP是革兰氏阴性菌细胞壁中肽聚糖四肽尾的组成部分,asd突变株在无外源DAP条件下不能生存[22]。本研究将含asd基因的互补质粒pYA-HN-VP2导入鼠伤寒沙门菌SL1344的crp、cya、asd基因缺失株,表型鉴定结果显示构建的重组菌可以在不添加DAP的平板上正常生长,表明重组菌与质粒形成了质粒平衡致死载体系统。该系统不但避免了抗生素选择压力,而且可以解决质粒丢失及外源基因表达不稳定等问题,在临床应用中显示出巨大优势。本研究中遗传稳定性实验结果显示重组菌SL1344ΔcrpΔcyaΔasd(pYA-HN-VP2)传至第70代,仍可以稳定遗传重组质粒pYA-HN-VP2。
为了保证融合基因编码的蛋白质正确折叠,活性互不影响,一般选择富含疏水性的柔性氨基酸接头(linker)连接融合基因。由这些氨基酸组成的接头序列,活动度较好,可以使各自蛋白折叠成天然构象,保证生物学活性互不影响[23-24]。因此,为了获取具有生物学活性的HN-VP2融合蛋白,本研究在设计引物时,在HN基因下游引物和VP2上游引物之间加入了氨基酸接头(G-S-G-G-S-G),然后通过SOEing PCR将HN基因和VP2基因进行融合,并且western blot结果显示分泌表达的融合蛋白HN-VP2具有良好的免疫反应性。同时,毒力试验结果显示该重组减毒沙门菌 SL1344ΔcrpΔcyaΔasd(pYA-HNVP2)的毒力较野生株SL1344相比下降了至少5个对数单位,表明该重组减毒菌株安全性高,为临床应用奠定了基础。
综上所述,本实验正确构建了分泌表达HN-VP2融合蛋白的重组减毒沙门菌,安全性好,遗传稳定,重组菌株的免疫应答能力和保护力效果评价需要后续实验进一步研究。本研究为开发ND和IBD的新型口服活载体候选疫苗株奠定重要基础,又为鸡ND和IBD和沙门菌病的防控提供新策略。

