肠内营养对老年慢性心力衰竭患者营养状态及胰岛素样生长因子-1、C反应蛋白、白细胞介素-6的影响
张由建 范卫东 周华颖
(1河南省胸科医院,河南 郑州 450003;2河南省通许县中医院)
慢性心力衰竭(CHF)是由于多种心血管疾病发展,使心脏结构或功能异常,心排血量降低,肺循环及体循环发生淤血的一种临床综合征,是心血管疾病发展到终末阶段的一种表现〔1〕。长期的肺循环、体循环淤血,可造成食欲下降、无法进食等症状,随病程的发展多数患者出现营养不良、负氮平衡状态,且在老年患者中更为多见。长期营养不良,供应心肌的能量不足,单纯提高心肌动力,其结果只能是日益加重,预后不良。CHF发病机制以内皮功能失调、炎症反应异常、肾素血管紧张素醛固酮系统失衡等为主〔2〕,炎症反应贯穿CHF疾病发生、发展全过程,心肌细胞死亡后,以心肌纤维细胞代替,是心力衰竭发展的主要病理过程〔3〕,导致心肌收缩能力减弱,心功能降低。血清中胰岛素样生长因子(IGF)-1对血管平滑肌增殖具有促进作用,促进侧支循环建立,改善心肌细胞供血供氧,减少局部心肌缺血,抑制心肌细胞凋亡,修复坏死心肌细胞〔4〕,但上述过程均需要机体营养物质参与,营养不良可影响炎症细胞清除作用或抑制作用降低。监测营养不良CHF患者的IGF-1及相关炎症因子水平,有助于提高治疗效果,改善预后〔5,6〕。本文拟进一步验证肠内营养支持疗法对CHF患者营养状态、炎症指标及心功能的改善情况。
1 资料与方法
1.1临床资料 选取2016年1月至2017年1月收治的老年CHF患者134例,入选标准:①既往有明确心血管疾病史;②符合纽约心脏病学会(NYHA)心功能分级Ⅱ~Ⅳ级;③有典型左心功能不全症状;④心脏彩超提示左室射血分数(LVEF)<40%;⑤营养风险筛查2002量表(NRS)评分≥3分。排除标准:①代谢性疾病及甲状腺疾病史;②入院前3个月内患有急慢性感染性疾病;③伴有先心病或房室传导阻滞等心律失常疾病;④肝肾功能不全、精神障碍、恶性肿瘤及血液系统疾病;⑤入院前已使用营养调节疗法治疗;⑥入院时诊断或伴有急性心肌梗死、心源性休克等;⑦自身免疫性疾病。采用信封法随机分为研究组与对照组,每组67例。本研究取得患者或家属同意,并签订知情同意书,并由医院医学伦理委员会批准。两组临床资料差异无统计学意义(均P>0.05),具有可比性,见表1。

表1 两组临床资料比较(n,n=67)
1.2方法 入院后均给予常规纠正心力衰竭治疗,主要包括利尿、扩张血管减轻心脏负荷;吸氧缓解机体缺氧症状;强心加强心肌收缩力等。研究组在常规治疗基础上给予肠内营养支持疗法,营养剂主要采用整蛋白型肠内营养剂(粉剂)(商品名:能全素;批准文号:国药准字H20030467;厂家:纽迪希亚制药(无锡)有限公司;规格:320 g/听)、肠内营养乳剂(商品名:瑞能;批准文号:国药准字H20040722;厂家:华瑞制药有限公司;规格125 g/袋)等,根据患者胃肠耐受情况调整摄入量,必要时加入其他流质或半流质饮食,保持能量20 kCal/(kg·d),热量密度1 kCal/ml,不愿或无法口服者给予鼻饲供给。供给前以50 ml生理盐水冲洗管道。老年胃肠功能减弱且合并CHF,故延长治疗疗程为1个月为1个疗程。对照组在常规治疗基础上给予限盐、限水自愿饮食,随患者意愿自由饮食。
1.3观察指标 所有患者于治疗前及治疗1个疗程行营养状态评分测定,参照营养不良-炎症评分量表进行〔7〕,最高分10分,得分越高营养不良程度越严重。测定治疗前后清晨排便后体重及身高,以计算体重指数(BMI),以皮褶厚度测定三头肌皮褶厚度(TSF);以软皮尺测量上臀肌围(AMC);抽取空腹肘静脉血液标本送检,测定血清总蛋白(TP)、白蛋白(ALB)、前白蛋白(PA)含量及白细胞介素(IL)-6、C反应蛋白(CRP)、总IGF-1含量,以评定治疗前后营养状况及炎症水平。同时以心脏彩色多普勒超声测定左室舒张末期内径(LVEDD)、左室收缩末期内径(LVESD),计算LVEF、每搏输出量(SV)、心输出量(CO),并行6 min步行实验,以评定心功能情况。各检测项目均由同组医师完成,检验项目严格按照说明书操作,以降低人为误差。治疗期间详细记录两组不良事件或并发症发生情况。
1.4统计学方法 采用SPSS19.0软件进行χ2检验、t检验。
2 结 果
2.1两组治疗前后营养状况评分及相关指标比较 两组治疗前营养状况评分及相关指标差异无统计学意义(P>0.05);两组治疗后各项指标与治疗前比较差异有统计学意义(P<0.05),且研究组治疗后营养状况评分显著低于对照组(P<0.05),其他各项指标均显著高于对照组(P<0.05),见表2。
2.2两组治疗前后IGF-1及相关炎症因子比较 两组治疗前IGF-1、IL-6、CRP水平差异无统计学意义(P>0.05),治疗后两组均显著低于同组治疗前,且研究组显著低于对照组(均P<0.05),见表3。

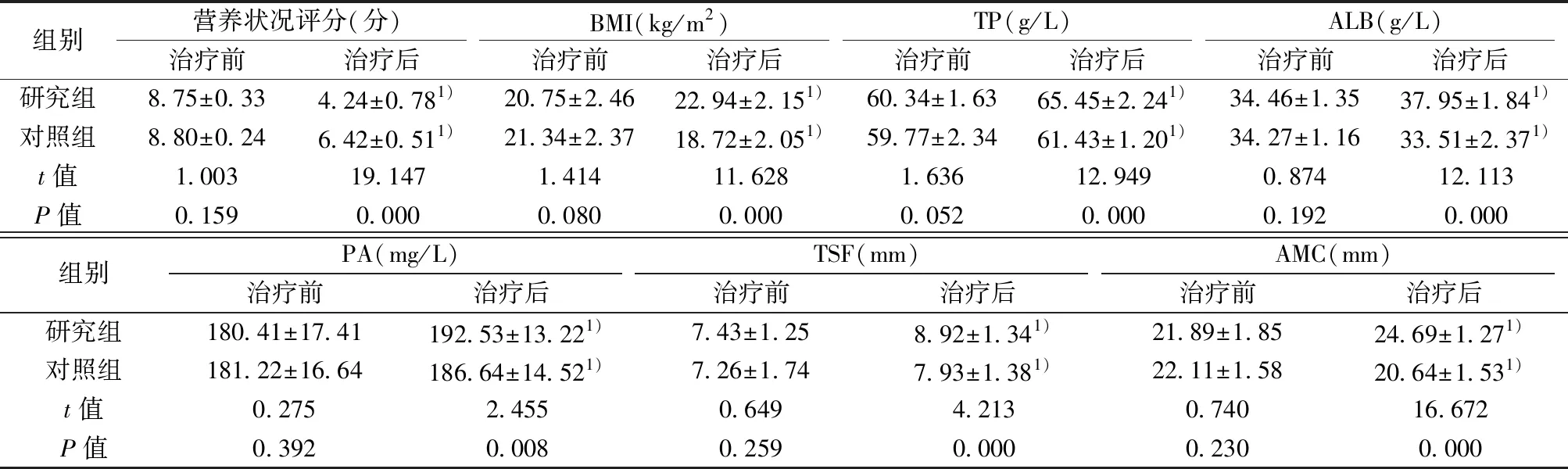
组别营养状况评分(分)治疗前治疗后BMI(kg/m2)治疗前治疗后TP(g/L)治疗前治疗后ALB(g/L)治疗前治疗后研究组8.75±0.334.24±0.781)20.75±2.4622.94±2.151)60.34±1.6365.45±2.241)34.46±1.3537.95±1.841)对照组8.80±0.246.42±0.511)21.34±2.3718.72±2.051)59.77±2.3461.43±1.201)34.27±1.1633.51±2.371)t值1.00319.1471.41411.6281.63612.9490.87412.113P值0.1590.0000.0800.0000.0520.0000.1920.000组别PA(mg/L)治疗前治疗后TSF(mm)治疗前治疗后AMC(mm)治疗前治疗后研究组180.41±17.41192.53±13.221)7.43±1.258.92±1.341)21.89±1.8524.69±1.271)对照组181.22±16.64186.64±14.521)7.26±1.747.93±1.381)22.11±1.5820.64±1.531)t值0.2752.4550.6494.2130.74016.672P值0.3920.0080.2590.0000.2300.000
与同组治疗前比较:1)P<0.05;同表3,表4


组别IGF-1(ng/ml)治疗前治疗后IL-6(pg/ml)治疗前治疗后CRP(mg/L)治疗前治疗后研究组238.76±26.14207.17±37.881)224.28±19.52165.48±18.351)12.10±2.698.34±2.051)对照组241.62±29.25215.21±36.371)220.56±18.67190.48±17.941)12.57±8.139.10±2.381)t/P值0.597/0.2769.173/0.0001.127/0.1317.974/0.0000.440/0.3301.980/0.025
2.3两组治疗前后心功能指标比较 两组治疗前各项心功能指标对比差异无统计学意义(P>0.05),治疗后与同组治疗前对比差异有统计学意义(P<0.05);研究组治疗后LVEF、CO、SV及6 min步行距离显著高于对照组(P<0.05),LVEDD、LVESD显著低于对照组(P<0.05),见表4。


组别LVEF(%)治疗前治疗后LVEDD(mm)治疗前治疗后LVESD(mm)治疗前治疗后研究组44.31±4.5854.16±4.251)55.73±5.1951.46±4.571)44.75±5.3438.12±4.381)对照组45.23±4.6948.76±3.621)56.08±4.1553.55±4.211)44.62±5.4840.13±4.93t/P值1.149/0.1267.917/0.0000.431/0.3332.753/0.0030.139/0.4452.495/0.007组别CO(ml/次)治疗前治疗后SV(ml/次)治疗前治疗后6 min步行距离(m)治疗前治疗后研究组3.46±0.575.02±0.721)37.59±5.2145.82±6.731)325.34±56.82398.42±59.221)对照组3.54±0.484.36±0.371)38.44±6.2441.62±5.691)346.83±60.37364.14±58.621)t/P值0.879/0.1916.674/0.0000.856/0.1973.901/0.0002.122/0.0183.367/0.000
2.4两组治疗期间不良事件及并发症发生情况比较 两组治疗期间均未见死亡患者,其中研究组见食道反流2例,腹胀、腹泻或腹痛3例,误吸、电解质紊乱各1例,给予调整营养方案后症状消失;对照组食道反流4例,尿潴留2例,不完全性肠梗阻1例,腹胀、腹泻或腹痛9例,误吸2例,电解质紊乱2例。两组并发症发生率差异有统计学意义(P<0.05)。
3 讨 论
随着我国人口老龄化及生活习惯的改变,心血管疾病发病率日益升高,因心血管疾病导致的死亡发生率也逐年增高,已成为严重的社会问题〔8〕。心血管疾病随着时间的延长必然形成心肌损伤、心脏解剖结构重塑及相应神经内分泌水平异常等,最终导致死亡。最新研究显示,CHF发展过程中,除心脏解剖结构重塑及相应神经内分泌水平异常外,心肌能量代谢途径也可发生改变〔9,10〕。心肌能量代谢异常又可加速心肌重塑,增加心肌缺血、缺氧进程,导致恶性循环,使肺循环及体循环淤血加重,增加胃肠道负担,引发厌食、恶心、少食等临床症状,故CHF患者多存在营养不良。营养不良又使心肌能量不足,心肌收缩能力减弱,加重CHF临床症状,故可认为CHF患者是多种恶性循环共同结果导致〔11,12〕。老年患者各脏器功能均存在不同程度衰退,胃肠也不例外,多存在胃酸分泌功能下降、胃肠蠕动缓慢、排空时间延长、胃动力不足、不同程度消化、吸收功能障碍等特点〔13,14〕。CHF发生、发展过程均有炎症反应、机体应激反应参与,可促使糖皮质激素分泌量增加,儿茶酚胺类物质合成、释放加速,使机体处于高分解代谢状态,引发负氮平衡〔15〕,加速心力衰竭恶化,降低患者免疫功能,增加并发症发生风险,而炎症状态伴随CHF全过程,营养不良是否会加速CHF进程,已引起众多学者关注〔16〕。
本研究结果显示,CHF患者给予肠内营养可改善机体营养状态及炎症状态,且对心功能具有改善作用。炎症因子是引发心肌损伤的主要原因,心肌损伤产生的连锁激动可直接影响心脏血流动力学,甚至参与心室重塑过程,进而导致心功能降低。肠内营养支持疗法改善患者营养状态,提高患者免疫力,减少炎症因子产生,促进炎症因子代谢,减少心肌损伤。老年CHF患者均存在不同程度营养不良,机体处于负氮平衡及代谢紊乱状态,加速CHF进程。肠内营养支持疗法可改善负氮平衡及代谢紊乱状态,阻断恶性循环,达到改善CHF进程作用〔17〕。老年人均存在不同程度胃肠功能障碍,患有CHF可导致胃肠淤血,影响正常饮食,甚至导致肠道黏膜脱落,肠内营养支持疗法可预防肠内正常菌群过度繁殖、内毒素移位等,进而阻断肠衰竭、毒血症及败血症,避免多器官衰竭发生,降低治疗难度〔18〕。肠内营养支持改善肠道功能,使机体营养供需达到动态平衡状态,提供心肌收缩所需的能量,辅助达到改善心肌收缩力的目的。肠内营养支持通过口腔或鼻饲给予,一方面可刺激胃肠道蠕动,促进胃肠道功能恢复;另一方面较静脉营养支持而言,不通过静脉给予液体,不增加肺循环、体循环淤血,避免加重心脏负担〔19〕。肠内营养液富含维生素及少量膳食纤维,维生素有改善机体代谢、提高免疫、清除自由基及抗氧化等功能,同样可达到抗炎作用。而且膳食纤维有促进消化吸收、促进肠蠕动、改善肠道保护功能。本研究结果还显示,合理有效的肠内营养支持可降低心肌细胞损伤,降低并发症发生率,改善预后。相关文献显示,心力衰竭确诊后1年内病死率高达40%左右〔20〕。本研究存在一定缺陷,未对患者进行远期随访,未对患者远期心室重塑等进行研究。
综上,肠内营养支持可改善老年CHF患者营养状态,降低IGF-1、CRP、IL-6水平,提高心功能,达到提高治疗效果的目的。

