纳米银的制备与表征*
唐晓丹,魏金超,高玉梅,陈芮
(1.云南师范大学 化学化工学院,云南 昆明 650500;2.中国科学院 化学研究所,北京 100190)
纳米银是指粒径在1~100 nm之间的微小单质银颗粒.纳米银具有宏观量子隧道效应、体积效应、量子尺寸效应及表面效应等特性[1-2],这些特征赋予其独特的催化、光学及电学性质,因而被用作防静电材料[3]、低温导热材料、光学材料、抗菌材料、医用材料[4]、催化剂及电子元器件[5]等.纳米银广泛的应用价值使其成为物理学、化学、材料学及生物学等领域的研究热点之一.
制备纳米银的方法很多,包括物理法、化学法以及微生物法等.其中物理法包括激光灼烧法、机械研磨法和辐射法,这些方法原理简单、产品纯净且质量好,但生产成本高且粒径大.生物法包括天然材料制备法和微生物体系法,这类方法绿色环保.化学法包括化学还原法、光化学还原法、电化学法、超声波化学法和微乳液法[4]等.化学法成本较低且操作简单,能控制纳米银的粒径大小和粒度分布范围,可得到均匀稳定的晶型结构[1,4],是制备粒径可控金属纳米颗粒的首选方法.王迎春等[1]以十二烷基硫酸钠做稳定剂,用抗坏血酸还原硝酸银制备了平均粒径为30 nm的球形纳米银.腾乐金等[6]用氨水-甲酸铵在十二烷基硫酸钠存在的条件下还原硝酸银,制得颗粒均匀且平均粒径为35.4 nm的球形纳米银.张治等[7]以一定比例的NaBH4和C6H5Na3O7的混合液为还原剂,聚乙烯吡咯烷酮(PVP)为稳定剂,硝酸银为银源,得到了3~4 nm、5~7 nm、26~30 nm和45~50 nm的球形纳米银.通过调节硝酸银和硼氢化钠的用量能够实现纳米银粒径的可控制备.王洪超等人[8]以柠檬酸、PVP和十二烷基三甲基溴化铵为吸附剂,用十六烷基三甲基溴化铵还原硝酸银,制得了分散均匀的片状纳米银粉.此外,还有以PVP为稳定剂,在氨水存在时用过氧化氢还原银离子来制备纳米银的报道[9].
尽管纳米银的制备方法较多,但这些制备工艺中依然存在纳米银粒径失控、粒度分布广和结晶不完全等问题.本文研究了以硼氢化钠为还原剂,将银从他的配合物、盐的有机体系或溶液中还原成微小的银单质[10]的最佳条件.
1 实验部分
1.1 试剂与仪器
1.1.1 试剂
硝酸银、氨水和PVP均为市售分析纯.
1.1.2 仪器
UV-8000S型紫外可见分光光度计(上海元析仪器有限公司);JEM-2100型透射电子显微镜(日本电子株式会社);ALPHA-Ⅱ型红外光谱仪(德国布鲁克·道尔顿公司).
1.2 实验方法
常温下,将量取的PVP溶液和AgNO3溶液置于磁力搅拌器上以10 r/min的转速搅拌2 h,至其混合均匀.滴加NaBH4至溶液呈亮黄色.在-0.6 Mpa,50 ℃下,蒸干亮黄色溶液,并于40 ℃下真空干燥样品,即可得到红棕色的纳米银粉.
2 结果与讨论
2.1 实验条件的探究
纳米颗粒的紫外特征吸收峰的位置、半峰宽及强度与其粒径、粒度分布和浓度有关[11].纳米颗粒的粒径可以通过其紫外特征吸收峰的位置确定.若特征吸收峰红移,表明纳米颗粒的粒径变大,反之粒径变小.若特征吸收峰的半峰宽较宽,表明纳米颗粒的粒度分布范围宽,反之粒度分布范围窄.通过特征吸收峰的强度,可以判断纳米颗粒的浓度.
2.1.1 硝酸银浓度对纳米银紫外吸收特性的影响
图1是PVP溶液和NaBH4溶液浓度不变时,改变AgNO3的浓度制得的纳米银的紫外-可见吸收光谱.结果表明:样品在400 nm附近均有特征吸收峰.当AgNO3浓度依次从0.01 mol/L增大到0.04 mol/L时,纳米银的特征吸收峰先蓝移后红移.AgNO3浓度为0.02 mol/L时,纳米银的特征吸收峰的波长和半峰宽均小.表明:此时制得的纳米银粒径小且粒度分布范围窄.当AgNO3浓度为0.03 mol/L时,纳米银的特征吸收峰的强度较大,表明纳米银的浓度较大.当AgNO3浓度为0.04 mol/L 时,纳米银的特征吸收峰的波长和半峰宽均变大,表明此时的纳米银粒径大、粒度分布范围宽.综上所述,AgNO3浓度为0.02 mol/L时,纳米银的粒径最小,粒度分布范围窄.

图1 AgNO3浓度对纳米银紫外吸收特性的影响(PVP浓度3%,NaBH4浓度0.01%)Fig.1 Effect of the concentration of AgNO3 on UV-Vis absorption spectrum of silver nanoparticles at 3% PVP and 0.01% NaBH4
2.1.2 硼氢化钠浓度对纳米银紫外吸收特性的影响
图2是AgNO3浓度和PVP浓度不变时,改变NaBH4浓度时制得的纳米银的紫外-可见吸收光谱.当NaBH4浓度依次从0.005%增加到0.03%时,纳米银的特征吸收峰先红移再蓝移.当NaBH4浓度为0.005%时,特征吸收峰的波长最小、半峰宽大、吸收峰的强度小,此时的纳米银粒径小、粒度分布广且浓度低,该浓度不适用于生产.NaBH4浓度从0.01%增加到0.02%时,纳米银的特征吸收峰红移,半峰宽增大、强度也增大,表明此时纳米银的粒径变大,粒度范围变宽.当NaBH4浓度为0.03%时,纳米银的特征吸收蓝移,特征吸收峰的强度大且半峰宽小,表明此时的纳米银的粒径最小且粒度范围窄.综合以上的分析,NaBH4浓度为0.03%时,可制得粒径小且粒度分布范围小的纳米银.
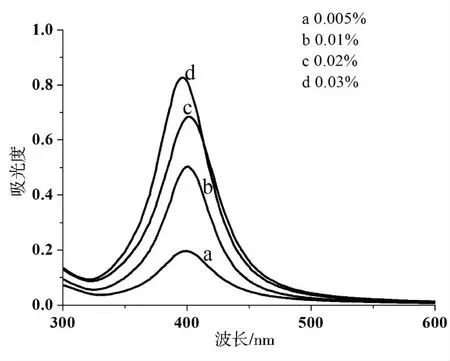
图2 NaBH4浓度对纳米银紫外吸收特性的影响(PVP浓度3%,AgNO3浓度0.02 mol/L)Fig.2 Effect of the concentration of sodium borohydride on UV-Vis absorption spectrum of silver nanoparticles at 3% PVP and 0.02 mol/L AgNO3
2.1.3 PVP浓度对纳米银紫外吸收特性的影响

图3 PVP浓度对纳米银紫外吸收特性的影响(AgNO3浓度0.02 mol/L,NaBH4浓度0.01%)Fig.3 Effect of the concentration of sodium borohydride on UV-Vis absorption spectrum of silver nanoparticles at 0.02 mol/L AgNO3 and 0.01% NaBH4
图3是AgNO3浓度和NaBH4浓度不变,改变PVP浓度时纳米银的紫外吸收曲线.随着PVP浓度的增大,纳米银的紫外特征吸收峰先蓝移再红移.PVP的浓度从2%增大到3%,纳米银的特征吸收峰稍有红移,特征吸收峰的强度接近,表明此时纳米银的粒径最小.PVP为4%时,纳米银特征吸收峰的强度增大、半峰宽变小,表明此时纳米银浓度大,粒度分布范围窄.这是因为低浓度的PVP不能有效地阻止纳米银的团聚;若PVP浓度过大,PVP会聚合在一起,导致包裹的纳米银发生团聚、粒径变大.因此,PVP的量要适宜.总之,当PVP为2%时,纳米银的粒径小、粒度分布范围小.
综上所述,制备粒径小且粒径分布窄的纳米银的最佳条件为:AgNO3浓度0.02 mol/L,NaBH4浓度0.03%及PVP浓度2%.
2.2 纳米银的形貌表征
图4是在0.02 mol/L AgNO3和30 mL 2%PVP的混合液中滴入0.03% NaBH4制得纳米银的电镜图.由图可知制得的纳米银分散均匀,基本呈球形且粒径在2~3 nm.当AgNO3和PVP的用量从10 mL增加到30 mL时,纳米银的粒径从10~15 nm变为2~3 nm.因此,通过改变AgNO3和PVP的用量可以实现纳米银粒径的可控制备.

图4 纳米银的电镜图Fig.4 TEM of Silver Nanoparticles
3 结 论
以PVP为稳定剂,硼氢化钠还原法制备粒径小且粒径分布窄的纳米银的最佳条件为:0.02 mol/L AgNO3,0.03% NaBH4,2%PVP.此条件下制得的纳米银分散均匀,基本呈球形;通过改变AgNO3、NaBH4和PVP三者的浓度,能实现纳米银粒径的可控制备.

