抗体分型检测对幽门螺杆菌感染的诊断价值*
邹蕊霞,褚传莲,张琳璐,张艳敏,王凤霞,李芳,左芳
(1.山东大学附属济南市中心医院 保健消化科,山东 济南 250013;2.济南大学 山东省医学科学院医学与生命科学学院,山东 济南 250200)
幽门螺杆菌感染(helicobacter pylori, Hp)作为慢性胃炎、消化性溃疡及胃癌的主要致病因素已被普遍认可,其被世界卫生组织归类为I类致癌物[1]。 目前临床常用的非侵入性检测方法为尿素呼气试验(urea breath test, UBT)和血清抗体检测,但两者结果时常会出现不一致。本研究旨在探讨山东地区Hp感染情况及其高危因素,并对抗体分型检测和UBT诊断Hp感染的价值进行分析。探讨两者检查结果出现差异的原因,进一步提高临床诊断Hp的准确性,指导临床工作。
1 资料与方法
1.1 一般资料
选取2010年7月—2010年12月在山东大学附属济南市中心医院进行Hp抗体分型检测的462例受试者,根据抗体分型分为Ⅰ型202例(Ⅰ型组)、Ⅱ型104例(Ⅱ型组)和对照组156例。其中,男性279例,女性183例;平均年龄(60.04±18.86)岁。观察指标:①收集受试者的基本信息,如年龄、性别、是否吸烟、饮酒、有无冠状动脉粥样硬化性心脏病(以下简称冠心病)、糖尿病、高血压、反流性食管炎、糜烂性胃炎、阑尾炎、胃溃疡、胃癌、息肉及结直肠癌等疾病史;②山东地区Hp感染率及常见感染类型;③Hp抗体不同分型患者中UBT检测结果。排除标准:严重的肝肾功能不全,免疫系统疾病;妊娠妇女;正进行Hp根除及根除后<1个月,以及进行Hp抗体分型检测和UBT前1个月内使用抗生素或者质子泵抑制剂。
1.2 试剂与仪器
Hp试剂盒购于北京誉美康医疗器械有限公司,尿素胶囊购于上海欣科医药有限公司,Hp检测仪购于安徽养和医疗器械设备有限公司。
1.3 方法
462例受试者清晨空腹采集静脉血2~3 ml,分离血清,操作遵照试剂盒说明书进行。酶联免疫吸附法检测血清Hp免疫球蛋白G(immunoglobulin G, IgG)抗体,包括抗Vac A、抗Cag A、抗UreA及抗UreB抗体。根据Hp抗体分型检测结果将Vac A和/或Cag A阳性分为Ⅰ型,仅Ure B和/或Ure A阳性分为Ⅱ型,Vac A、Cag A、UreA及UreB均为阴性作为对照组。其中97例受试者Hp抗体分型检测前后1周内行UBT,早晨空腹及禁食3 h后进行,温凉饮用水(20 ml)服用1粒尿素胶囊,静坐15~20 min,将呼气卡取出,沿呼气口向卡内进行2~5 min的呼气,直至卡上指示窗的颜色由蓝转白;将呼气卡检测窗口上的封签揭去,将呼气卡插入Hp检测仪中,取得每分钟衰变数(DPM/mmol),阴性:DPM<99;阳性: DPM>149。
1.4 统计学方法
数据分析采用SPSS 18.0统计软件。计数资料以构成比或率(%)表示,比较用χ2检验;影响因素的分析采用多元Logistic回归模型,P <0.05为差异有统计学意义。
2 结果
2.1 山东地区Hp总感染率
山东地区Hp总感染率为66.2%。其中,Ⅰ型Hp感染率为43.7%,最常见抗体分型为CagA、VacA、UreA及UreB均为阳性;其次为CagA、UreB阳性,感染率分别为22.1%和11.3%。Ⅱ型Hp感染率为22.5%,最常见抗体分型为UreB阳性,其感染率为16.5%;其次为UreA、UreB阳性或UreA阳性,感染率分别为4.3%和1.7%。
2.2 各组Hp抗体分型基线资料比较
各组年龄、Hp相关性疾病(糖尿病、高血压、冠心病、反流性食管炎、糜烂性胃炎、胃癌及胃溃疡)、吸烟、饮酒及急性阑尾炎等基线资料比较,差异有统计学意义(P <0.05);Hp感染阳性组(Ⅰ型+Ⅱ型)高于对照组(P <0.05)。Hp感染阳性组(Ⅰ型+Ⅱ型)与对照组性别比较,差异无统计学意义(P >0.05)。年龄、Hp相关性疾病、饮酒、吸烟及急性阑尾炎是Hp感染的高危因素(P <0.05)。见表1。
2.3 Hp感染危险因素的多元Logistic回归分析
Logistic分析结果显示,年龄、2型糖尿病、冠心病、高血压、反流性食管炎、糜烂性胃炎、胃癌、胃溃疡、饮酒及急性阑尾炎是Hp感染的独立危险因素(P <0.05)。见表2。
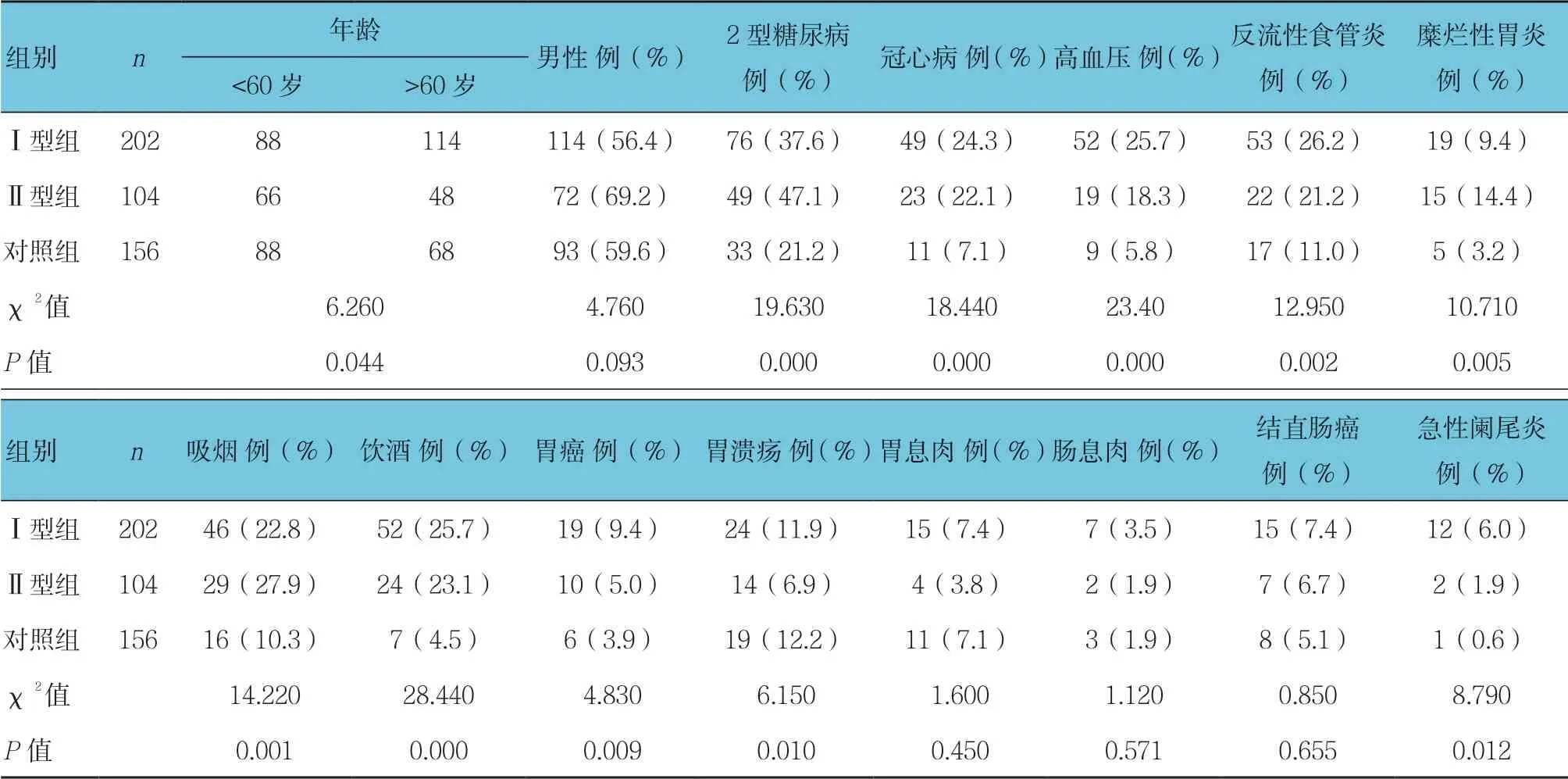
表1 各组Hp抗体分型基线资料比较
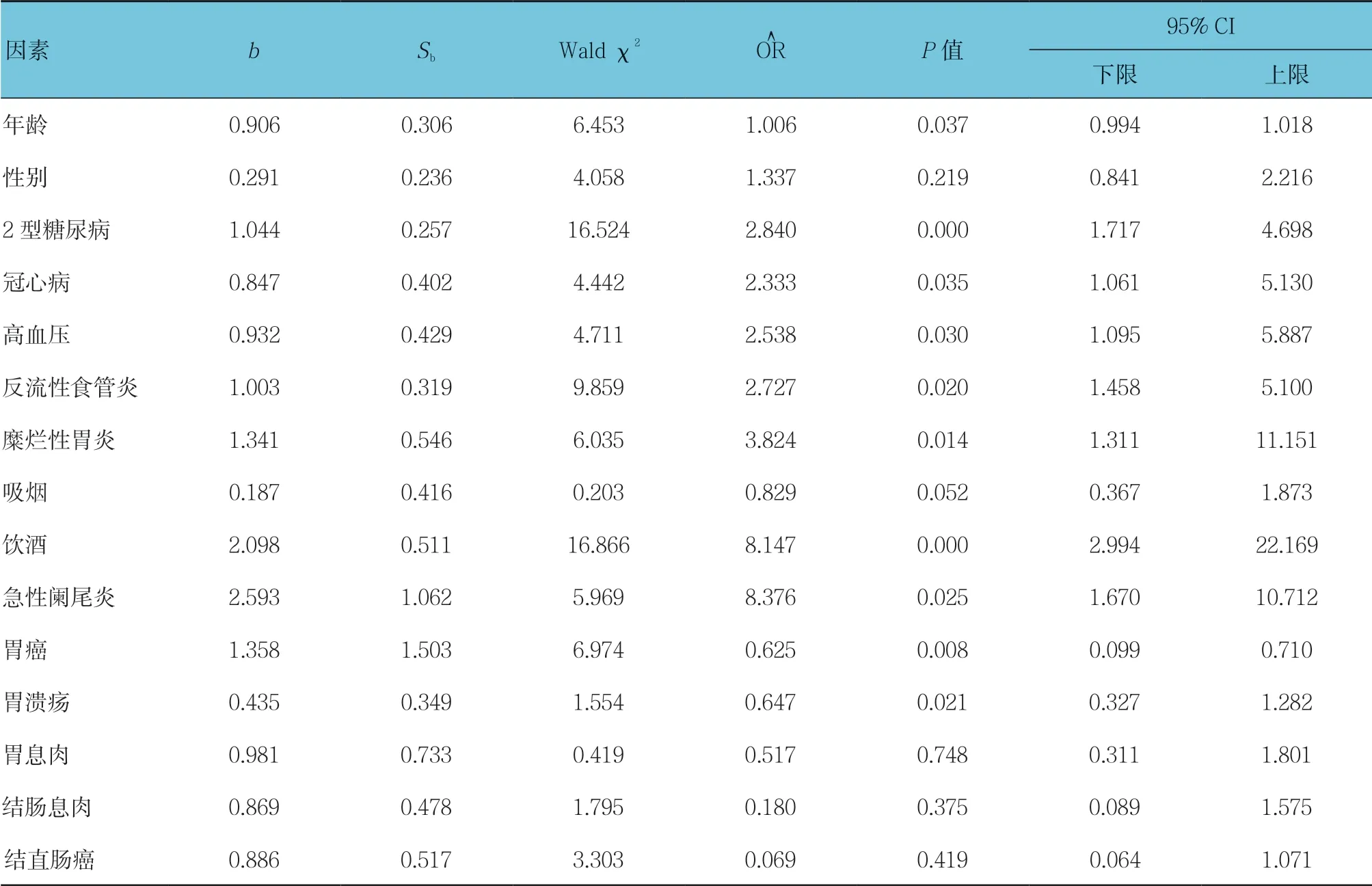
表2 Hp感染危险因素的多元Logistic回归分析参数
2.4 Hp抗体分型Ⅰ型、Ⅱ型患者UBT结果
Hp抗体分型Ⅰ型、Ⅱ型患者UBT结果比较,经χ2检验,差异有统计学意义(χ2=12.760,P =0.000);I型患者UBT阳性率高于Ⅱ型。见表3。
2.5 抗体分型与UBT检测Hp感染结果
Hp抗体分型与UBT总一致率为84.5%。阳性符合率、阴性符合率分别为80.6%和86.9%,阳性预测值为35.4%,阴性预测值为53.3%。
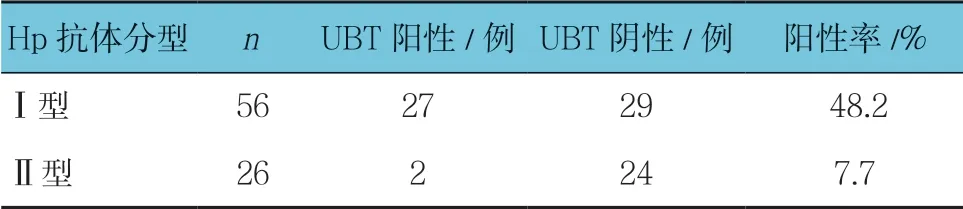
表3 Hp抗体分型Ⅰ型、Ⅱ型患者UBT结果比较
3 讨论
Hp感染会导致多种临床疾病,主要为消化系统疾病。WANG等[2]发现,有多种因素易导致Hp感染,如高龄、吸烟、高血压、冠心病及糖尿病等。在山东地区,高龄、患有Hp相关性疾病、吸烟及饮酒等人群感染Hp概率较大。
Cag A是毒力岛的重要组成部分,Vac A可增加黏膜对尿素的通透性[3-4]。Ure与Hp毒力相关,是Hp破坏局部酸性环境从而定植于胃黏膜的关键因子。研究发现,Cag A、Vac A在人群中表达率分别为66.70%和42.20%;UreB、UreA在Ⅱ型菌株中表达率分别为93.30%和26.00%,人群中表达率分别为91.80%和55.20%[2]。CagA、UreB在浙江地区高表达,分别为100%和91.70%,VacA为52.40%[5-6]。本研究中,UreB为高表达,与浙江地区一致,但CagA、VacA表达率在感染人群中低于浙江地区,具有地区差异,可能与不同地区流行菌株蛋白抗原表达异质性有关[6]。因此,各地区抗Hp治疗时应结合该地区流行病学进行,提高检出率。
有文献报道,UBT、抗体分型检测的敏感性和特异性分别为99%和98%、94%和95%,两者常出现非一致性[7]。本研究中,UBT与抗体分型检测总一致率为84.53%,阳性符合率为80.6%,但阳性预测值、阴性预测值不高,可能与Hp感染后产生IgG抗体需1~3个月且抗体在体内至少存在6个月有一定关系。DANIEL[8]发现,连续超过5 d食用酸奶或蜂蜜,IgG含量下降。另有研究发现,UBT阳性而抗体分型为阴性,可能与进行UBT的药物剂量、不同的设备相关,可导致1%~2%的误诊率[9]。产尿素酶的细菌、某些食物也可使UBT出现假阳性。抗生素诱导Hp变形,隐藏Hp抗原,暂时性不分泌毒力因子[10],且Hp可在定居于胃黏膜后关闭脲酶表达,导致UBT为阴性[11]。本研究中,53例患者UBT阴性而抗体分型检测阳性,可能为胃黏膜严重萎缩的患者存在Hp检测干扰或胃黏膜菌量减少,使UBT出现假阴性。UBT与抗体分型检测联合,可为诊断Hp感染提供参考。
综上所述,山东地区Hp感染率高,尤其在中老年人群中较高,以Ⅰ型多见,且吸烟、饮酒及患有Hp相关性疾病的患者更易感染Hp。抗体分型检测是一种诊断Hp感染敏感性高的方法,其创伤小、简单、快捷,可对Hp进行分型并分析其毒力。但抗体分型是非现症感染指标,主要用于随访,不能评价药物治疗效果。UBT与抗体分型检测联合能准确筛查Hp感染并对其分型,降低误诊率,减少抗生素的使用,同时节约医疗资源。

