吉西他滨对人舌鳞癌Tca8113细胞的放射增敏作用及其机制研究*
刘星验,张斌,马竟,陈健
(1.锦州医科大学附属第一医院 口腔颌面外科,辽宁 锦州 121000;2.葫芦岛市第二 人民医院,辽宁 葫芦岛 125000)
舌癌是最常见的口腔癌[1],有较强的局部浸润性和转移率高等特点,可导致咀嚼、言语和吞咽等功能失常,甚至有死亡的风险。舌癌对放射的敏感性不高,临床上主要是手术治疗,积极探讨放疗增敏的新方法成为研究热点之一[2]。吉西他滨(Gemcitabine, GEM)是脱氧胞苷的水溶性类似物[3],具有放射增敏作用强,毒副作用较小的特点[4]。本研究以GEM联合放疗作用于舌鳞癌Tca8113细胞,研究其对Tca8113细胞放射敏感性的影响及可能的作用机制,为舌癌的治疗提供理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞舌鳞癌Tca8113细胞购于中国科学院上海细胞生物研究所。
1.1.2 试剂GEM购于美国ApexBio公司,DMEM培养基、胰蛋白酶购于美国HyClone公司,二甲基亚砜(dimethyl sulfoxide, DMSO)购于北京索莱宝科技有限公司,链霉素/青霉素(双抗)、四甲基偶氮唑蓝(ttihiazoly blue, MTT)购于上海碧云天生物技术有限公司,胎牛血清购于杭州四季青公司,流式细胞凋亡检测试剂盒购于美国BD公司。
1.2 方法
1.2.1 细胞培养Tca8113细胞在含10%胎牛血清的DMEM高糖培养基中培养,置于37.0℃、5%二氧化碳CO2恒温细胞培养箱中,定期传代、换液,取对数期Tca8113细胞进行实验。
1.2.2 MTT法测定取对数生长期的Tca8113细胞,消化、重悬、计数后置于96孔板内,5×103个/孔细胞,每组设3个复孔,测量重复3次。细胞贴壁后,加入不同浓度GEM(0.000、0.001、0.010、0.020、0.030、0.100及1.000μmol/L)完全培养基培养24 h后终止培养,每孔加入质量浓度为5 mg/ml的MTT 20μl,37℃条件下孵育4 h。弃上清液,每孔加入150μl DMSO。摇床上震荡10 min,使用多功能酶标仪在490 nm波长处测定光密度(optical density, OD)值。以OD值显示实验结果,以浓度为横坐标,细胞存活率为纵坐标,绘制细胞的生长曲线。据此计算出GEM对Tca8113细胞增殖的影响,选定最佳浓度进行后续 实验。
取Tca8113细胞接种于96孔板内,每孔细胞数为5×103个,将其分为空白对照组、GEM组(0.02μmol/L)、单纯放疗组(4 Gy)、GEM(0.02μmol/L)联合放疗组(4 Gy)。处理24 h,用MTT法明确最佳照射剂量。
1.2.3 平板克隆实验将1×103个Tca8113细胞接种在6孔板中,待细胞贴壁后弃培养液分为空白对照组、GEM组、单纯放疗组、GEM联合放疗组。加入GEM处理细胞24 h,暴露于4 Gy照射,继续在孵箱中孵育10~14 d,弃培养液,洗涤、固定及染色后,计数各孔集落数(≥50个细胞为1个集落)。计算各组细胞克隆率。
1.2.4 流式细胞术将Tca8113细胞用0.02μmol/L GEM处理24 h后,4 Gy照射或不予处理,与空白对照组比较。5 min离心1 500 r/min收集悬浮细胞。贴壁细胞用胰蛋白酶消化,磷酸盐缓冲液漂洗细胞2次,并进行细胞计数、离心,收集1×105~3×105个细胞,将收集的细胞重悬于150μl染色溶液中,加入5μl Annexin V-FITC混匀后,加入10μl Propidium Iodide混匀,室温避光反应5~15 min。应用流式细胞仪测量细胞凋亡率。
1.2.5 Western blotting0.02μmol/L GEM处理Tca8113细胞24 h后,吸出培养液,放疗继续作用细胞24 h,Western blotting检测各组Tca8113细胞中Bax、Bcl-2、 Cleaved Caspase-3及Cleaved Caspase-9蛋白的表达水平。收集空白对照组、GEM组、单纯放疗组和GEM联合放疗组的细胞,胰酶消化后将收集的细胞离心并重悬于裂解缓冲液中。冰上孵育30 min后,提取澄清匀浆4℃、12 000 r/min离心20 min。BCA蛋白定量试剂盒检测各组蛋白浓度。10%聚丙烯酰胺凝胶电泳分离蛋白,将凝胶中的蛋白转移至硝酸纤维素膜上,300 mA湿转90 min,室温下使用5%脱脂牛奶封闭2 h,加入相应稀释比例的一抗孵育过夜,洗膜后室温下孵育二抗1 h,化学发光法显影、定影后扫描分析。采用Image J图像分析软件分析灰度值,计算出样本蛋白相对表达量。
1.3 统计学方法
数据分析采用SPSS 17.0统计软件。计量资料以均数±标准差(±s)表示,比较用方差分析,进一步两两比较用SNK-q检验。P <0.05为差异有统计学意义。
2 结果
2.1 MTT测定结果
2.1.1 GEM对Tca8113细胞活力的抑制作用不同浓度GEM(0.000、0.001、0.010、0.020、0.030、0.100及1.000μmol/L)作用时细胞存活率分别为(100.00±0.00)%、(98.59±0.20)%、(95.46±0.08)%、(94.79±0.08)%、(93.95±0.24)%、(91.77±0.54)%及(73.90±2.98)%,经方差分析,差异有统计学意义(F =171.025,P =0.000);与0.000μmol/L组比较,GEM浓度为0.010、0.020、0.030、0.100、1.000μmol/L时细胞存活率降低(P <0.05)。见图1。
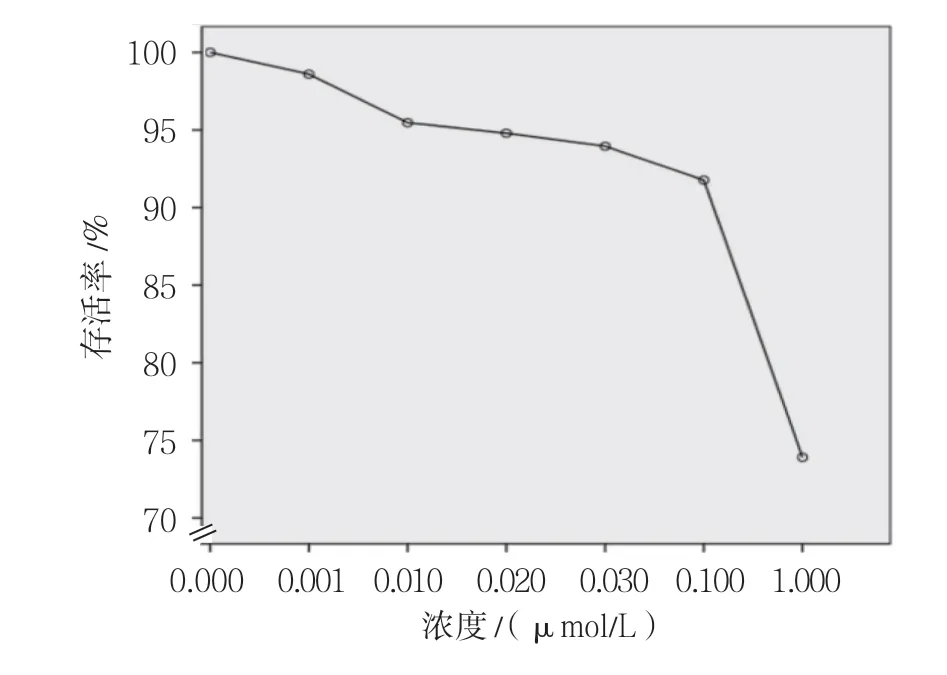
图1 Tca8113细胞在不同浓度时的细胞存活率曲线
2.1.2 GEM对放疗的增敏作用空白对照组、GEM组、单纯放疗组和GEM联合放疗组细胞存活率分别为(100.00±0.00)%、(84.83±1.78)%、(80.64±1.44)%和(73.95±1.24)%,经方差分析,差异有统计学意义(F =214.368,P =0.000);与空白对照组比较,其他各组细胞存活率降低(P <0.05);与单纯放疗组比较,GEM联合放疗组细胞存活率降低(P <0.05)。见 图2。

图2 各组Tca8113细胞存活率比较 (±s)
2.2 GEM联合放疗对Tca8113细胞集落形成的影响
放射剂量选定4 Gy,空白对照组、GEM组、单纯放疗组和GEM联合放疗组克隆形成率分别为(33.83±1.15)%、(28.46±1.42)%、(15.50±1.10)%和(0.00±.00)%,经方差分析,差异有统计学意义(F =593.548,P =0.000);与单纯放疗组比较,GEM联合放疗组克隆形成率降低(P <0.05),几乎处于静止期。见图3。
2.3 GEM增强射线诱导细胞的凋亡
流式细胞术检测发现,空白对照组、GEM组、单纯放疗组和GEM联合放疗组细胞凋亡率分别为(0.03±0.01)%、(5.68±0.18)%、(6.54±0.23)%和(28.63±0.38)%,经方差分析,差异有统计学意义(F =7959.927,P =0.000)。与空白对照组比较,GEM组和单纯放疗组的Tca8113细胞发生凋亡(P <0.05);两者联用后较单纯放疗组凋亡率升高(P <0.05),说明GEM能增强放疗对Tca8113细胞的敏感性。见图4。
2.4 Bcl-2、Bax、Cleaved Caspase-9及Cleaved Caspase-3蛋白的表达水平

图3 各组Tca8113细胞克隆实验细胞集落形成图

图4 GEM联合放疗对Tca8113细胞凋亡的影响
各组细胞中Bcl-2、Bax、Cleaved Caspase-3及Cleaved Caspase-9蛋白相对表达量比较,经单因素方差分析,差异有统计学意义(P <0.05);与空白对照组比较,GEM组、单纯放疗组和GEM联合放疗组中Bcl-2蛋白相对表达量降低(P <0.05),Bax、Cleaved Caspase-3及Cleaved Caspase-9蛋白相对表达量升高(P <0.05);GEM联合放疗组中Bcl-2蛋白相对表达量较单纯放疗组和GEM组降低(P <0.05);GEM联合放疗组中Bax、Cleaved Caspase-3及Cleaved Caspase-9蛋白相对表达量较单纯放疗组和GEM组升高(P <0.05)。线粒体凋亡途径相关蛋白Bcl-2、Bax、Cleaved Caspase-3及Cleaved Caspase-9蛋白表达增强或减弱可能是GEM提高放疗诱导舌鳞癌Tca8113细胞凋亡作用的机制之一。见表1和图5。
表1 各组细胞中Bax、Bcl-2、Cleaved Caspase-3及Cleaved Caspase-9蛋白的表达水平比较 (±s)
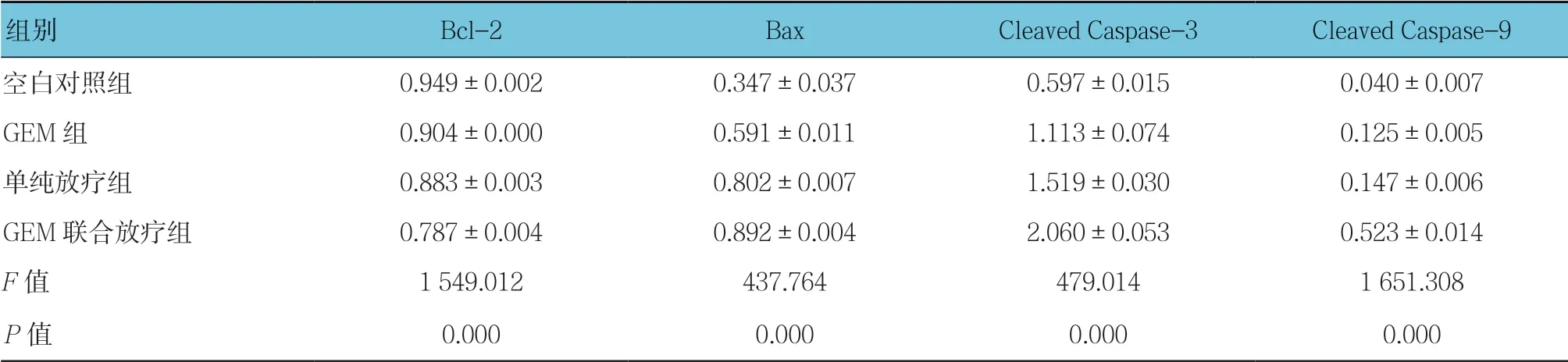
表1 各组细胞中Bax、Bcl-2、Cleaved Caspase-3及Cleaved Caspase-9蛋白的表达水平比较 (±s)
组别Bcl-2BaxCleaved Caspase-3Cleaved Caspase-9空白对照组0.949±0.0020.347±0.0370.597±0.0150.040±0.007 GEM组0.904±0.0000.591±0.0111.113±0.0740.125±0.005单纯放疗组0.883±0.0030.802±0.0071.519±0.0300.147±0.006 GEM联合放疗组0.787±0.0040.892±0.0042.060±0.0530.523±0.014 F值1 549.012437.764479.0141 651.308 P值0.0000.0000.0000.000

图5 Bax、Bcl-2、Cleaved Caspase-3及Cleaved Caspase-9蛋白表达的变化
3 讨论
舌癌是恶性程度极高的口腔癌,放疗是提高生存率的重要治疗手段之一。既往研究发现,GEM能提高乏氧细胞对放射线的敏感性,抑制DNA合成,从而达到抗肿瘤作用[5]。本实验旨在研究GEM联合放疗时,提高对Tca8113细胞增殖的抑制、凋亡的能力,从而起到放疗增敏作用的机制。
有研究表明,GEM对胰腺癌细胞的增殖有抑制作用,且呈浓度依赖性[6]。本实验得出相类似的结果,在此基础上将放疗与GEM联合作用于Tca8113细胞,发现GEM联合放疗组比单纯放疗组细胞存活率低。克隆形成实验和流式细胞术的结果说明,GEM对Tca8113细胞具有放射增敏作用。
线粒体介导的内源性途径为细胞凋亡早期的重要途径[7-8]。本实验选取线粒体途径相关蛋白Bax、Bcl-2、Cleaved Caspase-3及Cleaved Caspase-9作为监测指标,进一步探究GEM增强Tca8113细胞的放射敏感性。在线粒体介导的凋亡途径中[9],Bax为线粒体上的一种跨膜因子,在凋亡信号的诱导下,Bax转移到线粒体外膜处,促进线粒体膜通透性的改变,释放的细胞色素C能与Caspase-9形成凋亡小体,Caspase-9自我活化后再激活Caspase-3,从而促进细胞凋亡。LI等[10]发现,GEM作用于人胰腺癌CFPAC-1细胞系后,抑制Bcl-2蛋白的表达,即Bax/Bcl-2比率升高,两者形成同二聚体,降低线粒体跨膜电位。随着Ca2+浓度升高,激活启动因子Caspase-9,进一步诱导“死亡蛋白酶”、Caspase-3,进而引起细胞走向凋亡。研究表明,经GEM联合放疗处理的胰腺癌BXPC-3细胞出现Bax基因表达升高,Bcl-2基因表达降低,这些细胞表现出更高的放射敏感性[11]。本实验研究GEM联合放疗作用于舌鳞癌Tca8113细胞得出类似结果,与单纯放疗组比较,GEM联合放疗组可通过诱导舌癌Tca8113细胞中Bcl-2蛋白,使Bcl-2蛋白表达水平下降,Bax蛋白表达则升高。Caspase-3是Caspase级联反应中发挥凋亡作用的执行者,Caspase-3通常以酶原的形式存在,活化后形成C1eaved Caspase-3发挥凋亡作用[12]。本实验中,GEM联合放疗组中C1eaved Caspase-9、C1eaved Caspase-3蛋白表达比单纯放疗组更显著,与Bcl-2表达变化相反。笔者推测,GEM联合放疗可以通过线粒体介导内源性途径诱导Tca8113细胞的凋亡,增加放射敏感性,这与WOUTERS等[13]研究结果一致。
综上所述,GEM具有增强放疗诱导Tca8113细胞凋亡的能力,可提高舌癌的放射敏感性。其主要机制可能是促进Bax基因的表达,抑制Bcl-2进而激活Caspase-9,活化Caspase-3,下游底物剪切被激活,进而诱导细胞凋亡。

