两种典型水稻土中秸秆碳转化的微生物过程
仇存璞,陈晓芬,刘明,李委涛,吴萌,江春玉,冯有智,李忠佩
两种典型水稻土中秸秆碳转化的微生物过程
仇存璞1,2,陈晓芬3,刘明1,2,李委涛1,吴萌1,江春玉1,冯有智1,2,李忠佩1,2
(1中国科学院南京土壤研究所土壤与农业可持续发展国家重点实验室,南京 210008;2中国科学院大学,北京 100049;3江西省农业科学院土壤肥料与资源环境研究所,南昌 330200)
【】研究土壤中秸秆腐解速率、腐解过程中微生物群落结构变化和参与秸秆腐解的功能微生物群落组成,为揭示土壤有机质转化和积累的微生物学机制提供理论依据。以我国亚热带两种典型水稻土——常熟乌栅土和鹰潭红壤性水稻土为研究对象,设置不添加秸秆(CK)和添加13C标记的水稻秸秆(RS)处理,厌氧恒温培养38 d,在培养过程中定期测定气体释放量,研究秸秆矿化速率的动态变化;采集土壤样品,利用13C-PLFA-SIP技术分析参与秸秆降解的微生物群落的动态变化。培养前12 d,秸秆降解缓慢,此时秸秆对土壤有机质(SOM)产生正激发效应;培养12-18 d秸秆快速降解,18 d后趋缓。培养结束时,秸秆碳在红壤性水稻土和乌栅土中的矿化率分别为24%和33%。秸秆碳对CO2和CH4贡献率随培养时间的延长而增加,在培养末期分别为53%-60%和54%-57%。添加秸秆可以提高土壤微生物生物量及微生物活性,乌栅土微生物活性高于红壤性水稻土。16:0(一般细菌)是参与秸秆分解主要类群,i16:0和i15:0(G+细菌)和18:1ω9c(真菌)也是参与秸秆分解的重要微生物类群。随培养时间增加,G+细菌和放线菌的相对丰度增加,G-细菌呈降低趋势。红壤性水稻土和乌栅土PLFAs中标记利用秸秆碳的PLFAs的比例分别为27%-32%和18%-24%。真菌和一般细菌对秸秆碳的利用效率较高,而土壤原有有机质(SOM)矿化主要与G-和放线菌相关联。添加秸秆造成乌栅土和红壤性水稻土两种水稻土微生物群落结构呈现明显差异,但分解利用外源秸秆碳的微生物群落结构相似,而分解利用SOM微生物群落结构有差异。秸秆厌氧降解过程中秸秆碳的矿化滞后于土壤自身SOM;不同本底微生物活性和多样性是影响秸秆碳矿化速率的重要因素;添加秸秆后不同土壤微生物群落结构的差异主要是参与SOM降解的微生物差异,土壤原SOM是导致这种差异的重要因素。
秸秆降解;13C-PLFA-SIP;水稻土;微生物群落
0 引言
【研究意义】秸秆还田可以提高土壤有机质(SOM)含量,促进土壤养分的循环转化,对维持农田生态平衡具有重要作用[1]。在秸秆分解转化形成土壤SOM的过程中,微生物群落的演替决定了转化产物的数量和品质[2]。秸秆的微生物分解机制及其调控措施近年来受到广泛重视。研究不同影响因素下秸秆分解过程,相关土壤微生物群落结构变化,以及参与分解的特异功能微生物群落组成,有助于揭示土壤SOM转化、积累的微生物学机制。【前人研究进展】秸秆本身的性质[3],土壤性质[4-5]和环境条件[6]都可影响秸秆的分解。土壤微生物是土壤SOM、土壤养分转化和循环的动力,是土壤SOM转化的执行者。外源植物残体进入土壤基质后,发生由微生物介导的物理-化学-微生物的转化过程[7]。因此,土壤微生物也是秸秆分解的主要参与者,是驱动秸秆分解的动力。增加土壤微生物活性和生物量能够加快秸秆的分解[8]。秸秆的分解也改变着微生物群落结构[9-10],BASTIAN 等[11]发现在小麦秸秆分解过程中前期的优势菌群主要是细菌,而后期的优势菌群主要为真菌。微生物群落结构和秸秆降解过程有着直接的关联,在秸秆降解的不同时段,微生物群落有明显的演替现象[12]。13C稳定性同位素技术在土壤SOM周转和微生物生态学等方面应用广泛[13-15]。PLFA-SIP技术可以指示标记物在土壤中转化过程的功能微生物[13, 16-17]。Williams等[18]发现PLFAs(16:0、18:1ω9c和18:2ω6,9c)可以大量利用深红三叶草和黑麦草秸秆碳,但不能被PLFAs(16:1ω5c和10Me17:0)利用。【本研究切入点】分解秸秆的微生物群落结构会随环境的变化和时间的推移而发生变化。目前对旱地生态系统的研究较多,而稻田长期处于干湿交替状态,同旱作土壤中秸秆降解过程及与微生物群落的关系可能存在明显差异。水稻土添加秸秆后,SOM转化过程中参与秸秆碳代谢的微生物类群随时间如何变化研究较少。任何影响微生物生长的土壤环境或条件均有可能影响秸秆碳在土壤中的去向。不同水稻土(如不同母质)中参与秸秆碳代谢的关键微生物类群是否有差异仍需深入探讨。【拟解决的关键问题】本研究以我国亚热带两种典型水稻土——常熟乌栅土和鹰潭红壤性水稻土为研究对象,研究了秸秆在不同水稻土中的矿化速率及动态变化,探讨了不同培养时期利用外源秸秆碳的微生物群落组成变化以及在不同母质土壤中的差异,为揭示秸秆碳在水稻土中转化过程机制提供理论依据。
1 材料与方法
1.1 供试土壤和秸秆
本试验采用两种典型水稻土,一种采自中国科学院鹰潭农业生态试验站(江西省鹰潭市余江县,116°55′E,28°15′N),为第四纪红黏土母质上发育的红壤性水稻土。另一种采自于中国科学院常熟生态试验站(江苏省常熟市,120°42′E,31°33′N),其为湖泊沉积物上发育的乌栅土(表1)。
供试秸秆为13C标记的水稻秸秆,采用脉冲标法,在水稻分蘖期、拔节期、抽穗期和灌浆期对其进行4次标记,水稻成熟后收获标记的秸秆。标记的水稻秸秆经杀青、烘干、粉碎(<40目)后,保存在密闭干燥的容器中备用。水稻秸秆有机碳含量为387 g·kg-1,全氮含量为19.7 g·kg-1,δ13C值为797‰。
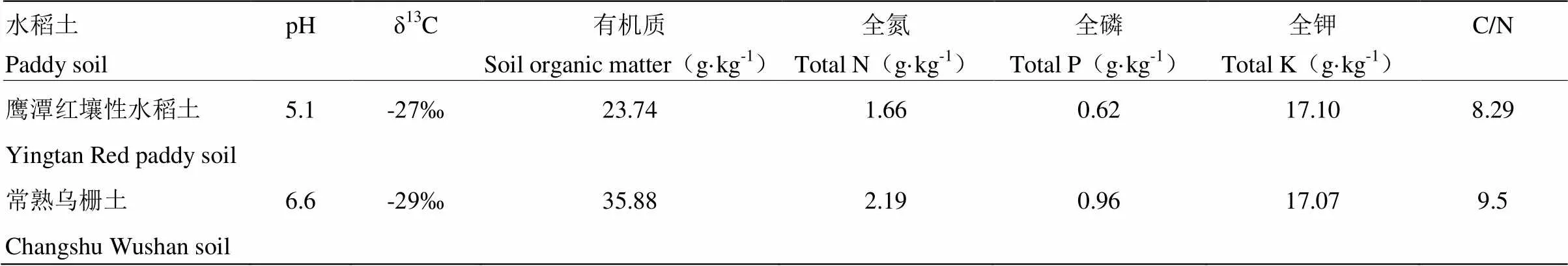
表1 供试土壤性质
1.2 试验设计
称取相当于烘干土重20 g的风干土样置于110 mL培养瓶中,添加0.2 g13C标记水稻秸秆混合均匀,同时设置未添加秸秆的土壤作为对照。调节含水量为土壤最大持水量(WHC)的60%,充氮气后置于25℃恒温培养箱中厌氧培养。在培养的第3、6、9、12、18、28、38天采集气体测定CO2与CH4含量,在第3、9、18、38天采集土样进行磷脂脂肪酸的分析。
1.3 CO2和CH4测定
CO2和CH4浓度采用气相色谱仪GC-7890A(Agilent Technologies,美国)测定。CO2和CH4中同位素组成采用同位素质谱仪MAT253(Thermo Finnigan,德国)测定。
1.4 PLFA提取和微生物群落结构测定
采用修正的Bligh-Dyer方法进行脂类提取和PLFA分析[19-20]。用带有MIDI Sherlock系统(MIDI,Inc.,Newark,DE,USA)的Agilent 7890气相色谱(Agilent Technologies,Santa Clara,CA,USA)对提取的脂肪酸甲酯(FAME)进行识别与定量。PLFA的含量和类型常用来表征土壤微生物群落结构的变化。其中,14:0、15:0、16:0、17:0、18:0和20:0代表一般细菌;i14:0、a14:0、i15:0、a15:0、i16:0、a16:0、i17:0、a17:0、i18:0和i20:0代表革兰氏阳性(G+)细菌;15:1ω6c、16:1ω7c、16:1ω9c、17:1ω8c、18:1ω7c、19:1ω6c、20:1ω9c、21:1ω3c、cy17:0和cy19:0代表革兰氏阴性(G-)细菌;18:1ω9c和18:2ω6c代表真菌;10Me16:0、10Me17:0和10Me18:0代表放线菌[21-22]。加和标记脂肪酸量作为各类群生物量。采用气相色谱-燃烧-同位素质谱GC(Thermo Scientific Trace GC Ultra)-C-IRMS(Finnigan MAT 253)测定FAME的δ13C值。被检出的PLFAs中,用于同位素分析的PLFAs有19种,分别归类为一般细菌(14:0、15:0、16:0、17:0、18:0 和20:0)、革兰氏阳性(G+)细菌(a15:0、i15:0、i16:0、a17:0和i17:0)、革兰氏阴性(G-)细菌(16:1w9c、cy17:0、18:1ω7c和cy19:0)、真菌(18:1ω9c和18:2ω6c)和放线菌(10Me16:0和10Me18:0)。
1.5 计算方法
土壤释放CO2-C中来自水稻秸秆碳的比例为[23]:
Fstraw= (δ13CO2, straw-δ13CO2, control)/(δ13Cstraw-δ13Csoil) (1)
式中,δ13CO2, straw和δ13CO2, control为添加秸秆和不添加秸秆土壤释放CO2的δ13C值;δ13Cstraw和δ13Csoil分别为水稻秸秆和土壤的δ13C值。计算土壤释放CH4-C中来自水稻秸秆碳的比例应用相似的公式。
在添加秸秆的土壤中由土壤原有SOM释放的CO2量为:
CO2, SOM= CO2, straw× (1-Fstraw) (2)
式中,CO2, straw为添加秸秆土壤中CO2的总释放量。计算在添加秸秆的土壤中由土壤原有SOM释放的CH4量应用相似的公式。
添加秸秆对SOM分解释放CO2的激发效应为:
激发效应=CO2,SOM/CO2,control-1 (3)
式中,CO2,control为不添加秸秆的土壤CO2总量,添加秸秆对SOM矿化(CO2+CH4)和分解释放CH4的激发效应应用相似的公式。
通过计算添加秸秆土壤释放气体中碳量占秸秆碳的比例估算秸秆碳的矿化率:
秸秆碳的矿化率 = 标记秸秆释放气体-C量/秸秆碳量 (4)
每种PLFA中标记利用秸秆碳所占比例(Pi, %)用以下公式进行计算[24]:
Pi=(δ13CPLFA-straw-δ13CPLFA-control)/(δ13Cstraw-δ13Csoil)×100 (5)
式中,δ13CPLFA-straw和δ13CPLFA-control分别代表添加标记水稻秸秆处理和对照处理单个PLFA的δ13C值(‰);δ13Cstraw和δ13Csoil分别代表标记水稻秸秆和土壤的δ13C值(‰)。
秸秆碳PLFA(13C-PLFA)单体的含量(nmol·g-1)为:
13C-PLFA = PLFA单体含量(nmol·g-1)×Pi/100 (6)
1.6 数据处理与分析
运用PASW18.0(SPSSinc,Chicago,IL,USA)软件进行方差分析和主成分分析(PCA)。运用Origin 9.0软件进行绘图。
2 结果
2.1 秸秆碳矿化动态及其对CO2和CH4排放的贡献
在红壤性水稻土和乌栅土对照中,厌氧培养38 d时CO2累积排放量分别为54和71 μmol·g-1(图1-a),水稻秸秆的添加使CO2累积排放量分别增加了72%和86%。在各处理中,在培养初期CO2排放量迅速增加,18 d后释放速率趋缓。来源于水稻秸秆的CO2累积排放量在培养初期缓慢增加,12 d后迅速增加18 d后趋缓;培养结束时,其在红壤性水稻土和乌栅土中累积排放量分别为56和69 μmol·g-1,分别占总排放量的60%和53%。培养初期,水稻秸秆的添加促进土壤原有SOM分解,使来源于土壤有机碳的CO2排放量快速累积,12 d后趋于稳定,水稻秸秆对土壤SOM矿化的促进作用减弱,培养结束时,其在红壤性水稻土和乌栅土中累积排放量分别为37和61 μmol·g-1。水稻秸秆的矿化产CO2要滞后于土壤SOM,但在培养末期的累积排放量高于土壤SOM。在红壤性水稻土和乌栅土对照中,厌氧培养38 d后CH4累积排放量分别仅为1.8和3.6 μmol·g-1(图1-b),水稻秸秆的添加可以显著增加CH4累积排放,分别达到37和68 μmol·g-1。秸秆和土壤原有SOM厌氧分解产生的CH4均随培养时间呈线性增加,培养38 d后,来源于秸秆碳的CH4在红壤性水稻土和乌栅土中累积排放量分别占总排放量的57%和54%。培养前28 d,秸秆碳对CO2和CH4排放的贡献率乌栅土大于红壤性水稻土(图1-d),且秸秆碳对CH4的贡献率在培养前9 d呈指数增长在12 d达到峰值,而秸秆碳对CO2的贡献率在培养前期较低在9—18 d呈指数增长并在28 d时达到峰值。秸秆碳对总矿化量(CH4和CO2)的贡献率在不同水稻土中无明显差异。根据释放于气体中的碳来估算秸秆碳的矿化率(图1-c),整个培养期内秸秆碳在红壤性水稻土中的矿化率小于乌栅土,培养结束时两种水稻土中秸秆碳的矿化量分别为24%和33%。

“YT”和“CS”分别指鹰潭红壤性水稻土和常熟乌栅土。下同The abbreviations “YT” and “CS” in the legend indicates Yingtan Red paddy soil and Changshu Wushan soil, respectively. The same as below
添加秸秆可以促进SOM分解产生CO2从而导致正激发效应(图1-a,图2-a),但这种影响逐渐减弱在培养12 d后变为负激发效应(图2-a)。添加秸秆同样可以诱发SOM矿化产CH4导致正激发效应(图1-b,图2-b),这种影响在乌栅土中培养3—12 d时持续增加,在培养12 d时达到最大,之后下降但依旧为正激发效应;但在红壤性水稻土中激发效应的强度显著小于常熟乌栅土,在培养的前9 d表现为负激发效应,之后表现为正激发效应。CO2+CH4的激发效应在培养第12天时达到最大随后减弱,在乌栅土中仍旧表现为正激发效应,但在红壤性水稻土中12 d后表现为负激发效应。

图2 CO2(a),CH4(b)和CO2+CH4(c)的激发效应Fig. 2 Priming effects of CO2 (a), CH4 (b) and CO2 plus CH4 (c)
2.2 土壤微生物群落结构组成及变化
厌氧培养过程中,不添加秸秆处理的土壤总PLFAs和各类群微生物PLFAs含量均表现为随培养时间的延长而增加(图3)。乌栅土的总PLFAs和各类群微生物PLFAs含量在整个培养过程中均高于红壤性水稻土。在添加秸秆的水稻土中,随培养时间的延长乌栅土中总PLFAs略有增加,而红壤性水稻土总PLFAs降低。在培养末期,添加秸秆的红壤性水稻土总PLFAs与对照接近,这主要与一般细菌、革兰氏阳性菌(G+)和真菌含量的下降有关。但在添加秸秆的乌栅土中,虽G+有所降低,但幅度小于红壤性水稻土,且一般细菌和革兰氏阴性菌(G-)含量升高,因此添加秸秆的乌栅土总PLFAs在培养末期时略有升高。

“CK”和“RS”分别指不添加和添加秸秆The abbreviations “CK” and “RS” indicates soils without and with straw addition, respectively
对土壤PLFAs数据进行主成分分析,提取得到的主成分1和主成分2分别解释变量方差的43.6%和13.5%(图4)。在添加秸秆的水稻土中,培养18 d后的各处理聚集,说明添加秸秆的水稻土微生物群落结构趋于稳定。随着培养时间延长,乌栅土中添加秸秆各样点迁移幅度较红壤性水稻土大,说明添加秸秆对乌栅土微生物群落结构的影响更大。
2.3 参与秸秆分解的微生物群落组成及变化
PLFA单体中碳来源于秸秆碳和土壤SOM,但在不同的单体中的含量和比重有差异(图5,6)。利用秸秆碳的微生物群落中,一般细菌占主导地位,其相对丰度在红壤性水稻土和乌栅土中分别达60%—76%和47%—55%(表2)。一般细菌中16:0含量最高(图5),在红壤性水稻土中,培养3 d时为8.7 nmol·g-1(占利用秸秆碳微生物PLFAs的比例为50%),18 d时为6.1 nmol·g-1(62%),38 d时为4.0 nmol·g-1(38%);而在乌栅土中,培养3 d时为8.7 nmol·g-1(占利用秸秆碳微生物PLFAs的比例为44%),38 d时为4.0 nmol·g-1(25%),16:0是水稻土中参与秸秆降解的主要细菌PLFA单体。另外G+细菌中i15:0和i16:0和真菌中18:1ω9c也是参与秸秆降解的重要PLFA单体。由表2可知,G+细菌和放线菌的相对丰度随培养时间的延长而增加,G-细菌和真菌在两种土壤中随培养时间的延长均减少。利用秸秆碳的PLFAs,在红壤性水稻土PLFAs中的比例为27%—32%(图6-a),而在乌栅土PLFAs中的比例为18%—24%(图6-b),说明红壤性水稻土中微生物较乌栅土更易利用秸秆碳。G+细菌和放线菌对秸秆碳的利用效率随着培养时间延长而增加,而G-细菌和真菌对秸秆碳的利用效率随培养时间而降低。一般细菌和真菌对秸秆碳的利用效率较高,在红壤性水稻土中分别达43%—46%和38%—62%,在乌栅土中分别为30%— 34%和25%—50%。而G-细菌和放线菌对秸秆碳的利用效率较低(0—15%),这两类微生物类群主要与土壤原有SOM矿化相关联。

“CK”和“RS”分别指不添加和添加秸秆。数字指培养时间(天)

图5 不同水稻土添加秸秆厌氧培养过程中利用秸秆碳的土壤PLFA单体含量
对13C标记和非标记PLFAs进行主成分分析,区别来源于秸秆碳和SOM碳的微生物群落组成差异,提取得到的主成分1和主成分2分别解释变量方差的66.3%和13.4%(图7)。在添加秸秆的水稻土中,参与秸秆降解的微生物群落结构相似,但两种土壤中参与SOM降解的微生物群落结构差异明显。说明添加秸秆后两种水稻土微生物群落结构的差异主要来自参与SOM降解的微生物的不同。乌栅土中参与秸秆分解和参与SOM分解的微生物群落结构的差异显著大于红壤性水稻土。培养18 d后各样点聚集,参与秸秆和原有SOM分解的微生物群落结构均在18 d趋于稳定。在乌栅土中,各样点迁移幅度较红壤性水稻土大,说明添加秸秆对乌栅土中参与秸秆和SOM分解的微生物群落结构的影响均大于红壤性水稻土。
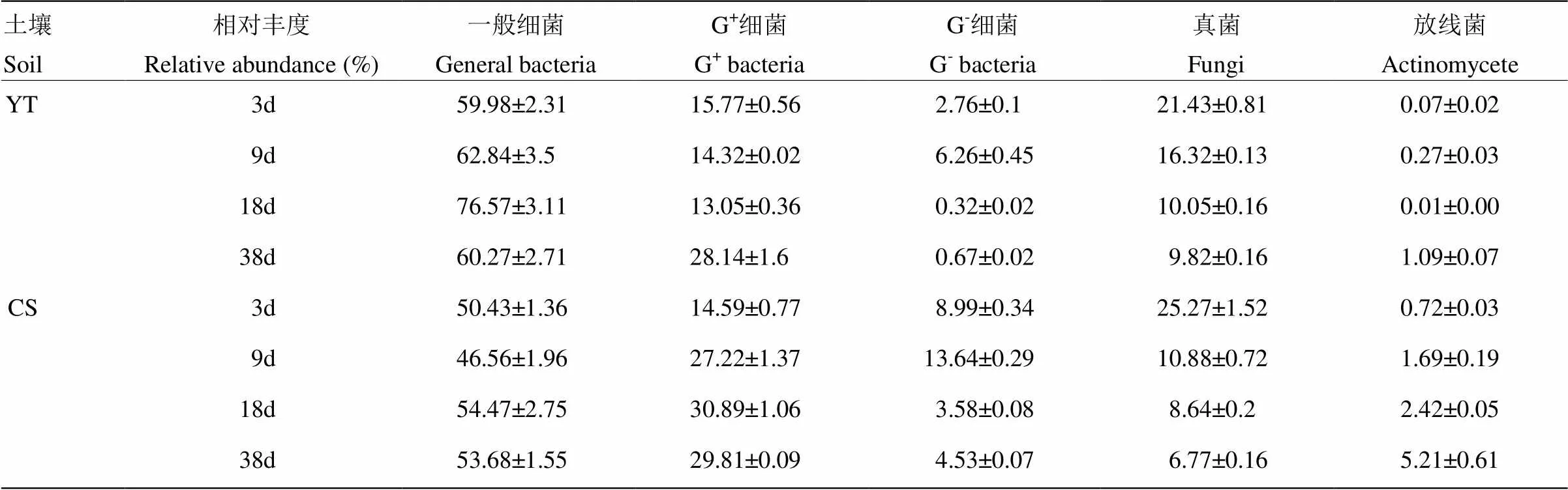
表2 不同水稻土添加秸秆厌氧培养过程中利用秸秆碳的土壤PLFAs各组成的相对丰度
“YT”和“CS”分别指鹰潭红壤性水稻土和常熟乌栅土
The abbreviations “YT” and “CS” in the legend indicates Yingtan Red paddy soil and Changshu Changshu soil, respectively
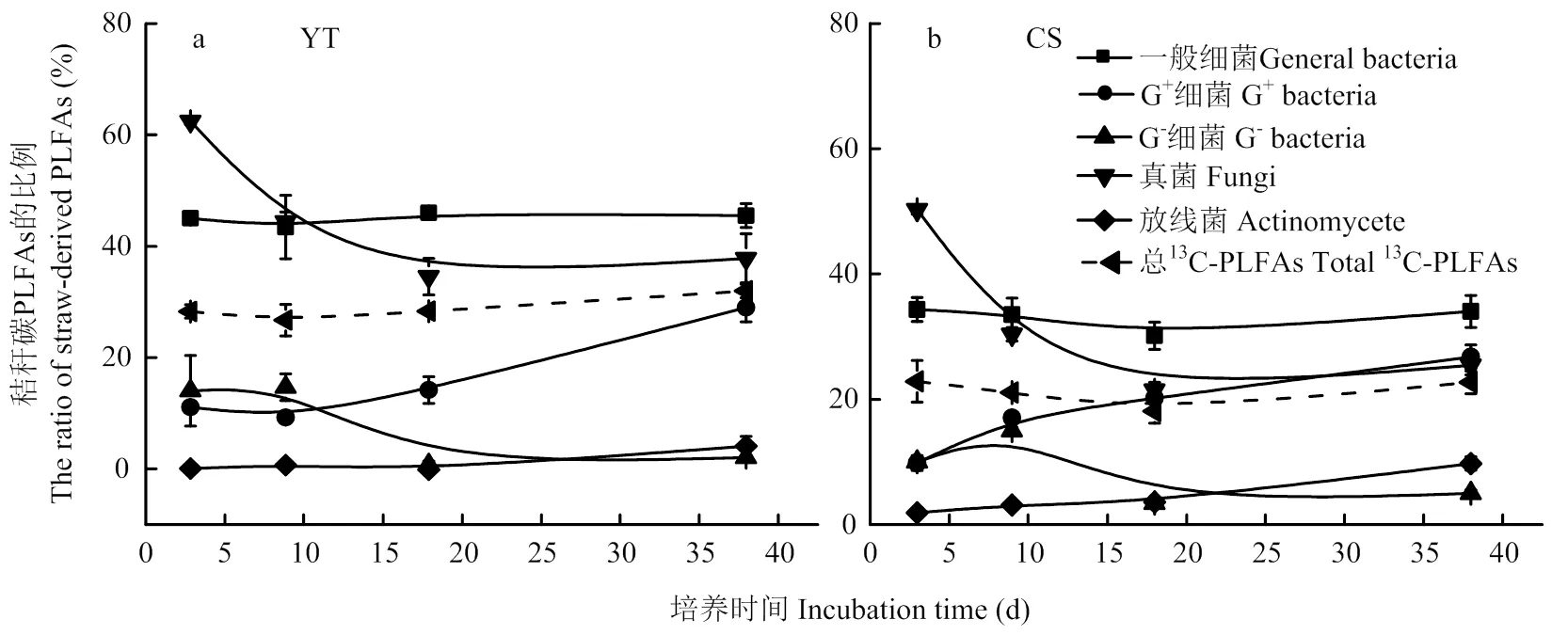
图6 秸秆碳在添加秸秆土壤磷脂脂肪酸各组成中贡献率

“RS”和“SOM”分别代表来源于水稻秸秆碳和土壤有机质碳。数字代表培养时间(天)
3 讨论
3.1 秸秆碳矿化
水稻秸秆由纤维素(约35%)、半纤维素(约25%)、木质素(约15%)以及粗蛋白(约3%)等大分子物质组成,可以被多种微生物群落及复合体应用不同的物质利用模式而利用[3, 25-26],它们在土壤中的降解转化是在微生物、酶等参与下的矿化分解和腐殖化过程[27]。本文结果显示培养前12 d,秸秆的降解速率较低,此时CO2的排放主要是秸秆对土壤原有SOM分解的促进作用所产生(正激发效应)(图1,2)。多数室内培养试验结果表明,因土壤中添加了秸秆,改善了土壤团聚体结构,增加了土壤养分,有效促进了土壤微生物的生长和代谢,进而增强了其对土壤原SOM的分解,即发生正激发效应。培养12 d后激发效应降低,秸秆开始快速腐解,如乌栅土中秸秆总矿化率(CO2+CH4)在12 d时为9%,而在18 d时达到23%。秸秆添加可以促进SOM分解产生CO2,进而激发微生物的活性利用新添加的有机物质[28-29],使秸秆快速腐解。FONTAINE[30]的研究发现,纤维素可刺激至少两种类型的微生物产生,一种专门分解纤维素,另一种主要是分解SOM,但也可能利用纤维素。因此,水稻秸秆的添加可能刺激了SOM分解微生物的产生,然而刺激效应是有限的,随后逐渐被能利用秸秆的微生物淘汰[31]。也有研究认为还田秸秆在土壤微生物的作用下同时进行的矿化和腐殖质化过程增加了SOM含量,而源于秸秆碳新形成的SOM,主要是形成的活性有机碳,更易被微生物利用[31],从而降低土壤原SOM的分解。研究结果还发现,添加秸秆同样可以增加CH4的产生并且促进SOM分解产生CH4(图2-b),秸秆中一些惰性组分的降解可以刺激SOM降解微生物的生长进而导致SOM分解产生CH4[32]。培养后期,秸秆腐解速率减缓。通常,植物残体中的糖类、蛋白质、淀粉和氨基酸等活性组分最早被微生物快速分解;随后,半纤维素和纤维素等惰性组分被微生物分解利用[4, 33]。研究结果还表明,秸秆在红壤性水稻土中的矿化速率要低于乌栅土,在培养末期秸秆在红壤性水稻土中的矿化率比乌栅土低8%,这可能与土壤微生物活性有关,微生物生物量可以反映土壤微生物活性,红壤性水稻土微生物活性低于乌栅土(图3)。同时结果表明添加秸秆后乌栅土的激发效应要高于红壤性水稻土(图2),SOM分解过程中,电子受体浓度、产甲烷活性、微生物活性和底物利用率对激发效应的生成时间、大小和持续时间均有影响[23]。
3.2 微生物群落结构变化
本研究运用PLFA方法探索秸秆厌氧降解过程中微生物群落结构的动态变化。PCA分析结果表明,随着培养时间的延长,对照土壤微生物群落组成略有迁移,而添加秸秆会加速微生物群落结构的单向演替(图4),同时水稻秸秆对乌栅土微生物群落结构的影响要大于红壤性水稻土。通过不同碳来源的PLFAs组成的PCA分析还表明,添加秸秆会加速分解利用秸秆和SOM的微生物群落结构的单向演替,并且这种演替依旧是乌栅土大于红壤性水稻土(图7)。通常认为,在水稻秸秆和SOM厌氧降解过程中,微生物的演替是由限制资源的可利用性和群落利用这些资源的能力所驱动的[23]。本研究发现添加秸秆后两种土壤利用分解水稻秸秆的微生物群落结构相似而分解利用SOM的微生物群落结构有差异。而本研究中,两种土壤添加同样的秸秆且添加量相同,而土壤的SOM含量不同(表1),且两种土壤的SOM组成也是有差异的[34],如乌栅土活性胡敏酸碳占腐殖酸碳的比例显著高于红壤性水稻土,而富里酸碳占腐殖酸碳的比例显著低于红壤性水稻。SOM为土壤微生物生长提供主要的碳源和能源,其含量和组成是影响土壤微生物生物量以及群落组成的关键因素[35-36]。乌栅土和红壤性水稻土SOM含量和组成的差异势必使得SOM的可利用组分及可利用率产生差异,进而引起分解利用SOM的微生物群落组成的差异。此外乌栅土有机碳含量更高,C/N为9.50,红壤水稻土有机碳含量较低,C/N比8.29,碳氮比越高,腐殖化程度越低。C/N比值也影响微生物群落结构,细菌和真核生物群落结构均与土壤C/N比值显著相关[36]。
3.3 特异微生物的变化
MOORE-KUCERA和DICK[37]对森林土壤的研究表明,18:1ω9c和18:2ω6,9c(真菌标志物)对13C标记凋落物和根残体中碳的利用能力最强。ELFSTRAND等[38]的研究指出,16:0、革兰氏阴性菌(16:1ω7c和18:1ω7c)和真菌(18:1ω9c)是利用深红三叶草秸秆碳的主要类群。WILLIAMS等[18]对13C标记深红三叶草和黑麦草的根与秸秆的微生物分解过程研究发现,部分PLFAs(16:1ω5c和10Me17:0)基本不利用植物残体碳,而另一部分PLFAs(16:0、18:1ω9c和18:2ω6,9c)在整个培养过程中均能大量利用植物残体碳。本研究发现,乌栅土和红壤性水稻土中,16:0(一般细菌)是利用水稻秸秆碳的主要类群,i16:0和i15:0(G+细菌)和18:1ω9c(真菌)也是参与秸秆分解的重要微生物类群(图5)。植物残体性质和土壤条件的不同可能是导致参与植物残体分解微生物群落不同的主要原因。
由秸秆引入的外源碳可以增加微生物生物量,在培养3 d时PLFAs总量在红壤性水稻土和乌栅土中分别增加170%和155%,而在培养9 d分别增加100%和67%(图3)。其中G+细菌、G-细菌、一般细菌、放线菌和真菌的微生物生物量均有增加,暗示秸秆的厌氧降解过程涉及一系列复杂的微生物群体[39],是各种微生物共同参与下完成的。然而,秸秆对土壤微生物这种促进作用随着培养时间而减弱,并且在38 d时在红壤性水稻土中消失(图3)。
不同分解阶段相对应的微生物群落结构和组成的动态变化也反映了具有不同生长策略的微生物消长[3, 40]。在秸秆分解早期,由易分解部分产生的底物刺激R-策略微生物迅速繁殖生长。后期随着底物复杂性提高,可用性降低,K策略微生物具有生长优势。一般认为,G-细菌是R-策略(富营养型)微生物,生长速率快,主要利用易分解活性有机底物;而放线菌和大部分G+细菌是K-策略(贫营养型)微生物,对较难分解的有机物利用能力更强,因此生长速率缓慢[13]。本研究结果也表明,从培养的18 d到38 d,秸秆分解速率缓慢,水稻土中利用秸秆碳的G+细菌和放线菌平均相对丰度增加而G-细菌相对丰度降低(表2)。本研究还发现,红壤性水稻土中一般细菌在秸秆分解中发挥主要作用,而乌栅土,G+细菌和一般细菌对秸秆碳的利用能力最强,是参与秸秆分解的主要微生物类群。植物残体性质和土壤条件的不同可能是导致参与植物残体分解微生物群落不同的主要原因,而本研究中,秸秆来源和添加量一致,因此上述结果反映出不同母质土壤中微生物对碳源代谢方式的差异性(图6)。究其原因,可能是红壤性水稻土中SOM含量较乌栅土低,养分相对贫乏,当外源碳(水稻秸秆)加入后,红壤性水稻土微生物对外源碳的利用能力较乌栅土微生物相对容易。
4 结论
秸秆的添加促进土壤原有SOM的分解,水稻秸秆的矿化滞后于土壤SOM,秸秆在乌栅土中的矿化率大于红壤性水稻土。添加秸秆引起参与秸秆碳降解的微生物群落结构的变化,G+和放线菌的相对丰度随培养时间增加而增加,G-细菌随培养时间增加而降低。添加秸秆后乌栅土和红壤性水稻土两种水稻土微生物群落结构的差异主要是分解利用SOM微生物的差异。
[1] CHEN X F, LIU M, KUZYAKOV Y, LI W T, LIU J, JIANG C Y, WU M, LI Z P. Incorporation of rice straw carbon into dissolved organic matter and microbial biomass along a 100-year paddy soil chronosequence., 2018, 130: 84-90.
[2] SWIFT M H O, ANDERSON J.. Los Angeles: Univeristy of California Press, 1979.
[3] RUI J, PENG J, LU Y. Succession of bacterial populations during plant residue decomposition in rice field soil.2009, 75(14): 4879-4886.
[4] PEI J, LI H, LI S, AN T, FARMER J, FU S, WANG J. Dynamics of maize carbon contribution to soil organic carbon in association with soil type and fertility level., 2015, 10(3):e0120825.
[5] TANG S R, CHENG W G, HU R G, GUIGUE J, KIMANI S M, TAWARAYA K, XU X K. Simulating the effects of soil temperature and moisture in the off-rice season on rice straw decomposition and subsequent CH4production during the growth season in a paddy soil., 2016, 52(5): 739-748.
[6] WANG X, SUN B, MAO J, SUI Y, CAO X. Structural convergence of maize and wheat straw during two-year decomposition under different climate conditions., 2012, 46(13): 7159-7165.
[7] 王玉竹, 周萍, 王娟, 马蓓, 刘翊涵, 吴金水.亚热带几种典型稻田与旱作土壤中外源输入秸秆的分解与转化差异.生态学报, 2017, 37(19): 6457-6465.
WANG Y Z, ZHOU P, WANG J, MA B, LIU Y H, WU J S. Decomposition and transformation of input straw in several typical paddy and upland soils in subtropical China., 2017, 37(19): 6457-6465. (in Chinese)
[8] MATSUYAMA T, NAKAJIMA Y, MATSUYA K, IKENAGA M, ASAKAWA S, KIMURA M. Bacterial community in plant residues in a Japanese paddy field estimated by RFLP and DGGE analyses., 2007, 39(2): 463-472.
[9] 喻曼, 曾光明, 陈耀宁, 郁红艳, 黄丹莲, 陈芙蓉. PLFA法研究稻草固态发酵中的微生物群落结构变化. 环境科学, 2007, 11: 2603-2608.
YU M, ZENG G M, CHEN Y N, YU H Y, HUANG D L, CHEN F R. Microbial community changes during the degradation of sraw using phospholipid fatty acid analysis.2007, 11: 2603-2608. (in Chinese)
[10] LI P, LI Y C, ZHENG X Q, DING L N, MING F, PAN A H, LV W G, TANG X M. Rice straw decomposition affects diversity and dynamics of soil fungal community, but not bacteria., 2018, 18(1): 248-258.
[11] BASTIAN F, BOUZIRI L, NICOLARDOT B, RANJARD L. Impact of wheat straw decomposition on successional patterns of soil microbial community structure., 2009, 41(2): 262-275.
[12] BLAGODATSKAYA E, KUZYAKOV Y. Mechanisms of real and apparent priming effects and their dependence on soil microbial biomass and community structure: critical review., 2008, 45(2): 115-131.
[13] BAI Z, LIANG C, BODE S, HUYGENS D, BOECKX P. Phospholipid C-13 stable isotopic probing during decomposition of wheat residues., 2016, 98: 65-74.
[14] 窦森, 张晋京, LICHTFOUSE E, 曹亚澄. 用δ13C方法研究玉米秸秆分解期间土壤有机质数量动态变化. 土壤学报, 2003, 3: 328-334.
DOU S, ZHANG J J, LICHTFOUSE E, CAO Y C. Study on dynamic change of soil organic matter during corn stalk decomposition by δ13C method.2003, 3: 328-334. (in Chinese)
[15] PAN F X, LI Y Y, CHAPMAN S J, KHAN S, YAO H Y. Microbial utilization of rice straw and its derived biochar in a paddy soil.2016, 559: 15-23.
[16] CROSSMAN Z M, ABRAHAM F, EVERSHED R P. Stable isotope pulse-chasing and compound specific stable carbon isotope analysis of phospholipid fatty acids to assess methane oxidizing bacterial populations in landfill cover soils.2004, 38(5): 1359-1367.
[17] AOYAMA M, ANGERS D A, N'DAYEGAMIYE A, BISSONNETTE N. Metabolism of C-13-labeled glucose in aggregates from soils with manure application.2000, 32(3): 295-300.
[18] WILLIAMS M A, MYROLD D D, BOTTOMLEY P J. Carbon flow from C-13-labeled straw and root residues into the phospholipid fatty acids of a soil microbial community under field conditions.2006, 38(4): 759-768.
[19] BUYER J S, TEASDALE J R, ROBERTS D P, ZASADA I A, MAUL J E. Factors affecting soil microbial community structure in tomato cropping systems., 2010, 42(5): 831-841.
[20] BLIGH E G, DYER W J. A rapid method of toal lipid extraction and purification., 1959, 37(8): 911-917.
[21] ZHANG H, DING W, YU H, HE X. Carbon uptake by a microbial community during 30-day treatment with C-13-glucose of a sandy loam soil fertilized for 20 years with NPK or compost as determined by a GC-C-IRMS analysis of phospholipid fatty acids., 2013, 57: 228-236.
[22] ZELLES L. Fatty acid patterns of phospholipids and lipopolysaccharides in the characterisation of microbial communities in soil: a review.1999, 29(2): 111-129.
[23] YE R Z, DOANE T A, MORRIS J, HORWATH W R. The effect of rice straw on the priming of soil organic matter and methane production in peat soils.2015, 81: 98-107.
[24] MURASE J, MATSUI Y, KATOH M, SUGIMOTO A, KIMURA M. Incorporation of13C-labeled rice-straw-derived carbon into microbial communities in submerged rice field soil and percolating water., 2006, 38(12): 3483-3491.
[25] JIN S, CHEN H. Near-infrared analysis of the chemical composition of rice straw., 2007, 26(2): 207-211.
[26] KIMURA M, MIYAKI M, FUJINAKA K, MAIE N. Microbiota responsible for the decomposition of rice straw in a submerged paddy soil estimated from phospholipid fatty acid composition., 2001, 47(3): 569-578.
[27] 吴景贵, 王明辉, 万忠梅, 姜亦梅, 吴江. 玉米秸秆腐解过程中形成胡敏酸的组成和结构研究. 土壤学报, 2006, 143(13): 443-451.
WU J G, WANG M H, WANG Z M, JIANG Y M, WU J. Chemical composition and structure of humic acid from composted corn stalk residue.2006, 143(13): 443-451. (in Chinese)
[28] ZHU Z K, GE T D, LUO Y, LIU S L, XU X L, TONG C L, SHIBISTOVA O, GUGGENBERGER G, WU J S. Microbial stoichiometric flexibility regulates rice straw mineralization and its priming effect in paddy soil., 2018, 121: 67-76.
[29] YE R Z, HORWATH W R. Influence of rice straw on priming of soil C for dissolved organic C and CH4production.2017, 417(1/2): 231-241.
[30] FONTAINE S, BARDOUX G, BENEST D, VERDIER B, MARIOTTI A, ABBADIE L. Mechanisms of the priming effect in a savannah soil amended with cellulose., 2004, 68(1): 125-131.
[31] AN T T, SCHAEFFER S, ZHUANG J, RADOSEVICH M, LI S Y, LI H, PEI J B, WANG J K. Dynamics and distribution of13C-labeled straw carbon by microorganisms as affected by soil fertility levels in the black soil region of Northeast China.2015, 51: 605-613.
[32] FONTAINE S, MARIOTTI A, ABBADIE L. The priming effect of organic matter: a question of microbial competition?, 2003, 35(6): 837-843.
[33] 王旭东, 陈鲜妮, 王彩霞, 田霄鸿, 吴发启. 农田不同肥力条件下玉米秸秆腐解效果. 农业工程学报, 2009, 25(10): 252-257.
WANG X D, CHEN X N, WANG C X, TIAN X H, WU Q F. Decomposition of corn stalk in cropland with different fertility., 2009, 25(10): 252-257. (in Chinese)
[34] 孙星, 刘勤, 王德建, 张斌. 长期秸秆还田对土壤肥力质量的影响. 土壤, 2007, 39(5): 782-786.
SUN X, LIU Q, WANG D J, ZHANG B. Effect of long-term straw application on soil fertility., 2007, 39(5): 782-786. (in Chinese)
[35] LI D D, CHEN L, XU J S H, MA L, Olk Dan C, ZHAO B Z, ZHANG J B, XIN X L. Chemical nature of soil organic carbon under different long-term fertilization regimes is coupled with changes in the bacterial community composition in a Calcaric Fluvisol.2018, 54(8): 999-1012.
[36]. MARSCHNER P, KANDELER E, MARSCHNER B. Structure and function of the soil microbial community in a long-term fertilizer experiment.2003, 35(3): 453-461.
[37] MOORE-KUCERA J, DICK R P. Application of C-13-labeled litter and root materials for in situ decomposition studies using phospholipid fatty acids.2008, 40(10): 2485-2493.
[38] ELFSTRAND S, LAGERLOF J, HEDLUND K, MARTENSSON A. Carbon routes from decomposing plant residues and living roots into soil food webs assessed with C-13 labelling., 2008, 40(10): 2530-2539.
[39] CONRAD R. Contribution of hydrogen to methane production and control of hydrogen concentrations in methanogenic soils and sediments.1999, 28(3): 193-202.
[40] NOLL M, MATTHIES D, FRENZEL P, DERAKSHANI M, LIESACK W. Succession of bacterial community structure and diversity in a paddy soil oxygen gradient., 2005, 7(3): 382-395.
Microbial Transformation Process of Straw-Derived C in Two Typical Paddy Soils
QIU CunPu1,2, CHEN XiaoFen3, LIU Ming1,2, LI WeiTao1, WU Meng1, JIANG ChunYu1, FENG YouZhi1,2, LI ZhongPei1, 2
(1State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008;2University of Chinese Academy of Sciences, Beijing 100049;3Soil and Fertilizer & Resources and Environment Institute, Jiangxi Academy of Agricultural Sciences, Nanchang 330200)
【】The straw degradation rate, microbial community structure changes and functional microbial community composition involved in straw decomposition in soils were researched, and the research results could provide the theoretical foundation for revealing microbial mechanism of the soil organic matter transformation and accumulation. 【】Two typical subtropical paddy soil in China, including Changshu Wushan soil and Yingtan Red paddy soil, were collected as the research materials. We anaerobically incubated the soils with/without13C-enriched rice straw for 38 days. Gaseous samples were regularly collected to investigate mineralization rate of straw in dynamic changes. The soil samples were collected to analyze the dynamic changes of the microbial community composition related to straw decomposition by using13C-PLFA-SIP technology. 【】At the early stage before day 12 of the anaerobic culture, straw degraded slowly, and straw had positive priming effect on soil organic matter (SOM). At the stage of day 12-18, straw degraded rapidly and then the rate tended to be slow after day 18. At the end of incubation, straw mineralization rate was 24% and 33% in Red paddy soil and Wushan soil, respectively. The contribution of straw C to C efflux increased with incubation time, which was 53%-60% and 54%-57% to CO2and CH4efflux, respectively. The microbial biomass and activity were improved in the soil with straw, and the microbial activity in Wushan soil was higher than that in Red paddy soil. During straw degradation, 16:0 (general bacteria) was the main groups. i16:0, i15:0 (G+bacteria) and 18:1ω9c (fungi) were also important microbial groups involved in straw degradation. The relative abundance of straw-derived gram-positive (G+) bacteria and actinomycetes increased and gram-positive (G-) bacteria decreased with incubation time. The proportions of straw-derived PLFAs were 27%-32% and 18%-24% in Red paddy soil and Wushan soil PLFAs, respectively. The straw utilization efficiency was higher in fungi and general bacteria, while G-bacterial and actinomycetes PLFAs were preferentially linked to extant soil organic matter (SOM) mineralization. The microbial community composition was different between Wushan soil and Red paddy soil with rice straw. The straw-derived microbial community composition was similar in two soils, but the SOM-derived microorganisms were differences. 【】The mineralization of straw C lagged behind extant SOM during anaerobic straw degradation. The microbial activity and diversity in soil were important factors influencing the efficiency of straw mineralization. After adding straw in soil, it’s showed differences from the microbial community composition, which were mainly involved in the differences between SOM-derived microorganisms, and SOM was an important factor leading to these differences.
rice straw degradation;13C-PLFA-SIP; paddy soil; microbial community
10.3864/j.issn.0578-1752.2019.13.007
2018-12-22;
2019-03-11
国家自然科学基金(41430859)、国家重点研发计划项目(2018YFD0301104-01)、中国博士后基金(2018M640530)
仇存璞,Tel:025-86881313;E-mail:cpqiu@issas.ac.cn。
李忠佩,Tel:025-86881323;E-mail:zhpli@issas.ac.cn。通信作者冯有智,Tel:025-86881367;E-mail:yzfeng@issas.ac.cn
(责任编辑 李云霞)

