小粒黑豆GmRHF1基因生物信息学及线虫诱导表达分析
王 芳,吴 鹏,张珍珠,刘林馨,段玉玺
(1.齐齐哈尔大学 生命科学与农林学院/抗性基因工程与寒地生物多样性保护黑龙江省重点实验室,黑龙江 齐齐哈尔 161006; 2.沈阳农业大学 植物保护学院,辽宁 沈阳 110866)
泛素/26S蛋白酶体途径(Ubiquintin/26S-proteasome system,UPS)是真核生物体内高度保守的选择性蛋白质降解的主要途径。这一过程中,在ATP供能条件下,泛素(Ub)与泛素激活酶(E1)结合,然后转移至泛素结合酶(E2)。E2中间体与泛素连接酶(E3)催化泛素转移至特定的目标蛋白质和/或自动泛素化 E3本身。E3在泛素调节的蛋白质降解过程中负责识别特异性的底物蛋白,被认为是泛素化过程中最重要的组成部分。研究发现,拟南芥中超过1 400个基因编码E3泛素连接酶, 其中许多含有相同的RING-finger蛋白质结构域,称之为 RING(Really interesting new gene)家族,在40~60个氨基酸残基中具有一段保守的序列Cys-X2-Cys-X(9~39)-Cys-X(1~3)-His-X(2~3)-Cys/His-X2-Cys-X(4~48)-Cys-X2-Cys,是数量最庞大、类型最丰富的一类单亚基连接酶。经预测,拟南芥中存在477个RING-finger E3连接酶,水稻中488个,苹果中688个,芜菁中715个,大豆中760个[1-6]。它们具有一类特殊的RING-finger结构域,其由8个间隔精确的半胱氨酸和组氨酸残基组成,以交叉支撑(Cross-brace)的形式协调2个锌离子。根据第5位氨基酸是Cys还是His,分为RING-H2(C3H2C3)和RING-HC(C3HC4)2种,此外还有一些非典型的RING-finger结构域,如RING-v、RING-C2、RING-D、RING-S/T、RING-G等。RING-finger 与E2泛素结合酶结合,将E2和底物结合在一起。
在RING家族中有1个特殊亚族ATL(ArabidopsisTóxicos en Levadura),该家族蛋白质含有1个高度保守的RING-H2 zinc finger结构域和至少1个跨膜结构域(TM),在激发子处理后快速诱导表达。对ATL的功能分析表明,其调节植物中不同的途径,包括幼苗萌发后生长过渡、根系发育过程中细胞死亡的调控、胚乳发育过程或短日条件下向开花过渡过程中的氮素响应、激发子及抗病反应等生物进程[7]。
大豆胞囊线虫(Soybean cyst nematode,SCN,Heteroderaglycines)是一种内寄生线虫,在大豆生产中造成重大的经济损失。课题组在前期研究中,通过构建大豆胞囊线虫诱导小粒黑豆(Glycinemax)的早期基因差异表达SSH-cDNA文库,筛选到1个差异表达基因EST片段,在NCBI中进行BLASTn比对,该片段与大豆序列XM_003521788同源,一致性为99%,推测该基因片段为RING家族成员,参与抗线虫反应。为进一步验证和明确该基因的功能,利用RT-PCR方法克隆该基因cDNA序列,分析其在大豆胞囊线虫侵染前期的表达量变化模式,为该基因的功能鉴定奠定基础。
1 材料和方法
1.1 材料
供试大豆类型为小粒黑豆(国家编号ZDD1412),其抗大豆胞囊线虫3号生理小种,由沈阳农业大学北方线虫所保存。大豆胞囊线虫3号生理小种由沈阳农业大学北方线虫实验室繁殖保存。
1.2 线虫接种
将大豆种子用1%次氯酸钠溶液浸泡10 min,无菌水清洗,放入湿润的无菌滤纸培养皿中,25 ℃培养催芽2 d。待胚根长到约1 cm时移至塑料钵(12 cm×13 cm,含50%细沙、50%有机土壤)中,每钵移植1株幼苗。
用组织研磨器将大豆胞囊线虫卵从胞囊中释放出来,置于0.545 g/L的ZnCl2溶液中,27 ℃刺激线虫孵化3 d。大豆真叶展开后进行接种。在每棵植株根部附近注入4 000个二龄幼虫/卵的悬浮液。接种后12、24、36、48、72 h 取大豆根尖组织,液氮速冻,-70 ℃保存。以接种无菌水为对照。每个处理10株,重复3次。
1.3 核酸的提取及cDNA合成
使用TRizol (天根)试剂提取大豆根尖组织总RNA,按照Promega Reverse Transcription System反转录获得cDNA。反应体系为20 μL,其中MgCl24 μL,10×反转录缓冲液2 μL,dNTP混合物2 μL,RNasin核糖核酸酶抑制剂0.5 μL,AMV反转录酶0.6 μL,Oligo(dT)15引物1 μL,总RNA 1 μg,加无核酸酶水至总体积20 μL。42 ℃温育60 min,95 ℃ 加热5 min灭活反转录酶,-20 ℃保存备用。
1.4 GmRHF1基因的克隆
根据NCBI中大豆参考序列XM_003521788,设计GmRHF1基因特异性扩增引物(表1),进行PCR扩增。反应体系:cDNA模板1.5 μL,2×TaqPCR Master Mix(天根)12.5 μL,上游引物(10 μmol/L)1 μL,下游引物(10 μmol/L)1 μL,加ddH2O至25 μL。反应程序:95 ℃预变性 2 min;95 ℃ 变性30 s,57 ℃退火 30 s,72 ℃延伸1 min,30个循环;72 ℃延伸10 min。PCR扩增产物经凝胶回收纯化后,连接至pGEM-T Easy Vector(Promega,USA),将含有目的基因的质粒送生工生物工程(上海)有限公司测序。

表1 克隆和qRT-PCR反应的引物序列
1.5 不同处理GmRHF1基因表达分析
提取不同时间未接种及接种线虫的大豆根尖组织总RNA,反转录成cDNA模板,以大豆Actin11为内参基因,利用Primer Premier 5软件设计实时荧光定量PCR(qRT-PCR)引物(表1),利用qRT-PCR反应,分析线虫侵染前期根部GmRHF1的表达模式。反应体系参照荧光定量试剂盒SYBR Green(天根,FP209)说明书。反应程序:95 ℃预变性10 min;95 ℃ 变性30 s,56 ℃退火30 s,72 ℃延伸1 min,40个循环。采用2-ΔΔCt方法进行基因相对表达量分析。
1.6 序列生物信息学分析
在NCBI进行BLAST同源比对、开放阅读框分析(http://www.ncbi.nlm.nih.gov/gorf/orfig.cgi)及外显子数目和位置预测(http://gsds.cbi.pku.edu.cn/index.php);利用在线软件分析氨基酸序列组成、蛋白质分子质量、等电点(pI)等理化性质(http://web.expasy.org/protparam/)。采用DNAMAN 6.0 进行氨基酸序列比对,采用MEGA 5.0对大豆、拟南芥等RING-H2氨基酸序列构建系统进化树。
1.7 数据分析
采用SPSS 22.0 软件进行单因素方差分析和LSD显著性检验(P<0.05)。
2 结果与分析
2.1 小粒黑豆GmRHF1基因克隆
根据前期构建的大豆胞囊线虫诱导小粒黑豆表达SSH-cDNA文库获得的EST序列M0509,在NCBI数据库中进行BLASTn比对,利用 Primer Premier 5 设计特异性引物,以小粒黑豆cDNA为模板,PCR扩增获得大小约为1 300 bp的片段(图1)。采用凝胶纯化回收该片段,克隆后经蓝白斑筛选,用EcoR Ⅰ限制性内切酶对重组子酶切,电泳鉴定结果表明,目的基因已成功克隆至载体中(图2)。测序产物在GenBank中经BLASTn比对分析,与大豆参考序列相似性达100%,将其命名为GmRHF1。
2.2 小粒黑豆GmRHF1 生物信息学分析
2.2.1 氨基酸序列分析 从小粒黑豆中克隆目标基因GmRHF1的cDNA,其位于大豆基因组3号染色体上,在263—1 045 bp处有一个外显子区,含有完整的编码区序列(CDS),长度783 bp,编码260个氨基酸。经ExPASy 软件预测,蛋白质分子质量为27 880.43 u,分子式C1 211H1 907N343O383S15,pI为5.59。在NCBI数据库中用CDD search进行基因编码蛋白的保守结构域分析,发现在N末端102—145位氨基酸处具有RING-H2 finger(C3H2C3型)结构模体C-X2-C-X(9~39)-C-X(1~3)-H-X(2~3)-H-X2-C-X(4~48)-C-X2-C,结构域氨基酸序列为CAVCLSEVVEGEKARLLPKCNHGFHVACIDMWFQ-SHSTCPLC。在模体上具有Zn2+结合和多肽底物结合2个功能位点。其属于RING-finger H2_EL5 亚类、RING Ubox超家族(图3)。

M.DL2000 Marker;1.cDNA扩增产物
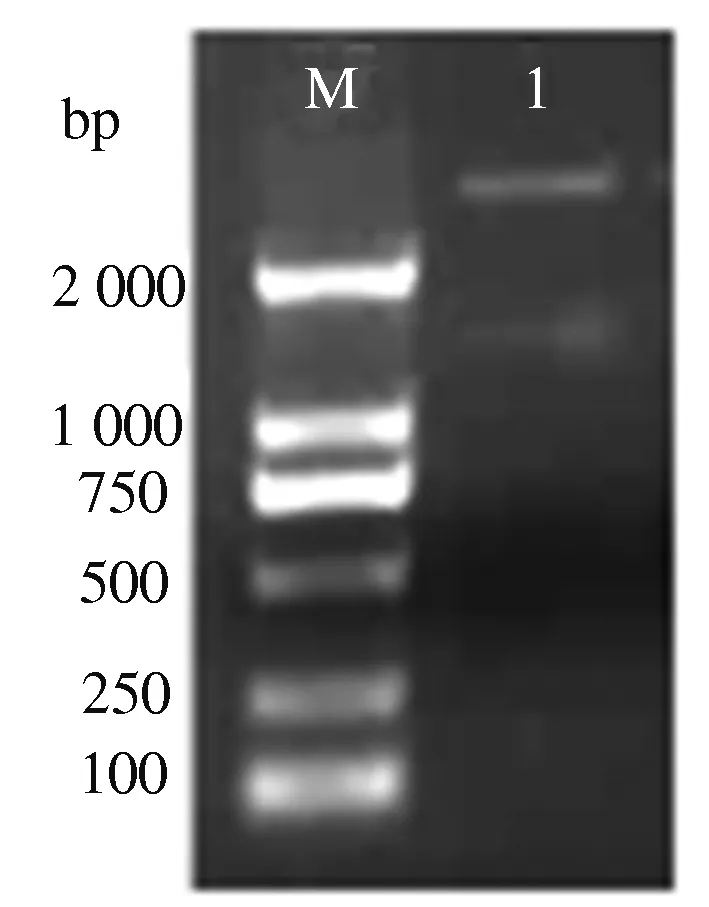
M.DL2000 Marker;1.重组质粒EcoR I酶切产物

图3 GmRHF1蛋白保守结构域预测结果Fig.3 Conserved domain of GmRHF1 protein predicted by CDD software
利用在线软件TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)及HMMER(https://www.ebi.ac.uk/Tools/hmmer)对GmRHF1蛋白进行跨膜结构预测。结果均显示,GmRHF1的1—22位氨基酸位于细胞膜表面,23—45位氨基酸(IMIVVIIIMFFVIVIALCLHLFA)之间有一个典型的跨膜螺旋区,46—260位氨基酸位于细胞膜内(图4)。

图4 GmRHF1蛋白跨膜区分析结果Fig.4 Prediction of GmRHF1 transmembrane region
2.2.2 同源性比对分析 将 GmRHF1氨基酸序列在NCBI数据库中进行BLASTp比对,从拟南芥、大豆、水稻、辣椒及秀丽隐杆线虫中检索到与 GmRHF1同家族或具有相同功能结构域的蛋白质,进行氨基酸序列比对(图5)。这些序列具有相似的GLD 保守区域及RING-H2 zinc finger 模体。Gm-RHF1(XP_003521836.1)与栽培大豆(Glycinemax)ATL3家族的2个蛋白质(XP_003548383.1、XP_003529860.1)在RING-H2 模体中分别存在5个和4个氨基酸差异,与苜蓿(Medicagotruncatula)ATL3蛋白(XP_013450635.1)存在7个氨基酸差异,与栽培大豆ATL63蛋白(XP_003552944.1)存在11个氨基酸差异,与拟南芥(Arabidopsisthaliana)ATL3蛋白(AAD33581.1)存在6个氨基酸差异。系统进化树分析表明,GmRHF1与苜蓿ATL3蛋白(XP_013450635.1)的亲缘关系最近,其次是栽培大豆ATL3
蛋白(XP_003548383.1、XP_003529860.1),再次是栽培大豆ATL63蛋白(XP_003552944.1)、野生大豆(Glycinesoja)ATL3蛋白(A0A0B2P3C5)等,与模式线虫秀丽隐杆线虫(Caenorhabditiselegans)Rbx1蛋白(BAB83695.1)亲缘关系最远(图6)。
2.2.3 与拟南芥 ATL家族成员进化关系分析 由于拟南芥是模式植物,其中RING-H2类型中的ATL家族成员的研究较深入,故将大豆GmRHF1与拟南芥 ATL家族成员进行进化关系分析(图7)。从UniProtKB数据库(https://www.uniprot.org/)中检索RING-H2 ATL 家族成员,共检索到拟南芥成员84个、水稻成员2个,与GmRHF1(XP_003521836.1)构建系统发育树,结果表明,GmRHF1与 拟南芥ATL3和ATL60相似度较高,亲缘关系较近,与拟南芥ATL家族中鉴定到的第一个成员ATL2也在一个大的聚类中。
2.3 小粒黑豆根组织中GmRHF1基因诱导表达分析
利用qRT-PCR方法探索在接种大豆胞囊线虫后12~72 h,小粒黑豆根尖组织GmRHF1基因表达量的变化。对试验中涉及的主要参数进行分析,内参基因和目的基因的扩增曲线均为标准的S型(图8)。在第19个循环处进入指数增长期,熔解曲线的峰型单一(图9),表明样品质量较高,引物特异性较好,无引物二聚体及非特异性扩增产物。
研究结果表明,GmRHF1在接种无菌水的对照组内表达量相对稳定;接种大豆胞囊线虫后12~48 h,其表达量均呈现上升趋势,分别为对照样品中表达量的3.04、3.75、2.24、1.66倍,均达到显著性差异(P<0.05);接种后72 h,表达量是对照的0.85倍,比对照下降15%,未达到显著性差异(P>0.05)(图10)。由此表明,该基因参与线虫侵染前期的抗病反应。

Gm.Glycine max; Gs.Glycine soja; Mt.Medicago truncatula; At.Arabidopsis thaliana; Ca.Capsicum annuum;

图6 GmRHF1(XP_003521836.1)与其他物种RING-H2 zinc finger蛋白的系统发育树Fig.6 Phylogenetic tree of GmRHF1(XP_003521836.1)and other RING-H2 zinc finger proteins
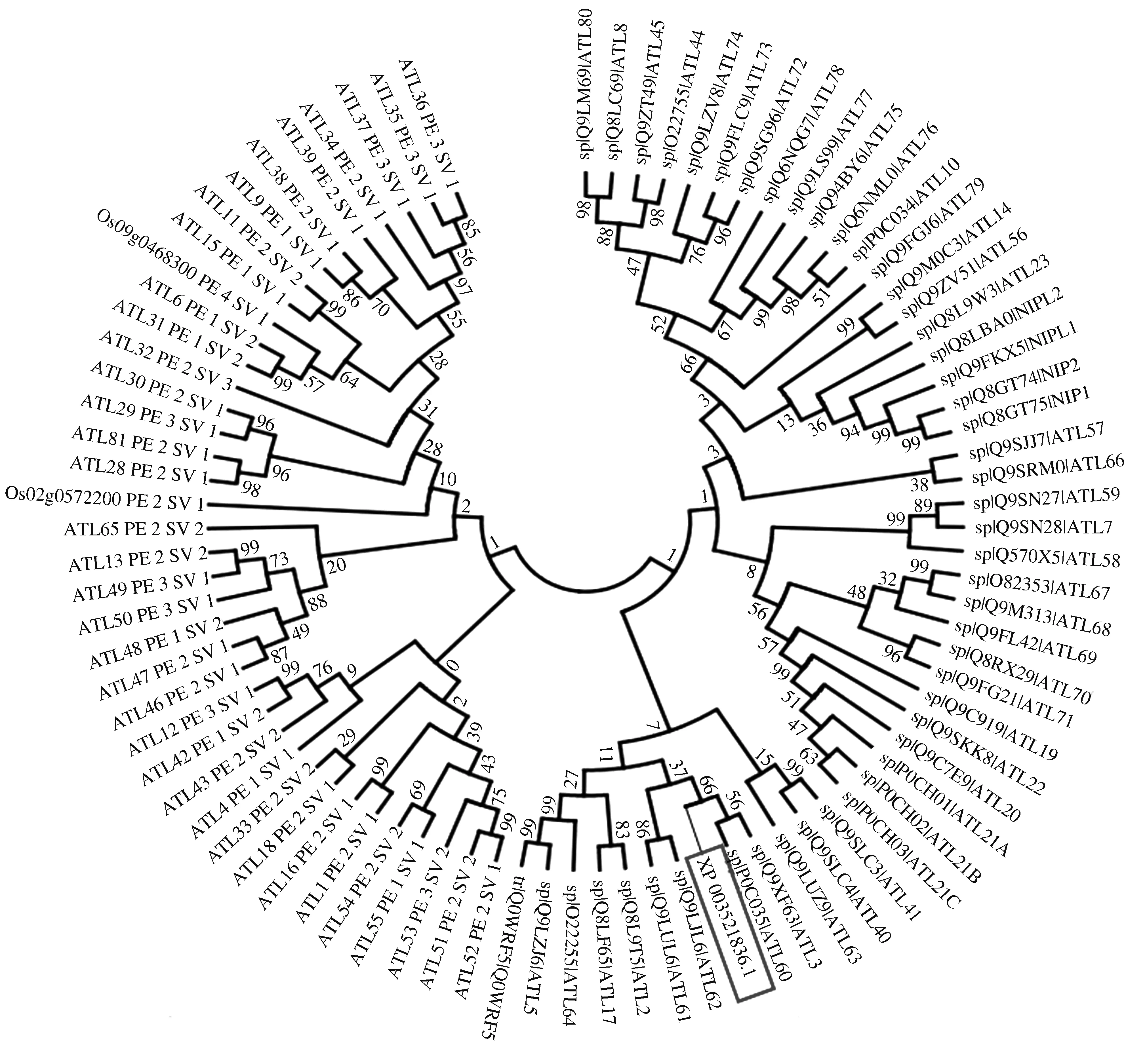
图7 GmRHF1与拟南芥ATL家族成员的进化关系分析Fig.7 Phylogenic analysis of GmRHF1 and ATL proteins from Arabidopsis thaliana
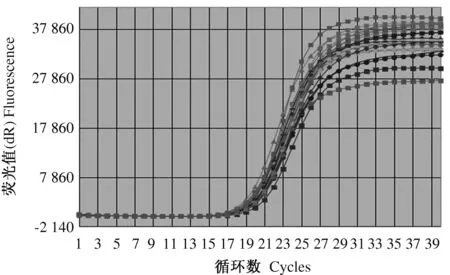
图8 Actin11和GmRHF1的扩增曲线Fig.8 Amplification plots of Actin11 and GmRHF1

图9 Actin11和 GmRHF1的熔解曲线Fig.9 Dissociation curve of Actin11 and GmRHF1

不同小写字母表示在0.05水平差异显著
3 结论与讨论
可逆的蛋白质泛素化作为一种蛋白质翻译后修饰,不需要从头合成蛋白质,可使细胞对外界刺激做出快速和特异性反应。E3泛素连接酶在这一途径中负责识别特异性底物蛋白,被认为是泛素化过程中最重要的组成部分。其中,Ring-finger型蛋白家族是数量最庞大、类型最丰富的一类单亚基连接酶。ATL家族是一个含有RING-H2结构域的特殊家族,含有1个高度保守的RING-H2 zinc finger结构域和至少1个跨膜结构域,在激发子处理后快速诱导表达,在拟南芥中有91个成员,在水稻中有121个成员[7]。本研究中,大豆GmRHF1含有1个RING-H2结构域和1个跨膜区,同源比对及系统进化分析表明,其属于 RING-H2 zinc finger ATL3 类,与拟南芥ATL家族具有一定的进化关系。大量研究发现,植物RING-H2 ATL类中的基因参与抗病防御反应。拟南芥ATL2基因由几丁质特异性诱导,在激发子反应通路早期以及水杨酸和茉莉酸介导的防御反应通路中发挥作用[8]。ATL6和ATL31参与对番茄细菌性疫病病原菌(Pseudomonassyringaepv.tomatoDC3000)的防御反应[9]。ATL9是ATL家族中含有PEST结构域的一种特殊蛋白质,参与对活体营养型生物病原真菌续断菊白粉病菌(Golovinomycescichoracearum)的基础抗性,以及几丁质和NADPH氧化酶介导的防御反应[10]。
在NCBI数据库保守结构域Conserved Domains中分析发现,GmRHF1具有类RING-H2_EL5结构特征。EL5又称蛋白质激发子5,是一种E3泛素蛋白连接酶,包含N-端跨膜结构域和C3H2C3型RING-H2 finger,是E2泛素结合酶的结合位点,通过泛素Lys48残基催化多聚泛素化蛋白。N-乙酰壳寡糖激发子可快速诱导该蛋白质的合成。EL5于水稻根系原始形成后,在维持细胞活力方面发挥着至关重要的作用。它还作为一种抗细胞坏死酶,介导植物激素作用后根细胞中产生的细胞毒性蛋白的降解。此外,EL5通过RING-H2 finger与水稻泛素载体蛋白UBC5b相互作用[11]。接种大豆胞囊线虫后的24 h是线虫在寄主细胞中移动和建立取食位点的时间,也是线虫与寄主斗争最激烈的时间。本研究中荧光定量PCR分析发现,GmRHF1在接种大豆胞囊线虫后48 h内表达量显著升高,推测该基因介导大豆与线虫的不亲和性互作反应,其具体调控机制有待于进一步研究。

