露地和大棚条件下鱼藤酮和印楝素在黄瓜和土壤中的残留及消解动态
陈 妍,刘新社
(商丘职业技术学院,河南 商丘 476000)
近年来,大棚蔬菜种植规模越来越大。黄瓜是大棚蔬菜主栽品种之一,由于其生长速度快,采收间隔期短,致使农药残留风险增大[1]。有研究表明,农药在大棚作物中的残留量均高于露地,而我国农药残留登记试验大多在露地条件下完成,得出的残留数据和安全间隔期主要适用于露地环境[2-5]。因此,对比研究常用农药在露地和大棚条件下的消解残留对保障农产品质量安全具有重要意义。
鱼藤酮是用于蔬菜、果树和茶叶的新型植物源杀虫剂,广泛存在于鱼藤属植物的根皮部,因其高效低毒、广谱、杀虫快、残留时间短、害虫不易产生抗性等特点,被视为较理想的杀虫剂[6]。近年来有研究表明,鱼藤酮为强烈的神经毒剂,与包括帕金森综合症在内的一些疾病有关,且对水生生物有极高的毒性[7]。印楝素存在于印楝树的种子、树叶及树皮中,具有对有害生物高效、对非靶标生物安全、易分解、不污染环境等特点,是世界上公认的理想植物杀虫剂[8]。目前,有关鱼藤酮和印楝素在露地环境下的残留及消解行为已有一些研究报道[9-19],但尚未见有关2种药剂在大棚蔬菜与露地蔬菜中残留规律的比较研究,随着鱼藤酮和印楝素的广泛应用,开展二者在农产品中的残留检测尤为重要。因此,采用乙腈提取、Florisil固相萃取柱净化、高效液相色谱分析(HPLC)的方法,测定了鱼藤酮和印楝素在露地和大棚2种栽培模式下黄瓜和土壤中的消解动态和最终残留,旨在阐明不同的栽培模式下,鱼藤酮和印楝素在黄瓜及其土壤中的残留差异,以期为鱼藤酮和印楝素在露地和大棚蔬菜上的科学施用提供参考。
1 材料和方法
1.1 供试材料
药品与试剂:2.5%鱼藤酮乳油购自深圳市华农生物工程有限公司;0.3%印楝素乳油购自成都绿金生物科技有限责任公司;鱼藤酮标准品(纯度98.5%)、印楝素标准品(纯度95%)均购自美国Sigma公司;其他试剂均为分析纯。
仪器与设备:Agilent 1100液相色谱仪(配紫外检测器、自动进样器、化学工作站)、FJ-200高速匀浆机(上海标本模型厂)、FA2104电子天平(上海良平仪器仪表有限公司)、高速离心机(美国Beckman公司)、BUCHIR-210旋转蒸发仪(瑞士BUCHI公司)、SX-4-10马弗炉(沪南电炉烘箱厂)、DC-12 氮吹仪配有DC-12H恒温水浴锅(上海安谱科学仪器有限公司)及其他实验室常用仪器和设备。
供试作物:黄瓜品种为津优2号。
1.2 试验设计
于2018年在河南省商丘市同时进行露地和大棚条件下的消解动态和最终残留试验。2块地土质、肥力等条件相似,常规栽培管理,露地和大棚同时种植黄瓜津优2号。参照《农药残留试验准则》(NY/T 788—2004)[20]要求设置试验小区,每处理重复3次,小区面积为20 m2,各小区之间设置保护行,设空白对照处理。黄瓜样品:采用随机的方法在试验小区内不同方向及上下不同部位采集6条以上 (不少于2 kg) 生长正常、无病害、成熟的黄瓜果实;土壤样品:5点法取样,使用专用土壤采样铲,采样深度为0~15 cm (消解动态试验0~10 cm),每小区采样不少于1 kg。土壤在挑出石块、草根等杂物后混匀,自然风干,用缩分法缩分后取四分之一储存;对于黄瓜样品,用不锈钢刀切成1 cm大小的碎块,在不锈钢盆中充分混匀,四分法缩分,取2份150 g的样品,分别装入封口袋中储存。将样品冷藏在-20 ℃冷库中,全部用聚乙烯塑料袋包装,待测。
1.2.1 消解动态试验 2.5%鱼藤酮乳油和0.3%印楝素乳油,分别按有效成分84.375(推荐高剂量的1.5倍)、40.50 g/hm2(推荐高剂量的10倍)的剂量,于黄瓜果实生长至成熟个体约1/2大小时对水均匀喷雾1次,分别于施药后1、6 h和1、2、3、5、7、10、14 d采集黄瓜样品,测定黄瓜中鱼藤酮和印楝素的残留量。另外,在露地和大棚的试验地块,分别选20 m2表面平整、墒情良好的空地,按上述剂量加水稀释后对地表进行喷雾,于施药后1、6 h和1、2、3、5、7、10、14 d采集土壤样品,测定土壤中鱼藤酮和印楝素的残留量。
1.2.2 最终残留试验 采用2.5%鱼藤酮乳油和0.3%印楝素乳油,设低剂量56.25、4.05 g/hm2(推荐高剂量)和高剂量84.375、6.075 g/hm2(高剂量的1.5倍)分别施药2次和3次,施药间隔期为6 d。于黄瓜果实生长初期施药,按施药剂量从低到高均匀喷雾,于最后一次施药后3、5、7 d采集黄瓜和土壤样品,测定鱼藤酮和印楝素的残留量。
1.3 分析方法
1.3.1 样品提取与净化
1.3.1.1 黄瓜 准确称取10.0 g黄瓜样品于100 mL离心管中,加入30 mL乙腈溶液,高速匀浆2 min后,加入3 g氯化钠,涡旋1 min,4 000 r/min离心5 min,然后静置40 min,使乙腈相和水相分层。取15 mL有机相于100 mL梨形瓶中,旋转蒸发仪浓缩 (40 ℃)近干,用正己烷定容至2 mL,待净化。
预先用5.0 mL正己烷活化Florisil固相萃取柱,将上述黄瓜样品浓缩液转入柱内,待样液全部通过Florisil柱后,依次用8 mL正己烷-丙酮(体积比7∶3)、8 mL正己烷-丙酮(体积比6∶4)淋洗,收集洗脱液,旋转蒸发仪浓缩(40 ℃)近干,用甲醇定容到2 mL,过0.22 μm滤膜,待HPLC检测。
1.3.1.2 土壤 准确称取10.0 g土壤样品于100 mL离心管中,加入50 mL乙腈溶液,高速匀浆3 min后,加入5 g氯化钠,涡旋2 min,4 000 r/min离心5 min,然后静置40 min,使乙腈相和水相分层。取25 mL有机相于100 mL梨形瓶中,旋转蒸发仪浓缩 (40 ℃)近干,用甲醇定容至2 mL,过0.22 μm滤膜,待HPLC检测。
1.3.2 HPLC检测条件 色谱柱:Agilent TC-C18(250 mm×4.6 μm,5 μm);流速:1 mL/min;进样量:10 μL;柱温:30 ℃;鱼藤酮洗脱条件:等浓度洗脱,V乙腈∶V水=70∶30,检测波长299 nm;印楝素洗脱条件:等浓度洗脱,V乙腈∶V水=40∶60,检测波长217 nm;定量方式采用外标法。
1.3.3 标准储备液和标准曲线制备 准确称取鱼藤酮、印楝素各10 mg(精确至0.01 mg),用甲醇溶解并定容至100 mL,配成质量浓度为100 mg/L的标准母液。
标准曲线制作:取适量的标准母液用甲醇稀释成5、1、0.5、0.1、0.05、0.01 mg/L的标准溶液,按照1.3.2中仪器条件进行测定,以峰面积(y)为纵坐标、质量浓度(x)为横坐标绘制标准曲线。
1.3.4 添加回收试验 在空白黄瓜、土壤样品中进行3个水平(分别0.01、0.1、0.5 mg/kg)的添加回收试验,每一添加水平做5个平行,按照1.3.1中样品的提取、净化方法进行处理,另设空白对照,按照1.3.2中检测条件测定鱼藤酮和印楝素在黄瓜和土壤中的添加回收率。
1.3.5 数据处理 采用一级动力学方程式(Ct=C0e-kt)计算鱼藤酮和印楝素在黄瓜或土壤中的残留量,半衰期(T1/2)=ln2/k。
2 结果与分析
2.1 鱼藤酮和印楝素标准曲线的绘制
由图1、2可知,在0.01~5 mg/L质量浓度范围内,鱼藤酮和印楝素峰面积(y)与质量浓度(x)呈良好线性关系,鱼藤酮标准曲线方程y=19 890x+807.12(r2=0.999 3),印楝素标准曲线方程y=7 484.4x+90.734(r2=0.999 8),能够满足外标法定量检测鱼藤酮和印楝素残留量的要求。

图1 鱼藤酮标准曲线 Fig.1 Standard curve of rotenone
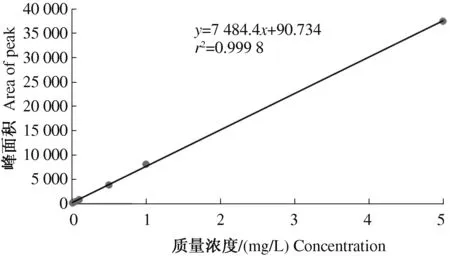
图2 印楝素标准曲线Fig.2 Standard curve of azadirachtin
2.2 HPLC法测定鱼藤酮和印楝素的灵敏度、准确度及精密度
根据添加回收率试验结果(表1),在1.3.2中的仪器条件下,鱼藤酮和印楝素在黄瓜和土壤中的最低检出浓度均为0.01 mg/kg,最小检出量均为0.036 ng。在0.01、0.1、0.5 mg/kg添加水平下,鱼藤酮和印楝素在黄瓜中的平均回收率分别为94.7%~96.7%、94.1%~94.7%,相对标准偏差分别为2.4%~5.5%、2.8%~4.2%;在土壤中的平均回收率分别为95.7%~99.5%、92.5%~99.3%,相对标准偏差分别为2.5%~6.9%、2.5%~6.0%。该方法的灵敏度、准确度和精密度均符合国家农业行业标准《农药残留试验准则》(NY/T 788—2004)[20]的要求,能够用于实际样本的残留量检测分析。

表1 鱼藤酮和印楝素在黄瓜和土壤中的添加回收率和相对标准偏差(n=5)Tab.1 Recovery rate and relative standard deviation (RSD) for rotenone and azadirachtin in cucumber and soil (n=5)
2.3 鱼藤酮和印楝素在黄瓜中的消解动态
黄瓜中消解动态测定结果(表2)表明,露地和大棚黄瓜中的鱼藤酮和印楝素残留量随时间延长而降低,且二者的残留降解符合一级动力学方程Ct=C0e-kt。施药后1 h,鱼藤酮在露地和大棚黄瓜中的原始沉积量分别为0.632 4、0.732 4 mg/kg,其消解动力学方程分别为C=0.512 3e-0.476 8t、C=0.580 6e-0.399 0t,R2分别为0.929 8、0.977 0,消解半衰期分别为1.45、1.74 d;印楝素在露地和大棚黄瓜中的原始沉积量分别为0.823 6、1.107 2 mg/kg,其消解动力学方程分别为C=1.043 2e-0.625 6t、C=1.463 6e-0.511 4t,R2分别为0.982 5、0.918 8,消解半衰期分别为1.11、1.36 d。露地黄瓜中鱼藤酮和印楝素原始沉积量均低于大棚,而大棚黄瓜中鱼藤酮和印楝素的半衰期均长于露地。
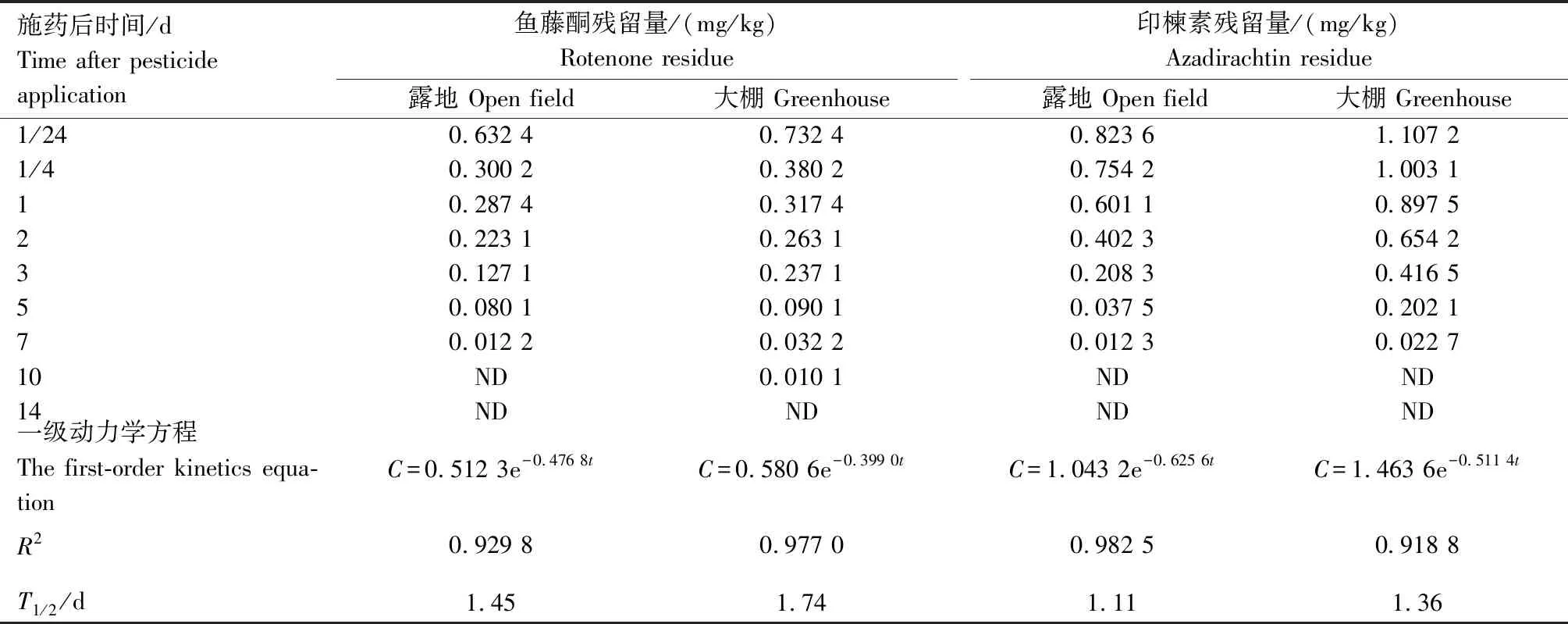
表2 鱼藤酮和印楝素在黄瓜中的消解动态Tab.2 Degradation dynamics of rotenone and azadirachtin in cucumber
注:C是残留量,t是施药后时间,T1/2是消解半衰期;ND表示未检出(即样品中鱼藤酮和印楝素残留量低于方法最低检出浓度)。下同。
Note:Cis the residue,tis the time after pesticide application, andT1/2is the half-life; ND means that the pesticides are not detected (i.e. the residues of rotenone and azadirachtin in the samples are lower than the minimum detected concentration).The same as below.
2.4 鱼藤酮和印楝素在土壤中的消解动态
土壤中消解动态测定结果(表3)表明,露地和大棚土壤中的鱼藤酮和印楝素残留量随时间延长而降低,且二者的残留降解符合一级动力学方程Ct=C0e-kt。施药后1 h,鱼藤酮在露地和大棚土壤中的原始沉积量分别为0.552 4、0.665 1 mg/kg,其消解动力学方程分别为C=0.383 9e-0.293 9t、C=0.262 5e-0.264 7t,R2分别为0.963 2、0.863 9,消解半衰期分别为2.36、2.62 d;印楝素在露地和大棚土壤中的原始沉积量分别为0.328 7、0.376 3 mg/kg,其消解动力学方程分别为C=0.357 7e-0.372 4t、C=0.379 2e-0.317 8t,R2分别为0.971 4、0.959 2,消解半衰期分别为1.86、2.18 d。露地土壤中鱼藤酮和印楝素原始沉积量均低于大棚,而大棚土壤中鱼藤酮和印楝素的半衰期均长于露地。

表3 鱼藤酮和印楝素在土壤中的消解动态Tab.3 Degradation dynamics of rotenone and azadirachtin in soil
2.5 鱼藤酮和印楝素在黄瓜和土壤中的最终残留量
由表4可知,无论大棚或露地,黄瓜和土壤中鱼藤酮的最终残留量随施药剂量、施药次数的增加而增加,随采样时间的延长而逐渐降低,并且大棚黄瓜和土壤中鱼藤酮的残留量稍高于露地。2.5%鱼藤酮乳油按推荐剂量56.25 g/hm2和1.5倍推荐剂量84.375 g/hm2分别施药2~3次,末次施药后3 d,露地采收的黄瓜和土壤中鱼藤酮的最高残留量分别是0.136 8、0.157 6 mg/kg,大棚采收的黄瓜和土壤中鱼藤酮的最高残留量分别是0.203 1、0.214 4 mg/kg;末次施药后5 d,露地采收的黄瓜和土壤中鱼藤酮的最高残留量分别是0.065 2、0.073 2 mg/kg,大棚采收的黄瓜和土壤中鱼藤酮的最高残留量分别是0.084 1、0.102 1 mg/kg;末次施药后7 d,露地采收的黄瓜和土壤中鱼藤酮的最高残留量分别是0.017 4、0.023 2 mg/kg,大棚采收的黄瓜和土壤中鱼藤酮的最高残留量分别是0.020 1、0.028 9 mg/kg。
由表4还可知,0.3%印楝素乳油按推荐剂量4.05 g/hm2和1.5倍推荐剂量6.075 g/hm2分别施药2~3次,末次施药后3、5、7 d露地和大棚采收的黄瓜和土壤中印楝素的残留量均未检出(即样品中印楝素的残留量低于方法最低检出浓度)。
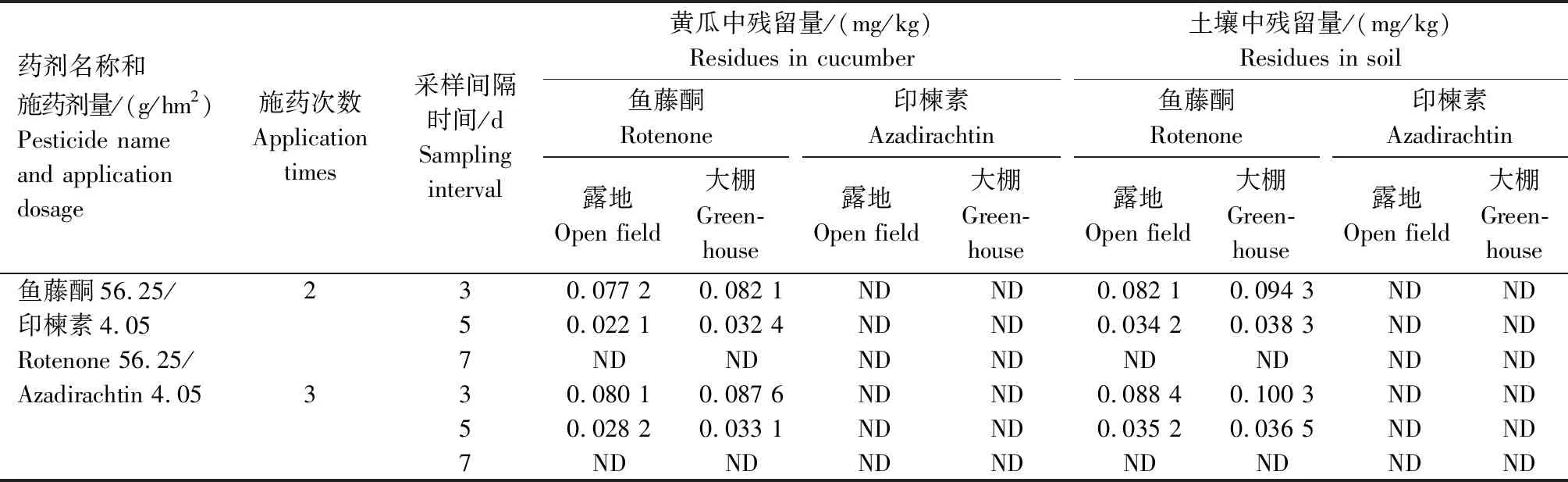
表4 鱼藤酮和印楝素在黄瓜和土壤中的最终残留量Tab.4 Final residues of rotenone and azadirachtin in cucumber and soil

续表4 鱼藤酮和印楝素在黄瓜和土壤中的最终残留量Tab.4(Continued) Final residues of rotenone and azadirachtin in cucumber and soil
3 结论与讨论
本研究建立了黄瓜和土壤中鱼藤酮和印楝素残留的简便检测方法,试验结果表明,黄瓜和土壤中鱼藤酮和印楝素经乙腈提取、Florisil固相萃取柱净化、甲醇定容后,HPLC检测,外标法定量,在0.01、0.1、0.5 mg/kg添加水平下,鱼藤酮和印楝素在黄瓜和土壤中的平均回收率为92.5%~99.5%,相对标准偏差为2.4%~6.9%,鱼藤酮和印楝素在黄瓜和土壤中的最低检出浓度均为0.01 mg/kg,最小检出量均为0.036 ng。由此可见,本研究采用的提取、测定方法能满足鱼藤酮和印楝素在黄瓜和土壤上的分析要求,因HPLC仪器价格较LC-MS低,故适合日常、大批量样品的检测。
鱼藤酮在露地和大棚黄瓜中的原始沉积量分别为0.632 4、0.732 4 mg/kg,土壤中的原始沉积量分别为0.552 4、0.665 1 mg/kg,印楝素在露地和大棚黄瓜中的原始沉积量分别为0.823 6、1.107 2 mg/kg,土壤中的原始沉积量分别为0.328 7、0.376 3 mg/kg;鱼藤酮在黄瓜和土壤中的半衰期分别为1.45、2.36 d(露地) 和1.74、2.62 d(大棚),印楝素在黄瓜和土壤中的半衰期分别为1.11、1.86 d(露地) 和1.36、2.18 d(大棚)。露地黄瓜和土壤中鱼藤酮和印楝素的原始沉积量均分别低于大棚,大棚黄瓜和土壤中的鱼藤酮和印楝素的半衰期均长于露地。这可能是由于在露地条件下施药,风等外力作用使药液发生飘移,进而减少药液在黄瓜和土壤上的原始沉积量,另外,与露地环境相比,大棚内环境相对封闭,空气流通缓慢,施药后药液不易挥发散失,残存农药易吸附或降落到作物表面,加之大棚塑料薄膜隔离光照和雨水,不利于农药的消解,这与丁悦等[21]对啶虫脒的研究结果相吻合。由此看来,露地和大棚不同栽培模式下作物的生长环境不同,农药的消解半衰期也有所差异,用露地环境下所得的最大残留限量(MRL)来指导大棚作物生产存在一定的风险[3,5]。
采收期距最后一次施药3~7 d时,露地和大棚采收的黄瓜样品中鱼藤酮的最高残留量分别为0.136 8、0.203 1 mg/kg,均低于我国规定的鱼藤酮在甘蓝中的MRL值0.5 mg/kg[20]。因此,2.5%鱼藤酮乳油用于露地或大棚黄瓜时,按施药剂量56.25~84.375 g/hm2施药2~3次,安全间隔期为3 d,此时黄瓜中鱼藤酮的残留量符合国家限量标准的要求,其在黄瓜上使用安全。
采收期距最后一次施药3~7 d时,露地和大棚采收的黄瓜和土壤中印楝素的残留量均未检出(即样品中印楝素的残留量低于方法最低检出浓度)。分析其原因可能有二:一是因为0.3%印楝素乳油中印楝素有效成分含量较低,仅0.3%;二是按1.5倍推荐剂量6.075 g/hm2对露地和大棚黄瓜施药,印楝素原始沉积量较低,且消解很快。此外,本研究最初按1.5倍推荐剂量6.075 g/hm2对露地和大棚黄瓜施药,1 d后印楝素的残留量已经低于最低检出浓度而检测不出,为了解印楝素在黄瓜上的残留降解行为,把施药剂量增大到40.50 g/hm2(推荐高剂量的10倍),研究得出印楝素在黄瓜和土壤中的消解半衰期为1.11~2.18 d,这与杨晓云等[14]报道的用2倍推荐剂量对甘蓝施药,6 h后未检出印楝素,当把施药剂量增大10倍,得出印楝素在甘蓝中的消解半衰期为0.89 d的研究结果一致。我国规定印楝素在甘蓝上的MRL值为0.1 mg/kg(临时限量)[22],因此,0.3%印楝素乳油用于露地或大棚黄瓜时,按施药剂量4.05~6.075 g/hm2施药2~3次,推荐安全间隔期为3 d,此时黄瓜中印楝素的残留量符合国家限量标准的要求,其在黄瓜上使用安全。

